для каких целей используют био или онкомаркеры в медицине
Онкомаркеры
Статистика неумолима – заболеваемость раком во всем мире растет с каждым годом. Причин тому огромное множество – это и общее ухудшение экологической ситуации, распространение вредных привычек (курение, алкоголь), употребление канцерогенов в пищу или применение их в быту, старение населения и т.д. Отмечается также тенденция к уменьшению среднего возраста больных, рак «молодеет». К счастью, медицина не стоит на месте, онкология в настоящее время – одно из приоритетных направлений. Современные технологии позволяют диагностировать рак на самых ранних стадиях, а значит существенно увеличить вероятность излечения. Одним из наиболее эффективных способов диагностики онкологических заболеваний в настоящее время является анализ на онкомаркеры.
Что такое онкомаркеры
Онкомаркеры – это особые белки, которые обнаруживаются в крови или моче больных раком. Опухолевые клетки продуцируют и выделяют онкомаркеры в кровь с момента возникновения новообразования, что делает возможным диагностику заболевания на ранних стадиях.
Анализ на онкомаркеры – самый надежный способ обнаружения злокачественной опухоли и возможность оценить эффективность лечения. Рецидив злокачественных заболеваний можно предвидеть за несколько месяцев до начала клинических проявлений. Благодаря специфичности каждого белка можно предположить очаг заболевания.
Отклонение от нормы одних маркеров однозначно свидетельствует о поражении определенных органов (ПСА, сПСА), другие онкомаркеры могут обнаруживаться при различных локализациях опухоли. В этом случае целесообразно провести комплексное обследование. К сожалению, именно поэтому диагностика рака на основе одного только анализа на онкомаркеры не является достоверной.
Анализы на онкомаркеры
Каждое новообразование выделяет строго определенный белок. Известно около 200 соединений, относящихся к опухолевым маркерам, но диагностическую ценность из них имеет не более 20. Наиболее часто проводят анализы на следующие виды онкомаркеров.
Онкомаркер АФП (Альфа-фетопротеин)
АФП сходен по составу с альбумином. У взрослых людей норма АФП обычно находится в пределах 15 нг/мл.
Концентрация выше 10 МЕ(международная единица)/мл считается патологической.
Повышенный уровень АФП может говорить о наличии следующих злокачественных заболеваний:
Тератокарцинома желточного мешка, яичника или яичек (эмбриональный рак)
Уровень АФП может повышаться при некоторых доброкачественных заболеваниях – циррозе печени, хроническом и остром гепатите, хронической почечной недостаточности. При беременности повышение АФП может быть признаком пороков развития плода.
АФП выявляется в плазме крови, амниотической жидкости, желчи, плевральной и асцитической жидкостях.
Онкомаркер Б-2-МГ (Бета-2-микроглобулин)
Онкомаркер Бета-2-микроглобулин можно обнаружить во всех клетках, кроме эритроцитов и клеток трофобласта.
В норме Бета-2-микроглобулин выявляется в моче в очень малых количествах.
Повышение концентрации в крови может говорить о почечной недостаточности.
Показатель этого маркера связан с активностью иммунитета, и может возрастать при любом воспалительном заболевании.
Анализ на Бета-2-микроглобулин назначают при подозрении на:
Рекомендуется учитывать показатель Б-2-МГ при оценке приживаемости после трансплантации органов.
Онкомаркер ПСА (специфический антиген простаты), сПСА (свободный антиген простаты)
ПСА присутствует в здоровой, чрезмерно развитой и трансформированной ткани простаты. Это самый специфичный и чувствительный антиген, позволяющий диагностировать рак предстательной железы.
Для исследования берут кровь (сыворотку или плазму), до биопсии, удаления или массажа простаты, т.к. механическое раздражение железы может вызывать повышение уровня ПСА, сохраняющееся до 3-х недель.
Норма ПСА – 0-4 нг/мл, уровень 10 нг/мл и выше свидетельствует о злокачественном заболевании. При уровне ПСА 4-10 нг/мл желательно определить и сПСА.
Отношение концентрации сПСА к концентрации ПСА, выраженное в процентах имеет диагностическое значение:
Онкомаркер РЭА (раково-эмбриональный антиген)
Онкомаркер РЭА вырабатывается во время беременности клетками пищеварительного тракта плода. У взрослых людей синтез практически полностью подавляется.
Уровень РЭА в норме – содержание в крови не более 0-5 нг/мл.
Уровень РЭА повышается при злокачественных заболеваниях:
Некоторое повышение онкомаркера РЭА возможно при хронической почечной недостаточности, гепатитах и других хронических заболеваниях печени, панкреатите, у курильщиков, а также у больных туберкулезом и аутоиммунными заболеваниями.
Онкомаркер CA 125
СА 125 – стандартный онкомаркер рака яичников. В норме концентрация онкомаркера СА 125 в крови — 0-30 МЕ/мл.
Повышенный уровень CA 125, более 30 МЕ/мл может указывать на злокачественные заболевания:
Повышенная концентрации СА 125 обнаруживается у женщин, больных эндометриозом и аденомиозом (заболевания, при которых клетки, выстилающие внутреннюю поверхность матки, обнаруживаются в других частях организма). Физиологически наблюдается повышение при беременности и во время менструации.
Онкомаркер СА 15-3
Онкомаркер СА 15-3 – специфический онкомаркер рака молочной железы.
В норме уровень СА 15-3 составляет 0-22 ЕД/мл.
Концентрация свыше 30 МЕ/мл говорит о патологии. У 80% женщин, с метастазирующим раком молочной железы уровень маркера повышен.
Онкомаркер СА 15-3 эффективен в определении рецидивов. Некоторое повышение маркера также может наблюдаться во время беременности.
Онкомаркер СА 19-9
Патологической считается концентрация в крови 40 МЕ/мл и выше. СА 19-9 применяется при диагностике и контроле лечения:
Онкомаркер СА 242
Обнаруживается в тех же случаях, что и СА 19-9, но обладает более высокой специфичностью, позволяя определять рак поджелудочной железы, толстой и прямой кишки на самых ранних стадиях.
Это один из основных маркеров, используемых в диагностике. По результатам анализа этого онкомаркера можно спрогнозировать рецидив злокачественных заболеваний желудочно-кишечного тракта за несколько месяцев.
Значения нормы онкомаркера СА 242 — 0-30 МЕ/мл.
ХГЧ (хорионический гонадотропин человека)
Гормон, в норме повышающийся во время беременности, для защиты плода от иммунной системы матери.
Повышение ХГЧ у мужчин и небеременных женщин говорит о злокачественном росте.
Значение нормы ХГЧ: 0-5 МЕ/мл, значения выше 10 МЕ/мл наблюдаются при трофобластических опухолях, хорионкарциномы яичника или плаценты (наиболее чувствителен), раке яичек.
UBC (Urinary Bladder Cancer)
Маркер рака мочевого пузыря. Высокоспецифичный тест, эффективный на ранних стадиях. Определяют UBC в моче, находящейся в мочевом пузыре не менее 3 часов, за норму считается уровень 0,12*10-4 мкг/мкмоль, при злокачественном поражении мочевого пузыря концентрация повышается до 20,1-110,5*10-4 мкг/мкмоль.
Необходимо учитывать, что один онкомаркер может появляться при различных заболеваниях, поэтому для точной диагностики используют комбинацию маркеров. Например, при определении
Еще одной тонкостью является то, что повышенный уровень онкомаркеров не обязательно означает рак. Поэтому биохимические исследования обязательно должны подкрепляться клиническими.
В курсе дела: что такое онкомаркеры?
В последние десятилетия наблюдается стремительный прогресс в онкологии. Произошедшие изменения помогли лучше понять биологию опухоли, позволяя использовать полученные знания на пользу пациентов, хотя, конечно, не так быстро, как бы нам хотелось.
Прогресс этот проявляется по-разному: от ежедневных новостей об открытии новых генов и мутаций, управляющих опухолью, до операций, возвращающих человека к жизни.
Но нам трудно выловить действительно важные новости среди информационного шума. К сожалению, информация о здоровье, которую тиражируют в СМИ, часто содержит ошибки и недостоверные факты.
Микроснимок клеток карциномы (источник: en.wikipedia.org)
Получив плохие вести о своем состоянии или состоянии близких, мы пытаемся найти выход, любую возможность, чтобы исправить сложившуюся ситуацию. Часто в этих попытках мы делаем только хуже, получая бесполезные процедуры и неработающие лекарства.
Недобросовестные клиники пытаются навязать ненужные, а порой и сомнительные диагностические тесты.
В силу своей профессии я часто встречаю людей, которые так или иначе столкнулись с онкологическими заболеваниями. Такие вопросы: «Скажи, куда нам обратиться, чтобы сдать тест на опухоль?» или «А если всей нашей семье сдать онкомаркеры, чтобы заранее знать, что всё в порядке?» — я слышу постоянно.
Давайте попробуем вместе разобраться в одном из самых часто встречающихся вопросов онкологии: что же такое био- и онкомаркеры, когда они нужны, а когда про них лучше совсем забыть?
Микроснимок клеток саркомы (источник: en.wikipedia.org)
Что такое био- и онкомаркеры?
Биомаркеры – это вещества, которые обнаруживаются в жидкостях и тканях больного в количествах, превышающих нормальный уровень здорового человека. Термин онкомаркер, или опухолевый биомаркер, обычно употребляется наравне с биомаркером, но только в онкологии. То есть по определению биомаркер — более широкое понятие.
Откуда онкомаркеры берутся в нашем теле? Они производятся раковыми или другими клетками организма в ответ на развитие опухоли или неопухолевые процессы. Большинство онкомаркеров синтезируются нормальными клетками наравне с опухолевыми, однако уровень их выработки заметно отличается.
Значительная доля онкомаркеров представлена белками и белковыми комплексами с углеводами. Многие биомаркеры хорошо изучены и используются в клинической практике. Некоторые связаны только с одним типом опухоли, тогда как другие могут быть характерны для нескольких опухолей.
Нет универсального опухолевого биомаркера, который можно найти при любом виде рака.
Клетки рака молочной железы (источник: en.wikipedia.org)
Когда мы должны использовать онкомаркеры?
Онкомаркеры используются для постановки диагноза, прогноза, лечения и контроля рецидивов некоторых типов опухолей. Но, несмотря на то, что растущий уровень определённых молекул, синтезируемых клетками нашего организма, предполагает наличие опухоли, этот факт не является достаточным условием для постановки диагноза.
Чтобы поставить диагноз «рак», измерение уровня онкомаркеров необходимо сочетать с другими тестами, например, биопсией.
Кстати, слово «рак» прочно закрепилось за всеми опухолевыми поражениями, хотя оно характерно только для опухолей эпителиальной природы (например, рак лёгких или молочной железы).
Количественные и качественные характеристики онкомаркеров могут одновременно отражать стадию (распространённость) заболевания и определять его прогноз. Помимо этого, часто онкомаркеры измеряют в процессе лечения опухолевого заболевания. Снижение концентрации этих молекул может свидетельствовать о положительном ответе на лечение, а повышение — об устойчивости к лечению, рецидиву и прогрессии опухоли.
Но не всё так просто. Существуют ограничения при использовании онкомаркеров, про которые не часто вспоминают медицинские центры и врачи, предлагающие диагностические и скрининговые тесты на их основе
Например, некоторые неопухолевые заболевания могут вызвать подъём уровня онкомаркеров. И наоборот — не у каждого пациента с определённым типом опухоли будет диагностический уровень молекул. Необходимо понимать диагностическую ценность теста, которая зависит от дискриминационного уровня (cut-off) онкомаркера — то есть количества или качества информации, которую мы будем интерпретировать как клинически значимую.
Эти ограничения не позволяют применять панель биомаркеров на условно здоровых людях, не имеющих жалобы и клинические симптомы.
Срез ткани молочной железы (источник: gdb.rferl.org)
Почему так происходит? Очень важно понимать, что такое чувствительность и специфичность, которые играют ключевую роль в клиническом применении диагностических тестов.
Существует понятие об идеальном онкомаркере. Он выявляет 100% опухолей на ранних этапах (чувствительность) и с вероятностью в 100% определяет только злокачественные новообразования (специфичность). Но до сих пор нет ни одного вещества, которое целиком бы подходило под эти требования.
На диагностическую значимость теста могут оказывать влияние определённые факторы. Например, у человека развивается неспецифическое воспаление, меняющее клеточную активность и имитирующее наличие опухолевого процесса. Или опухоль динамично реагирует на лечение, разрушается, и большое количество онкомаркера попадёт в биологические жидкости, что может способствовать неверной интерпретации.
Нецелесообразное назначение теста на онкомаркеры так же опасно, как применение высокотоксичного лекарства.
Как и какие онкомаркеры используются?
Обычно врач забирает кусочек ткани, кровь, слюну, мочу или другую биологическую жидкость и отсылает её в лабораторию, где с применением различных методов (иммуноферментный анализ, полимеразная цепная реакция, секвенирование) измеряется качественный и/или количественный уровень онкомаркеров в присланном образце.
Если хотят оценить динамику лечения или наличие рецидива, то выполняют измерение уровня онкомаркера в серии образцов в течение определенного отрезка времени, где анализируют повышение, стабилизацию или снижение показателей.
Общепринятых российских рекомендаций по использованию онкомаркеров в клинической практике нет. Мы ориентируемся на опыт западных коллег.
В соответствии с рекомендациями американского общества клинической онкологии (ASCO), National Cancer Institute и National Academy of Clinical Biochemistry в клинической практике используются около 35 биомаркеров. С их помощью диагностируют и следят за течением довольно обширного списка опухолевых патологий.
Со списком этих биомаркеров вы можете ознакомиться по ссылке.
Карта часто используемых онкомаркеров (источник: tumorsemero.blogspot.fr)
Можно ли использовать онкомаркеры для скрининга опухоли?
Сегодня онкомаркеры могут использоваться как критерий опухолевого ответа на лечение, а также для оценки прогноза. Однако исследователи надеются, что в скором времени они будут использовать онкомаркеры и для скрининговых тестов, что может помочь раннему обнаружению опухолей в бессимптомном периоде.
Скрининговые исследования проводятся на людях, которые не имеют жалоб и симптомов заболевания. Скрининговый тест должен обладать необходимой чувствительностью, определяя людей с наличием заболевания и специфичностью, отсекая людей без этого заболевания.
Если тест высокочувствительный, он обнаружит большинство людей с этим заболеванием и покажет наименьшее количество ложноотрицательных результатов.
Пример ложноотрицательного результата (источник: lansinoh.com)
А высокоспецифичный тест гарантирует минимизацию ложноположительных результатов.
Пример ложноположительного результата (источник: davitasource.com)
Хотя опухолевые маркеры крайне полезны в определении ответа на лечение или оценке рецидива заболевания, ни один из них не может самостоятельно использоваться для скрининга, так как сейчас эти тесты имеют недостаточную чувствительность и специфичность.
Для примера возьмем тест ПСА, который определяет уровень простатического специфического антигена в крови, и часто назначается врачами в качестве скринингового теста на рак предстательной железы. У больных раком простаты действительно наблюдается высокий уровень ПСА, однако повышаться уровень этого антигена может и из-за доброкачественных изменений в предстательной железе.
Большинству мужчин с высоким уровнем ПСА повезло – у них нет рака предстательной железы.
В настоящее время результаты теста ПСА могут привести к абсолютно ненужным диагностическим и лечебным манипуляциям у мужчин, не имеющим клинических симптомов, тем самым вызывая осложнения и другие негативные последствия. Каждый мужчина должен индивидуально обсуждать необходимость проведение теста ПСА с лечащим врачом, беря во внимание все возможные плюсы и минусы такого скрининга.
Ещё один онкомаркер, CA-125, который иногда повышается в крови у женщин с раком яичников, также может быть повышен у женщин с доброкачественными процессами в яичнике. И вследствие недостаточной чувствительности и специфичности этого маркера, он используется совместно с трансвагинальным ультразвуковым исследованием.
Интересно, что при анализе 28 потенциальных биомаркеров для рака яичников (в том числе и СА-125), у женщин на поздних стадиях заболевания не определялся ни один из этих биомаркеров.
Резюмируя, можно с уверенностью говорить, что использование онкомаркеров — это палка о двух концах.
Прибегать к тестам следует только под контролем грамотного онколога-профессионала, владеющего современными международными клиническими и научными данными для верной интерпретации в каждом индивидуальном случае.
Оригинал статьи опубликован на сайте Newtonew.
Как распознать рак при помощи биомаркеров?
Как распознать рак при помощи биомаркеров?
Антитела могут служить не только эффективной системой защиты организма от незванных гостей-патогенов, но и позволяют выявить наличие опухоли на ранних стадиях ее развития
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Смертность от злокачественных опухолей — сравнительно молодая проблема, возникшая, когда средняя продолжительность жизни человека существенно увеличилась благодаря многочисленным победам в борьбе с инфекциями. Практически все опухоли можно излечить на ранних стадиях их возникновения, однако обнаружить новообразование, как правило, удается лишь с появлением симптомов, когда помочь пациенту уже нельзя. В данной статье рассказывается об одном из типов биомаркеров, в последнее время активно разрабатывающихся для ранней диагностики рака, — биомаркерах на основе аутоантител.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Подобно вооруженной до зубов армии, иммунная система защищает организм от проникновения чужаков-патогенов. И, как и полагается действующей армии, в ее состав входят различные специализированные подразделения. Разведчики — дендритные клетки — первыми обнаруживают антиген; пограничники — тканевые макрофаги — следят за порядком в барьерных тканях организма; пехота — в первую очередь, нейтрофилы, а следом за ними и Т-, NK- и NKT-клетки — первая поднимается на борьбу с врагом; наконец, снайперы — В-лимфоциты — «стреляют» антителами в потенциального захватчика, а T- и B-клетки памяти, подобно мудрецам-стратегам, запоминают информацию об инфекции для эффективной и немедленной борьбы с ней при повторной атаке [1]. Для них не существует мирного времени — всегда нужно быть готовым снова вступить в бой без промедленья, например, против «предателей» организма — опухолевых клеток (рис. 1).
Рисунок 1. Иммунная система организма — высокопрофессиональная армия, стоящая на пути полчища патогенов
Здравствуй, антитело молодое, незнакомое.
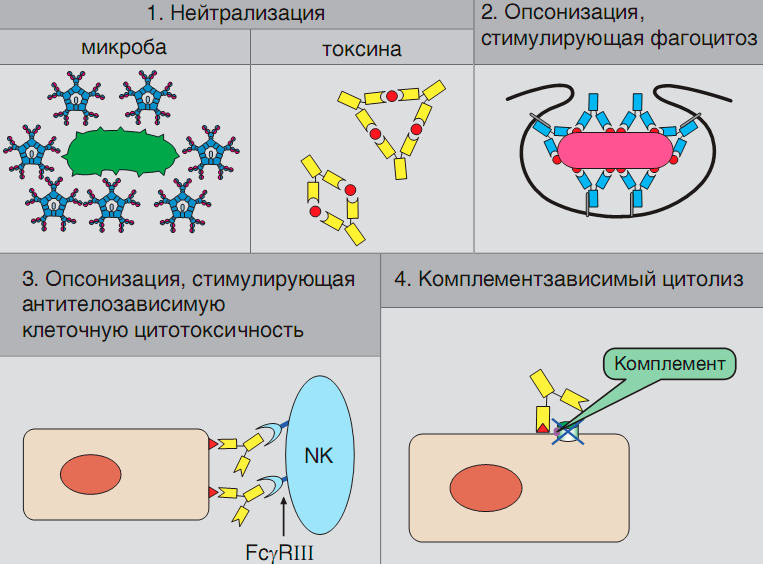
Антитела представляют собой растворимые белки-иммуноглобулины, вырабатываемые так называемыми плазматическими клетками, являющимися конечной стадией дифференцировки B-лимфоцитов и одними из ключевых игроков системы адаптивного (приобретенного) иммунитета. Антигенная стимуляция «наивного» (не встречавшегося с антигеном) B-лимфоцита через B-клеточный рецептор (представляющий собой мембранносвязанную форму антитела) активирует последовательность событий, в результате которых плазматическая клетка оказывается в костном мозге и начинает непрерывно продуцировать большие количества антител, специфичных к конкретному антигену. Участие антител в реализации иммунного ответа может осуществляться как путем прямого действия на молекулы и организмы-носители антигенов, так и косвенно, т. е. путем привлечения дополнительных механизмов (активация системы комплемента, привлечение фагоцитов и т. д.; рис. 2).
Рисунок 2. Основные механизмы действия антител. Нейтрализующее действие антител (вариант 1) проиллюстрировано на примере IgM-антител, блокирующих микроорганизм, и IgG-антител, формирующих иммунный комплекс с токсином. Варианты 2 и 3 (опсонизация, усиливающая фагоцитоз, и стимуляция цитотоксической активности NK-клеток) реализуются через взаимодействие иммуноглобулинов с Fcγ-рецепторами клеток. Взаимодействие с антигеном (вариант 4) открывает комплементсвязывающие участки IgG-антител, что приводит к запуску комплемента по классическому пути и лизис или опсонизацию клеток-мишеней.
Процесс формирования репертуара B-клеток обязательно включает в себя происходящую в костном мозге «негативную селекцию», в ходе которой из всего множества незрелых B-лимфоцитов удаляются клетки, несущие на своей поверхности B-клеточный рецептор, способный связывать собственные антигены организма (аутоантигены). Этот процесс крайне важен, поскольку он служит залогом того, что мишенями для антител не станут клетки организма-хозяина. Тем не менее, эффективность негативной селекции не является стопроцентной, и в реальности остается большое количество «аутореактивных» (т.е., способных распознавать аутоантигены) B-клеток. В норме данный феномен не оказывает негативного воздействия на организм, поскольку на пути к активации аутореактивной B-клетки лежит целый спектр дополнительных регуляторных барьеров. Тем не менее, иногда аутореактивным клеткам удается преодолеть все препятствия, и это может привести к инициированию аутоиммунного процесса, лежащего в основе всех аутоиммунных заболеваний. Этот же сценарий может развиваться и в случае образования опухоли. Опухолевые клетки, как правило, характеризуются целым спектром нарушений белковых молекул, которые могут быть обнаружены системой адаптивного иммунитета и проявляться в том числе наличием циркулирующих аутоантител к нормальным либо тем или иным образом модифицированным опухолевым белкам (называемым в данном случае опухолеассоциированными аутоантигенами). Последние включают в себя мутантные, неправильно свернутые или гликозилированные, сверхэкспрессированные белки или же белки с эктопической экспрессией, т.е. экспрессируемые опухолью, но не нормальной тканью того же происхождения/анатомической локализации. Источниками антигенов в опухолевой ткани также могут являться белки со скрытыми эпитопами, экспонирующимися в ходе опухолеспецифичного протеолиза.
Рак и ты: кто кого?
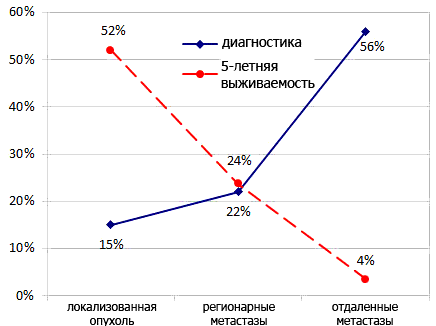
Злокачественные новообразования — бич современного человечества. Антибиотики, вакцины [4], лекарственные препараты, иммунные сыворотки и т.д. сделали возможным лечение и предупреждение огромного количества болезней, пандемии которых в прошлом уносили миллионы жизней (чума [2], [5], холера, оспа, сибирская язва и др.; рис. 3). Средняя продолжительность жизни человека увеличилась, и наиболее частой причиной смерти стали сердечнососудистые заболевания и опухоли (25 и 23% от общего числа умерших в год, соответственно, по данным на 2008 г. [6]). Средняя пятилетняя выживаемость пациентов с диагностированными опухолями легкого (первое место по частоте встречаемости у мужчин и второе после рака молочной железы у женщин) составляет 16,3%. Однако, если проанализировать данные по выживаемости отдельно для каждой из стадий диагностированной опухоли, то окажется, что обнаружение новообразования на стадии локализованной опухоли дает 52% выживаемости, а на стадии регионарных и отдаленных метастазов — 24% и 4%, соответственно [7] (рис. 4). Таким образом, наиболее перспективным путем снижения смертности от злокачественных новообразований является разработка и внедрение новых методов их ранней диагностики, наиболее многообещающим из которых является неинвазивное или малоинвазивное выявление биомаркеров опухоли (онкомаркеров) в крови, моче, слюне, бронхоальвеолярной жидкости, мокроте и опухолевой ткани пациента.
Рисунок 3. На сегодняшний день человечество справилось с такими болезнями, как чума и холера, в предыдущие века уносившими миллионы жизней. Картинка: гравюра по дереву «Танец смерти». Mich. Wohlgemuth, 1493.
Рисунок 4. Диагностика рака легкого и выживаемость пациентов по стадиям, 2001–2007 гг.
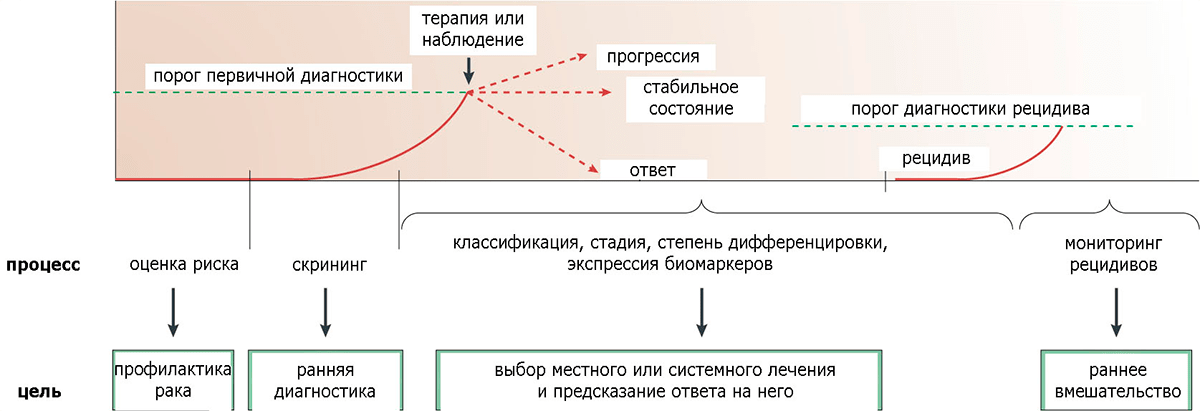
Онкомаркеры (в роли которых может выступать «молекулярный свидетель» наличия опухоли в организме практически любой природы, будь то белок, нуклеиновая кислота или липид) используются для диагностики злокачественных новообразований, их классификации и стадирования, мониторинга рецидивов, а также для оценки прогноза и выбора методики лечения (рис. 5). Аутоантитела, специфичные к опухолеассоциированным аутоантигенам, могут быть использованы практически в любом из вышеуказанных случаев и, в отличие от традиционных биомаркеров, характеризуются целым рядом важных преимуществ, таких как:
Рисунок 5. Схематическое представление использования биомаркеров на разных стадиях опухолевой прогрессии
Аутоантитела для диагностики — новое решение старых проблем!
Примером успешного применения аутоантител в диагностике злокачественных новообразований могут служить аутоантитела против опухолевого супрессора p53 [9], который часто мутирован в различных типах новообразований человека. Мутации приводят к нарушению третичной структуры белка, и в результате этого многие скрытые эпитопы становятся доступными для презентации их В- и Т-клеткам иммунной системы. Анти-p53 антитела в сыворотке крови рабочих, подвергшихся воздействию винилхлорида, детектируются до клинического диагноза ангиосаркомы печени [10], а у пациентов с хронической обструктивной болезнью легких — до клинического диагноза рака легкого [11]. Некоторые исследования продемонстрировали корреляцию между наличием у пациентов анти-p53 аутоантител и выживаемостью (рак яичников, колоректальный рак и рак легкого); при этом в большинстве случаев регистрация аутоантител против p53 была ассоциирована с неблагоприятным прогнозом.
Нельзя не упомянуть об онконевральных антителах — аутоантителах, специфичных к нейрональным антигенам — белкам, в норме экспрессирующимся только в нервной ткани, однако в силу различных генетических нарушений начинающих продуцироваться в опухолевой ткани, вызывая так называемый паранеопластический синдром (ассоциированное с опухолью патологическое состояние, характеризующееся аутоиммунным поражением различных отделов нервной системы). В качестве примера таких антигенов можно привести белки HuB, HuC и HuD (human antigens B, C, D), которые в норме экспрессируются во всех нейронах, а также при мелкоклеточном раке легкого, раке простаты и нейробластоме, и CDR2, в норме экспрессирующийся только в нейронах Пуркинье и ассоциированный с такими типами рака, как рак молочной железы, яичников и мелкоклеточный рак легкого. Онконевральные антитела обнаруживаются у большей части пациентов с паранеопластическим синдромом, и было показано, что их появление четко и независимо коррелирует с развитием в организме пациента злокачественного новообразования [12]. В настоящее время по наличию тех или иных онконевральных антител можно судить о преимущественной локализации опухолевого очага, который в силу своих малых размеров не был обнаружен в ходе первичного осмотра пациента [13].
Другим примером биомаркеров антительной природы являются аутоантитела против раково-семенниковых (раково-гаметных) антигенов [14]. Они экспрессируются в широком спектре новообразований (меланома, рак яичников, рак легкого), но не в нормальных тканях организма, за исключением мужских семенников. Аберрантная экспрессия этих белков приводит к развитию на них Т-клеточного и/или B-клеточного ответа, т.е. к появлению аутоантител в кровотоке больного. Наиболее известными представителями данного семейства опухолеассоциированных аутоантигенов являются MAGE-1 (он был первым найденным антигеном этой группы), NY-ESO1, MAGE-3 и SSX2.
Пожалуй, наиболее ярким успехом в области разработки аутоантительных биомаркеров является диагностикум EarlyCDT-Lung, основу которого представляют антитела против семи опухолеассоциированных антигенов, созданный в 2007 году и уже успешно применяющийся для выявления рака легкого на его ранних стадиях. В данной панели присутствуют раково-семенниковые антигены (NY-ESO-1, CAGE, MAGE A4), опухолевый супрессор p53, транскрипционный фактор SOX2, онконевральный антиген HuD и GBU4-5 — белок, функция которого в клетке до сих пор плохо изучена. Интересно, что состав антигенной панели менялся в процессе разработки в сторону более высокой чувствительности и специфичности, которые в конечном счете удалось поднять до 41% и 91%, соответственно. Рутинным тестом для обнаружения карцином легкого на Западе является компьютерная томография (КТ), однако было показано, что EarlyCDT-Lung диагностикум справляется с этой задачей лучше. КТ в силу разрешающей способности метода может не дать достоверных результатов при наличии у пациента опухоли с малыми линейными размерами, тогда как адаптивный иммунный ответ, формирующийся на опухолеассоциированные аутоантигены, может быть детектирован на самых ранних этапах развития новообразования.
Поиск антител против опухолеассоциированных аутоантигенов и разработка диагностикумов на их основе на сегодняшний момент являются одной из многообещающих ветвей современной диагностической онкоиммунологии. Простота исполнения и дешевизна, а, следовательно, доступность широкому кругу лиц, в будущем делает возможным применение таких диагностикумов в рамках планового медицинского обследования граждан, что является залогом своевременного обнаружения опухоли и полного выздоровления больного.
Вот так иммунная система не только стоит на страже организма, препятствуя развитию патогенов и опухолей, но и помогает исследователям находить все новые и новые методы диагностики различных заболеваний, — в частности, опухолей. Стрелы-антитела, прицельно пущенные В-клетками в мятежников, позволяют врачам найти и обезвредить последних, продлив тем самым жизнь пациента на долгие-долгие годы.