для каких реакций применим термин химическое равновесие
Химическое равновесие
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическое равновесие
Обратимые и необратимые реакции
Химическое равновесие присуще обратимым реакциям и не характерно для необратимых химических реакций.
Часто, при осуществлении химического процесса, исходные реагирующие вещества полностью переходят в продукты реакции. Например:
Невозможно получить металлическую медь, проводя реакцию в обратном направлении, т.к. данная реакция необратима. В таких процессах реагенты полностью переходят в продукты, т.е. реакция протекает до конца.
Но основная часть химических реакций обратима, т.е. вероятно параллельное протекание реакции в прямом и обратном направлениях. Иначе говоря, реагенты лишь частично переходят в продукты и реакционная система будет состоять как из реагентов, так и из продуктов. Система в данном случае находится в состоянии химического равновесия.
При обратимых процессах, вначале прямая реакция имеет максимальную скорость, которая постепенно снижается, в связи с уменьшением количества реагентов.
Обратная реакция, наоборот, вначале имеет минимальную скорость, которая увеличивается по мере накапливания продуктов.
В конце концов, наступает момент, когда скорости обоих реакций становятся равными – система приходит в состояние равновесия.
При наступлении состояния равновесия, концентрации компонентов остаются неизменными, но химическая реакция при этом не прекращается.
Т.о. химическое равновесие – это динамичное (подвижное) состояние.
Для наглядности, приведем следующий рисунок:
Допустим, протекает некая обратимая химическая реакция:
а А + b В = с С + d D
тогда, исходя из закона действующих масс, запишем выражения для скорости прямой υ1 и обратной υ2 реакций:
В состоянии химического равновесия, скорости прямой и обратной реакции равны, т.е.:
Для любого обратимого процесса, при заданных условиях константа равновесия K является величиной постоянной. Она не зависит от концентраций веществ, т.к. при изменении количества одного из веществ, количества других компонентов также меняются.
При изменении условий протекания химического процесса, возможно смещение равновесия.
Принцип Ле-Шателье
Все вышеперечисленные факторы влияют на смещение химического равновесия, которое подчиняется принципу Ле-Шателье:
если изменить одно из условий, при котором система находится в состоянии равновесия – концентрацию, давление или температуру, — то равновесие сместится в направлении той реакции, которая противодействует этому изменению.
Т.е. равновесие стремится к смещению в направлении, приводящему к уменьшению влияния воздействия, которое привело к нарушению состояния равновесия.
Итак, рассмотрим отдельно влияние каждого их факторов на состояние равновесия.
Факторы, влияющие на смещение химического равновесия:
Рассмотрим каждый фактор, влияющий на смещение равновесия подробнее:
Влияние изменения концентраций реагентов или продуктов
покажем на примере процесса Габера:
Если в равновесную систему, состоящую из N2(г), H2(г) и NH3(г), добавить, например, азот, то химическое равновесие должно сместиться в направлении, которое способствовало бы уменьшению количества водорода в сторону его исходного значения, т.е. в направлении образования дополнительного количества аммиака (вправо). При этом одновременно произойдет и уменьшение количества водорода.
При добавлении в систему водорода, также произойдет смещение равновесия в сторону образования нового количества аммиака (вправо). Тогда как внесение в равновесную систему аммиака, согласно принципу Ле-Шателье, вызовет смещение равновесия в сторону того процесса, который благоприятен для образования исходных веществ (влево), т.е. концентрация аммиака должна уменьшится посредством разложения некоторого его количества на азот и водород.
Уменьшение концентрации одного из компонентов, сместит равновесное состояние системы в сторону образования этого компонента.
Влияние изменения давления
Влияние изменения давления имеет смысл, если в исследуемом процессе принимают участие газообразные компоненты и при этом имеет место изменение общего числа молекул. Если общее число молекул в системе остается постоянным, то изменение давления не влияет на ее равновесие, например:
Если полное давление равновесной системы увеличивать посредством уменьшения ее объема, то равновесие сместится в сторону уменьшения объема. Т.е. в сторону уменьшения числа молей газа в системе. В реакции:
из 4 молеул газа (1 N2(г) и 3 H2(г)) образуется 2 молекулы газа (2 NH3(г)), т.е. давление в системе уменьшается. Вследствие чего, рост давления будет способствовать образованию дополнительного количества аммиака, т.е. химическое равновесие сместится в сторону его образования (вправо).
Если температура системы постоянна, то изменение полного давления системы не приведет к изменению константы равновесия К.
Влияние изменения температуры системы
Изменение температуры влияет не только на смещение ее равновесия, но также и на константу равновесия К.
Если равновесной системе, при постоянном давлении, сообщать дополнительную теплоту, то химическое равновесие сместится в сторону поглощения теплоты.
Итак, как видно, прямая реакция протекает с выделением теплоты, а обратная – с поглощением.
При увеличении температуры, равновесие этой реакции смещается в сторону реакции разложения аммиака (влево), т.к. она является эндотермической и ослабляет внешнее воздействие – повышение температуры.
Напротив, охлаждение приводит к смещению равновесия в направлении синтеза аммиака (вправо), т.к. реакция является экзотермической и противодействует охлаждению.
Таким образом, повышение температуры благоприятствует смещению химического равновесия в сторону эндотермической реакции, а падение температуры – в направлении экзотермического процесса.
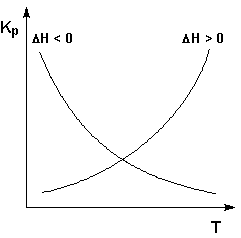
Константы равновесия всех экзотермических процессов при росте температуры уменьшаются, а эндотермических процессов – увеличиваются.
Влияние катализатора
Внесение катализатора в систему приводит к тому, что скорости как прямой, так и обратной реакций увеличиваются. Изменяется скорость приближения к состоянию равновесия, но k при этом не меняется.
Принцип Ле-Шателье также применим к таким реакциям, в которых компоненты находятся в различных фазовых состояниях, т.е. к гетерогенным реакциям. Тогда речь будет идти о гетерогенном равновесии, например:
В этой реакции газ и два твердых вещества находятся между собой в равновесии, и «концентрации» твердых компонентов остаются неизменными. Обычно «концентрации» твердых и жидких компонентов включаются в значение К, что позволяет не учитывать их при написании выражения для константы равновесия:
Это выражение показывает нам, что не важно, какое количество CaCO3(тв) и CaO(тв) содержится в равновесной системе, пока в ней присутствует хотя бы незначительное количество любого из этих веществ.
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении:
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄):
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
Для каких реакций применим термин химическое равновесие
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
1.7 ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Как было показано выше, протекание самопроизвольного процесса в термодинамической системе сопровождается уменьшением свободной энергии системы (dG 2 Y > 0. Таким образом, условием термодинамического равновесия в закрытой системе является минимальное значение соответствующего термодинамического потенциала :
Изобарно-изотермические (P = const, T = const):
Изохорно-изотермические (V = const, T = const):
Состояние системы с минимальной свободной энергией есть состояние термодинамического равновесия:
Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
Учение о равновесных состояниях – один из разделов термодинамики. Далее мы будем рассматривать частный случай термодинамического равновесного состояния – химическое равновесие. Как известно, многие химические реакции являются обратимыми, т.е. могут одновременно протекать в обоих направлениях – прямом и обратном. Если проводить обратимую реакцию в закрытой системе, то через некоторое время система придет в состояние химического равновесия – концентрации всех реагирующих веществ перестанут изменяться во времени. Необходимо отметить, что достижение системой состояния равновесия не означает прекращения процесса; химическое равновесие является динамическим, т.е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью. Химическое равновесие является подвижным – всякое бесконечно малое внешнее воздействие на равновесную систему вызывает бесконечно малое изменение состояния системы; по прекращении внешнего воздействия система возвращается в исходное состояние. Ещё одним важным свойством химического равновесия является то, что система может самопроизвольно прийти в состояние равновесия с двух противоположных сторон. Иначе говоря, любое состояние, смежное с равновесным, является менее устойчивым, и переход в него из состояния равновесия всегда связан с необходимостью затраты работы извне.
Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С, парциальные давления P или мольные доли X реагирующих веществ. Для некоторой реакции
соответствующие константы равновесия выражаются следующим образом:
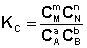
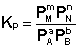
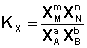
Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры. Выражение для константы равновесия для элементарной обратимой реакции может быть выведено из кинетических представлений.
Рассмотрим процесс установления равновесия в системе, в которой в начальный момент времени присутствуют только исходные вещества А и В. Скорость прямой реакции V1 в этот момент максимальна, а скорость обратной V2 равна нулю:
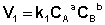
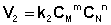
По мере уменьшения концентрации исходных веществ растет концентрация продуктов реакции; соответственно, скорость прямой реакции уменьшается, скорость обратной реакции увеличивается. Очевидно, что через некоторое время скорости прямой и обратной реакции сравняются, после чего концентрации реагирующих веществ перестанут изменяться, т.е. установится химическое равновесие.
Приняв, что V1 = V2, можно записать:
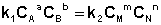
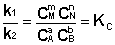
Т.о., константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л.
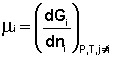
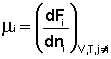
Химический потенциал компонента связан с его парциальным давлением или концентрацией следующими соотношениями:
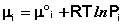
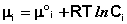
Здесь μ°i – стандартный химический потенциал компонента (Pi = 1 атм., Сi = 1 моль/л.). Очевидно, что изменение свободной энергии системы можно связать с изменением состава системы следующим образом:
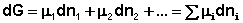
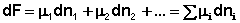
Поскольку условием равновесия является минимум свободной энергии системы (dG = 0, dF = 0), можно записать:
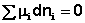
В закрытой системе изменение числа молей одного компонента сопровождается эквивалентным изменением числа молей остальных компонентов; т.е., для приведенной выше химической реакции имеет место соотношение:
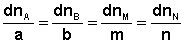
Отсюда можно получить следующее условие химического равновесия в закрытой системе:
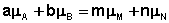
В общем виде условие химического равновесия можно записать следующим образом:
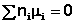
Выражение (I.94) носит название уравнения Гиббса – Дюгема. Подставив в него зависимость химического потенциала от концентрации, получаем:
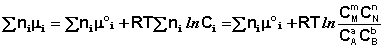
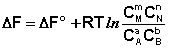
Для изобарно-изотермического процесса аналогичным образом можно получить:
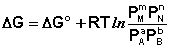
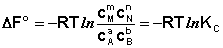
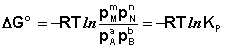
Здесь сi и рi – равновесные концентрации и парциальные давления исходных веществ и продуктов реакции (в отличие от неравновесных Сi и Рi в уравнениях I.96 – I.97).
Поскольку для каждой химической реакции стандартное изменение термодинамического потенциала ΔF° и ΔG° есть строго определенная величина, то произведение равновесных парциальных давлений (концентраций), возведенных в степень, равную стехиометрическому коэффициенту при данном веществе в уравнении химической реакции (стехиометрические коэффициенты при исходных веществах принято считать отрицательными) есть некоторая константа, называемая константой равновесия. Уравнения (I.98, I.99) показывают связь константы равновесия со стандартным изменением свободной энергии в ходе реакции. Уравнение изотермы химической реакции связывает величины реальных концентраций (давлений) реагентов в системе, стандартного изменения термодинамического потенциала в ходе реакции и изменения термодинамического потенциала при переходе из данного состояния системы в равновесное. Знак ΔG (ΔF) определяет возможность самопроизвольного протекания процесса в системе. При этом ΔG° (ΔF°) равно изменению свободной энергии системы при переходе из стандартного состояния (Pi = 1 атм., Сi = 1 моль/л) в равновесное. Уравнение изотермы химической реакции позволяет рассчитать величину ΔG (ΔF) при переходе из любого состояния системы в равновесное, т.е. ответить на вопрос, будет ли химическая реакция протекать самопроизвольно при данных концентрациях Сi (давлениях Рi) реагентов:
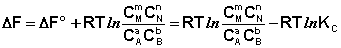
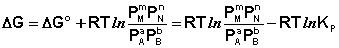
Если изменение термодинамического потенциала меньше нуля, процесс в данных условиях будет протекать самопроизвольно.
1.7.1 Влияние внешних условий на химическое равновесие
При постоянстве внешних условий система может находиться в состоянии равновесия сколь угодно долго. Если изменить эти условия (т.е. оказать на систему какое-либо внешнее воздействие), равновесие нарушается; в системе возникает самопроизвольный процесс, который продолжается до тех пор, пока система опять не достигнет состояния равновесия (уже при новых условиях). Рассмотрим, как влияют на положение равновесия некоторые факторы.
1.7.2 Влияние давления и концентрации
Рассмотрим несколько возможных случаев смещения равновесия.
1. В систему добавлено исходное вещество. В этом случае
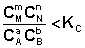
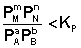
По уравнению изотермы химической реакции (I.100 – I.101) получаем: ΔF 0; ΔG > 0. Химическое равновесие будет смещено влево (в сторону расходования продуктов реакции и образования исходных веществ).
3. Изменено общее давление (для реакций в газовой фазе).
Парциальные давления всех компонентов Рi в этом случае изменяются в одинаковой степени; направление смещения равновесия будет определяться суммой стехиометрических коэффициентов Δn.
Учитывая, что парциальное давление газа в смеси равно общему давлению, умноженному на мольную долю компонента в смеси (Рi = РХi), изотерму реакции можно переписать в следующем виде (здесь Δn = Σ(ni) прод – Σ(ni) исх):
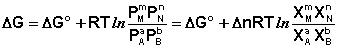
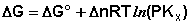
Примем, что Р2 > Р1. В этом случае, если Δn > 0 (реакция идет с увеличением числа молей газообразных веществ), то ΔG > 0; равновесие смещается влево. Если реакция идет с уменьшением числа молей газообразных веществ (Δn изобару Вант-Гоффа :
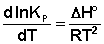
Рассуждая аналогичным образом, для процесса, проходящего в изохорных условиях, можно получить изохору Вант-Гоффа :
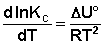
Изобара и изохора Вант-Гоффа связывают изменение константы химического равновесия с тепловым эффектом реакции в изобарных и изохорных условиях соответственно. Очевидно, что чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры.
Экзотермические реакции: ΔH° 0 (ΔU° > 0). В этом случае температурный коэффициент логарифма константы равновесия положителен; повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо).
Графики зависимостей константы равновесия от температуры для экзотермических и эндотермических реакций приведены на рис. I.4.
Рис. 1.4 Зависимость константы равновесия от температуры.
Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
Принцип Ле Шателье – Брауна является одним из следствий второго начала термодинамики и применим к любым макроскопическим системам, находящимся в состоянии истинного равновесия.