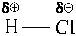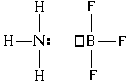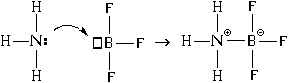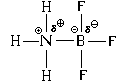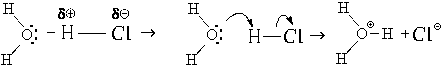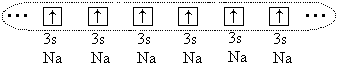донорно акцепторный механизм у каких соединений
Химические связи
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
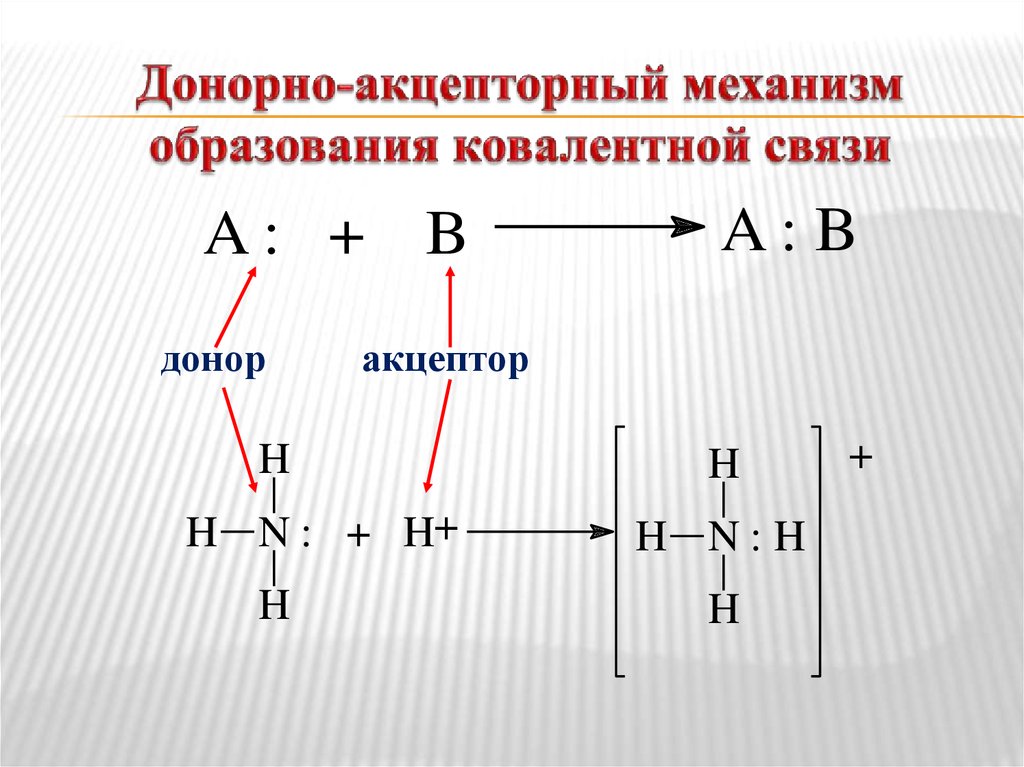
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Донорно-акцепторный механизм образования химической связи предполагает перенос заряда между акцептором и донором без создания между ними общей химической связи. Также возможна передача неподеленной пары электронов к акцептору от донора, в результате образуется связь.
Образование солей аммония
Рассмотрим донорно-акцепторный механизм на примере солей аммония. Начнем со взаимодействия аммиака (NH3) и трифторида бора (BF3). В процессе реакции происходит выделение 171,4 кДж/моль энергии. Взаимодействие протекает по уравнению:
Из четырех орбиталей, имеющихся у атома бора, три заполнены электронами, следовательно, есть одна вакантная орбиталь. В молекуле аммиака четыре орбитали азота укомплектованы электронами, причем три из них по обменному механизму дополнены электронами водорода. Одна орбиталь имеет электронную пару, принадлежащую только атому азота. Ее называют неподеленной электронной парой. Именно благодаря ей возможен донорно-акцепторный механизм.
Соединение между аммиаком и трифторидом бора возможно благодаря тому, что вакантная электронная пара аммиака размещается на свободной орбитали фторида бора.
Это донорно-акцепторный механизм образования ковалентной связи. Атом азота увеличивает валентность благодаря использованию неподеленной пары электронов для дополнительной связи. Бор повышает валентность посредством расположения на орбитали дополнительных электронов.
Таким образом, валентность этих химических элементов характеризуется и неспаренными электронами, и неподеленными электронными парами, и свободными орбиталями на внешнем энергетическом уровне.
Определения
Донором в данном примере выступает атом азота, который отдает свою электронную пару на образование химической связи. Акцептором является бор, обладающий вакантной орбиталью, принимающий электронную пару.
Процесс сопровождается уменьшением потенциальной энергии данной системы, выделением эквивалентного количества энергии. Вопросы, касающиеся механизма образования данного вида ковалентной связи, включены в курс школьной программы по химии, они предлагаются в итоговых тестах выпускникам средней общеобразовательной школы.
Образование катиона аммония
Ковалентная связь, образованная по донорно акцепторному механизму, характерна для солей аммония. Остановимся подробнее на ее особенностях. Итак, именно по донорно-акцепторному механизму образована связь между атомами азота и водорода в реакции:
В качестве акцептора выступает пустая орбиталь катиона водорода. Азот в катионе аммония проявляет валентность 4. Образование связи происходит и благодаря паре электронов, которые до начала взаимодействия принадлежали азоту.
Это связь ковалентная по донорно-акцепторному механизму. В итоге взаимодействия образуется катион аммония, который по ионному механизму будет объединяться с анионами, содержащимися в кислотах.
Образование угарного газа
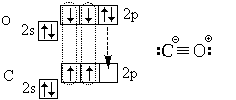
Донорно-акцепторный механизм можно рассмотреть на примере молекулы СО. У атома углерода на внешнем энергетическом уровне располагаются два неспаренных электрона. Такое же количество неспаренных электронов есть и у атома кислорода. В результате между атомами образуется двойная связь.
За счет пары электронов кислорода и пустой орбитали углерода, для получения связи используется донорно-акцепторный механизм.
Молекула азотной кислоты
Благодаря наличию трех неспаренных электронов атом азота в данном соединении образует три варианта связей: с кислородом двойную, одинарную с кислородом гидроксильной группы. По донорно-акцепторному механизму образована связь между еще одним атомом кислорода и азота.
Неспаренные электроны размещаются на одной орбитали, при этом одна освобождается.
Также можно допустить, что атомом азота отдан кислороду электрон. Превратившись в катион аммония, имеющий 4 неспаренные электрона, он удерживает анион благодаря силам электростатического взаимодействия.
Свойства связи
В качестве донора выступают молекулы, в составе которых есть атомы N, O, F, Cl, связанные с атомами иных химических элементов. Акцептором выступает частица, имеющая вакантные электронные уровни. К примеру, это могут быть представители d-семейств, которые имеют незаполненные d-орбитали.
В молекуле аммиака для образования связи задействованы три неспаренных электрона атома азота, и по 1s-электрону у трех атомов водорода. Связи находятся вдоль трех осей р-орбиталей. Молекула имеет вариант правильной пирамиды, в углах которой располагаются атомы водорода, а в вершине — азот азота. Угол между связями составляет 107 градусов. Аналогичные по форме молекулы образуют с водородом следующие элементы: сурьма, мышьяк, фосфор.
Свойства ковалентной связи, которая образуется по донорно-акцепторному механизму, не отличаются от характеристик связи, сформированной по обменному механизму. В качестве доноров могут выступать атомы азота, серы, фосфора, кислорода, владеющие неподеленными электронными парами на валентных орбиталях небольшого размера.
Также акцепторами выступают d-элементы, у которых есть незаполненная энергетическая ячейка во внешнем электронном слое.
Отметим, что на данный механизм образования связи распространяются все основные характеристики: насыщаемость, длина, кратность.
Особенности органических соединений
Взаимодействие по обменному механизму возможно для органических доноров. В частности, среди них можно отметить π-доноров, типичным примером которых является тетракис(диметиламино)этилене (ТДАЭ), органические акцепторы (фуллерены), хинодиметаны с акцепторными заместителями.
При химическом взаимодействии подобных соединений создается комплекс с переносом заряда. В нем заряженный положительно донор с отрицательно заряженным акцептором взаимодействуют благодаря силам электростатической природы. Значение имеют системы, в которых перенос заряда в основном электронном состоянии происходит частично, а в случае фото возбуждения наблюдается полная его передача.
Такие системы, донорно-акцепторные диады, триады, внутри которых между акцептором и донором есть мостиковая группа, позволяющая повышать длительность состояния с переносом электрического заряда, применяются для получения устройств, преобразующих солнечную энергию. Подобное явление, связанное с переносом заряда в любых его формах, применяется во многих биологических процессах.
Именно поэтому так подробно рассматриваются особенности протекания взаимодействий по донорно-акцепторному механизму в органических соединениях, анализируются возможности ускорения (замедления) подобных процессов, варианты введения дополнительных веществ (катализаторов).
Подведем некоторые итоги
Донорно-акцепторное взаимодействие является одним из важнейших проявлений ковалентной полярной химической связи. Ему уделяется существенное внимание в неорганической, аналитической, органической химии.
К примеру, именно с точки зрения донорно-акцепторного механизма поясняется образование ковалентных локализованных связей в молекулярных ионах координационных (комплексных) соединений. Связь в них создается благодаря неподеленной паре электронов лиганда и свободной орбитали комплексообразователя. Также донорно-акцепторный механизм поясняет формирование промежуточных продуктов. В частности, это создание комплексов с переносом заряда.
Существует модель донорно-акцепторного механизма лишь в рамках представлений о валентности как о возможности локализации плотности электронов в процессе формирования ковалентных связей. Именно этот механизм является основой образования разнообразных комплексных соединений. Такое взаимодействие необходимо для кислотно-основных превращений, касающихся переноса иона водорода (акцептора), образования наноструктур.
Донорно-акцепторный VS Обменный механизм
Для сдачи ЕГЭ Вам необходимо знать два механизма образования связей: обменный и донорно-акцепторный.
Обменный механизм
Обменный механизм возможен за счет создания общей электронной пары.
Обменный механизм характерен для ковалентной связи.
Рассмотрим на примерах.
Молекула аммиака
Азот имеет три неспаренных электрона на внешнем электронном слое.
Изобразим их вот так:
У водорода также имеется неспаренный электрон.
Одна связь — это пара электронов. Если объединить два электрона, то образуется одна химическая связь.
В данном случае мы можем создать три пары электронов:
Заменим точки на связи.
Молекула аммиака готова! 🙂
Молекула углекислого газа
Напишем электронную конфигурацию углерода.
Углерод в углекислом газе проявляет валентность IV, а значит двух неспаренных электронов для образования связи нам не хватит, поэтому запишем углерод в возбужденном состоянии.
Теперь мы видим 4 неспаренных электрона, при помощи которых углерод может образовать 4 связи.
Запишем электронную конфигурацию кислорода.
Кислород имеет два неспаренных электрона (в возбужденное состояние переходить не может), соответственно проявляет валентность II с своих соединениях.
Запишем схему образования связей в оксиде углерода (IV)
Заменим электронные пары на связи:
А как появляются заряды?
На самом деле электронные пары находятся не ровно между атомами элементов. А всегда смещены к наиболее электроотрицательному.
Так, перетягивая на себя электронную пару, атом приобретает отрицательный заряд. Например, в молекуле HCl электронная пара смещена к хлору, который приобретает отрицательный заряд, а водород положительный. Такая связь называется ковалентной полярной.
Если же разница между электроотрицательностями атомов очень велика, то более электроотрицательный атом забирает себе недостающий электрон, образуя ионную связь. Примерами таких соединений являются: NaF, KCl, LiBr и т.д.
Напомню, что самым электроотрицательным элементом является фтор и он никогда не отдаст свой электрон.
Донорно-акцепторный механизм
Донорно-акцепторная связь образуется за счет неподеленной электронной пары одного атома (донора) и вакантной орбитали другого атома (акцептора).
Связи, образованные по донорно-акцепторному механизму, присутствуют в: катионе аммония, комплексах, солях аминов.
Рассмотрим на примерах.
Катион аммония
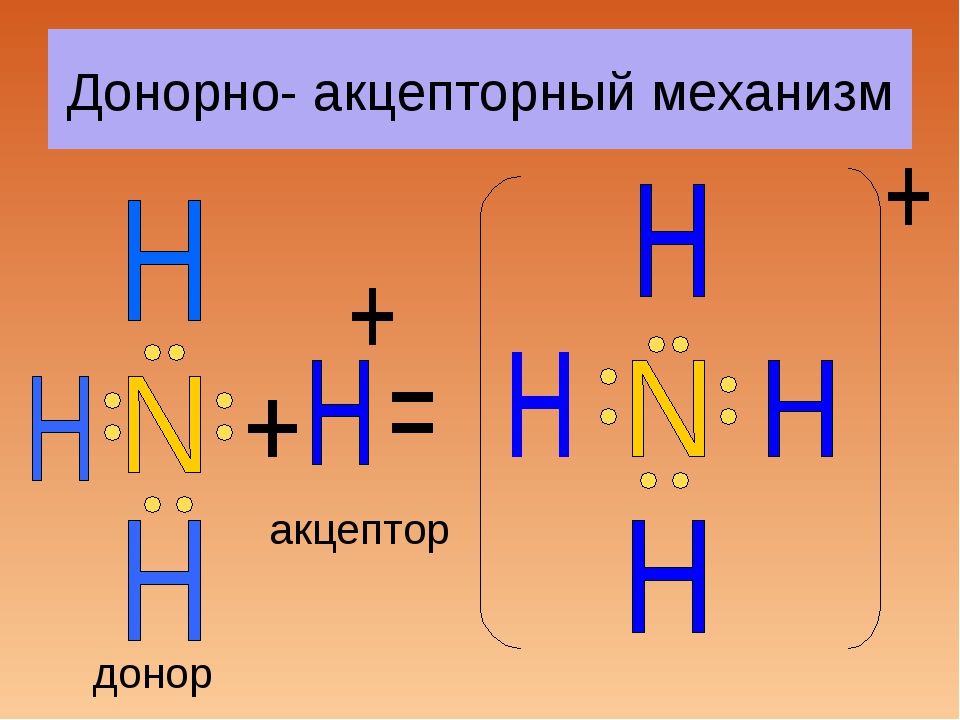
Выше мы рассмотрели образование молекулы аммиака. Три связи образуются по обменному механизму, а откуда берется четвертая?
У азота на внешнем слое есть неподеленная электронная пара, именно за счет неё азот образует четвертую связь по донорно-акцепторному механизму.
С парой то всё понятно, а откуда берется орбиталь, у водорода ведь один неспаренный электрон!
Все верно, но для того, чтобы водород стал акцептором, ему необходимо перейти в соответствующую степень окисления +1.
Чтобы водород стал +1 ему необходимо отдать один электрон, а значит он лишится своего единственного электрона => появится вакантная орбиталь.
Таким образом у нас есть донор (азот) и акцептор (водород).
Тетрагидроксоалюминат натрия
Вспомним немного про строение комплекса.
Комплексообразователь всегда является акцептором электронной пары. Лиганд — донором.
Алюминий является комплексообразователем. Напишем электронную конфигурацию Al в степени окисления 3.
Мы видим, что у алюминия достаточно места на 3 уровне для создания связей с кислородом. А у кислорода (рисовали раннее) есть пара электронов и он может быть донором.
Homework
Чтобы хорошо понять тему попробуйте сами объяснить какие связи есть (и почему) в молекулах/ионах, приведенных ниже.
А на этом пока всё 🙂
Вопросы можно задать в комментариях к посту.
Донорно акцепторный механизм у каких соединений
7.11. Строение веществ с ковалентной связью
Вещества, в которых из всех типов химической связи присутствует только ковалентная, делятся на две неравные группы: молекулярные (очень много) и немолекулярные (значительно меньше).
Кристаллы твердых молекулярных веществ состоят из слабо связанных между собой силами межмолекулярного взаимодействия молекул. Такие кристаллы не обладают высокой прочностью и твердостью (вспомните лед или сахар). Невысоки у них также температуры плавления и кипения (см. таблицу 22).
Таблица 22. Температуры плавления и кипения некоторых молекулярных веществ
tкип, o С
В отличие от молекулярных веществ, вещества, образующие атомные кристаллы, – одни из самых тугоплавких (см. таблицу 23.).
Таблица 23. Температуры плавления и кипения некоторых немолекулярных веществс ковалентными связями
tкип, o С
Si
Ge
1415
937
3250
2850
TiO2
ZrO2
1870
2700
3000
4300
Такие высокие температуры плавления вполне понятны, если вспомнить, что при плавлении этих веществ рвутся не слабые межмолекулярные, а прочные химические связи. По этой же причине многие вещества, образующие атомные кристаллы, при нагревании не плавятся, а разлагаются или сразу переходят в парообразное состояние (возгоняются), например, графит возгоняется при 3700 o С.
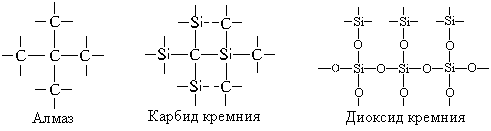
| Кремний – Si. Очень твердые, хрупкие кристаллы кремния по виду похожи на металлические, тем не менее он – неметалл. По типу электропроводности это вещество относится к полупроводникам, что и определяет его громадное значение в современном мире. Кремний – важнейший полупроводниковый материал. Радиоприемники, телевизоры, компьютеры, современные телефоны, электронные часы, солнечные батареи и многие другие бытовые и промышленные приборы содержат в качестве важнейших элементов конструкции транзисторы, микросхемы и фотоэлементы, изготовленные из монокристаллов особочистого кремния. Технический кремний используется в производстве сталей и в цветной металлургии. По химическим свойствам кремний – довольно инертное вещество, вступает в реакции только при высокой температуре Диоксид кремния – SiO2. Другое название этого вещества – кремнезем. Диоксид кремния встречается в природе в двух видах: кристаллическом и аморфном. Многие полудрагоценные и поделочные камни являются разновидностями кристаллического диоксида кремния (кварца): горный хрусталь, яшма, халцедон, агат. а опал – аморфная форма кремнезема. Кварц очень широко распространен в природе, ведь и барханы в пустынях, и песчаные отмели рек и морей – все это кварцевый песок. Кварц – бесцветное кристаллическое очень твердое и тугоплавкое вещество. По твердости он уступает алмазу и корунду, но, тем не менее, широко используется как абразивный материал. Кварцевый песок широко применяется в строительстве и промышленности стройматериалов. Кварцевое стекло используется для изготовления лабораторной посуды и научных приборов, так как оно не растрескивается при резком изменении температуры. По своим химическим свойствам диоксид кремния – кислотный оксид, но со щелочами реагирует только при сплавлении. При высоких температурах из диоксида кремния и графита получают карбид кремния – карборунд. Карборунд – второе по твердости после алмаза вещество, его тоже используют для изготовления шлифовальных кругов и » наждачной» бумаги. |
7.12. Полярность ковалентной связи. Электроотрицательность
Вспомним, что изолированные атомы разных элементов имеют разную склонность как отдавать, так и принимать электроны. Эти различия сохраняется и после образования ковалентной связи. То есть, атомы одних элементов стремятся притянуть к себе электронную пару ковалентной связи сильнее, чем атомы других элементов.
Рассмотрим молекулу HCl.
На этом примере посмотрим, как можно оценить смещение электронного облака связи, используя молярные энергии ионизации и средства к электрону. 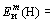
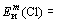
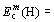
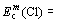
В этом случае говорят, что связь поляризуется, а сама связь называется полярной ковалентной связью.
Если же электронная пара ковалентной связи не смещена ни к какому из связываемых атомов, то есть, электроны связи в равной степени принадлежат связываемым атомам, то такая связь называется неполярной ковалентной связью.
Понятие » формальный заряд» в случае ковалентной связи также применимо. Только в определении речь должна идти не об ионах, а об атомах. В общем случае может быть дано следующее определение.
| Формальные заряды – реальные заряды изолированных атомов или ионов до образования ими химических связей. |
В молекулах, ковалентные связи в которых образовались только по обменному механизму, формальные заряды атомов равны нулю. Так, в молекуле HCl формальные заряды на атомах как хлора, так и водорода равны нулю. Следовательно, в этой молекуле реальные (эффективные) заряды на атомах хлора и водорода равны частичным (избыточным) зарядам.
Далеко не всегда по молярным энергиям ионизации и сродства к электрод легко определить знак частичного заряда на атоме того или другого элемента в молекуле, то есть оценить, в какую сторону смещены электронные пары связей. Обычно для этих целей используют еще одну энергетическую характеристику атома – электроотрицательность.
| Электроотрицательность – мера способности атома в веществе притягивать к себе электроны, связывающие этот атом с другими атомами. |
Так как относительная электроотрицательность зависит прежде всего от энергии ионизации атома (энергия сродства к электрону всегда намного меньше), то в системе химических элементов она изменяется примерно также, как и энергия ионизации, то есть возрастает по диагонали от цезия (0,86) ко фтору (4,10). Приведенные в таблице значения относительной электроотрицательности гелия и неона не имеют практического значения, так как эти элементы не образуют соединений.
Используя таблицу электроотрицательности, можно легко определить в сторону какого из двух атомов смещены электроны, связывающие эти атомы, и, следовательно, знаки частичных зарядов, возникающих на этих атомах.
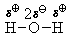
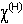
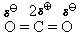
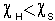
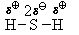
Таким образом, в случае образования ковалентной связи между атомами разных элементов такая связь всегда будет полярной, а в случае образования ковалентной связи между атомами одного элемента (в простых веществах) связь в большинстве случаев неполярна.
Чем больше разность электроотрицательностей связываемых атомов, тем более полярной оказывается ковалентная связь между этими атомами.
| Сероводород H2S – бесцветный газ с характерным запахом, присущим тухлым яйцам; ядовит. Он термически неустойчив, при нагревании разлагается. Сероводород мало растворим в воде, его водный раствор называют сероводородной кислотой. Сероводород провоцирует (катализирует) коррозию металлов, именно этот газ » повинен» в потемнении серебра. В природе он содержится в некоторых минеральных водах. В процессе жизнедеятельности его образуют некоторые бактерии. Сероводород губителен для всего живого. Сероводородный слой обнаружен в глубинах Черного моря и внушает опасения ученым: жизнь морских обитателей там находится под постоянной угрозой. |
7.13. Донорно-акцепторный механизм образования связи
В предыдущих параграфах вы подробно познакомились с двумя типами связи: ионной и ковалентной. Вспомним, что ионная связь образуется при полной передаче электрона от одного атома другому. Ковалентная – при обобществлении неспаренных электронов связываемых атомов.
Кроме этого, существует еще один механизм образования связи. Рассмотрим его на примере взаимодействия молекулы аммиака с молекулой трифторида бора:
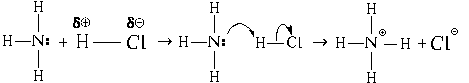
| Донорно-акцепторный механизм образования связи – механизм образования связи, при котором один из связываемых атомов является донором электронной пары, а другой – акцептором. |
При образовании связи по донорно-акцепторному механизму образуются одновременно и ковалентная связь, и ионная.
Конечно, после образования связи за счет разницы в электроотрицательности связываемых атомов происходит поляризация связи, возникают частичные заряды, снижающие эффективные (реальные) заряды атомов.
Рассмотрим другие примеры.
Пространственное строение получившегося катиона, иона аммония NH4 
Образование ионных кристаллов хлорида аммония NH4Cl можно наблюдать, смешав газообразный аммиак с газообразным хлороводородом:
Донором электронной пары может быть не только атом азота. Им может быть, например, атом кислорода молекулы воды. С тем же хлороводородом молекула воды будет взаимодействовать следующим образом:
Образующийся катион H3O 
В заключение рассмотрим электронное строение молекулы угарного газа (монооксида углерода) СО:
В ней, кроме трех ковалентных связей (тройной связи), есть еще и ионная связь.
Условия образования связи по донорно-акцепторному механизму:
1) наличие у одного из атомов неподеленной пары валентных электронов;
2) наличие у другого атома свободной орбитали на валентном подуровне.
Донорно-акцепторный механизм образования связи распространен довольно широко. Особенно часто он встречается при образовании соединений d-элементов. Атомы почти всех d-элементов имеют много свободных валентных орбиталей. Поэтому они являются активными акцепторами электронных пар.
7.14. Металлическая связь. Металлы
Ковалентная связь образуется между атомами, близкими по склонности к отдаче и присоединению электронов, только тогда, когда размеры связываемых атомов невелики. В этом случае электронная плотность в области перекрывания электронных облаков значительна, и атомы оказываются прочно связанными, как, например, в молекуле HF. Если хотя бы один из связываемых атомов имеет большой радиус, образование ковалентной связи становится менее выгодным, так как электронная плотность в области перекрывания электронных облаков у больших атомов значительно меньше, чем у маленьких. Пример такой молекулы с менее прочной связью – молекула HI (пользуясь таблицей 21, сравните энергии атомизации молекул HF и HI).
И все-таки между большими атомами (ro > 1,1 ) возникает химическая связь, но в этом случае она образуется за счет обобществления всех (или части) валентных электронов всех связываемых атомов. Например, в случае атомов натрия обобществляются все 3s-электроны этих атомов, при этом образуется единое электронное облако:
Атомы образуют кристалл с металлической связью.
Так могут связываться между собой как атомы одного элемента, так и атомы разных элементов. В первом случае образуются простые вещества, называемые металлами, а во втором – сложные вещества, называемые интерметаллическими соединениями.
| Металл – простое вещество, в котором атомы связаны между собой металлической связью. |
| Интерметаллическое соединение – сложное вещество, в котором атомы связаны между собой металлической связью. |
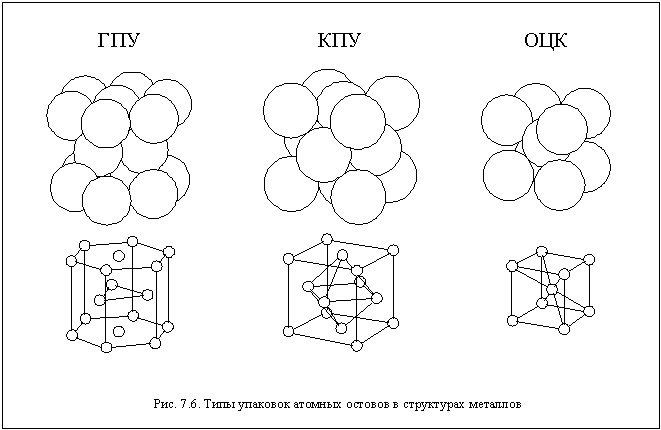
Из всех веществ с металлической связью между атомами в школе вы будете издать только металлы. Каково же пространственное строение металлов? Металлический кристалл состоит из атомных остовов, оставшихся после обобществления валентных электронов, и электронного облака обобществленных электронов. Атомные остовы обычно образуют плотнейшую упаковку, а электронное облако занимает весь оставшийся свободным объем кристалла.
Основными видами плотнейших упаковок являются кубическая плотнейшая упаковка (КПУ) и гексагональная плотнейшая упаковка (ГПУ). Названия этих упаковок связаны с симметрией кристаллов, в которых они реализуются. Некоторые металлы образуют кристаллы с неплотнейшей упаковкой – объемноцентрированной кубической (ОЦК). Объемные и шаростержневые модели этих упаковок показаны на рисунке 7.6.
Кубическую плотнейшую упаковку образуют атомы Cu, Al, Pb, Au и некоторых других элементов. Гексагональную плотнейшую упаковку – атомы Be, Zn, Cd, Sc и ряд других. Объемноцентрированная кубическая упаковка атомов присутствует в кристаллах щелочных металлов, элементов VB и VIB групп. Некоторые металлы при разных температурах могут иметь разную структуру. Причины таких отличий и особенностей строения металлов до сих пор до конца не выяснены.
При плавлении металлические кристаллы превращаются в металлические жидкости. Тип химической связи между атомами при этом не изменяется.
Металлическая связь не обладает направленностью и насыщаемостью. В этом отношении она похожа на ионную связь.
В случае интерметаллических соединений можно говорить и о поляризуемости металлической связи.
Характерные физические свойства металлов:
1) высокая электропроводность;
2) высокая теплопроводность;
3) высокая пластичность.
Вольфрам W. Это самый тугоплавкий из всех металлов: температура плавления вольфрама 3387 o С. Обычно вольфрам довольно хрупкий, но после тщательной очистки становится пластичным, что позволяет вытягивать из него тонкую проволоку, из которой делают нити электрических лампочек. Однако большая часть получаемого вольфрама идет на производство твердых и износостойких сплавов, способных сохранять эти свойства при нагревании даже до 1000 o С.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору