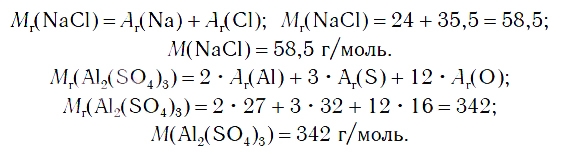формула рассола в химии
Формула соли пищевой
Определение и формула пищевой соли
Плавится и кипит без разложения. Умеренно растворяется в воде (не гидролизуется), растворимость не зависит от температуры, но сильно снижается в присутствии HCl, NaOH, хлоридов металлов. Растворяется в жидком аммиаке. Проявляет слабые восстановительные свойства.
Рис. 1. Пищевая соль. Внешний вид.
Химическая формула пищевой соли
Химическая формула пищевой соли NaCl. Она показывает, что в состав данной молекулы входят один атом натрия (Ar = 23 а.е.м.) и один атом хлора (Ar = 35,5 а.е.м.). По химической формуле можно вычислить молекулярную массу пищевой соли:
Mr(NaCl) = Ar(Na) + Ar(Cl);
Mr(NaCl) = 23 + 35,5 = 58,5
Графическая (структурная) формула пищевой соли
Структурная (графическая) формула пищевой соли является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
Ионная формула
Хлорид натрия – это средняя соль хлороводородной кислоты, способная диссоциировать на ионы в водном растворе согласно следующему уравнению:
Электронная формула
Образование молекулы пищевой соли происходит за счет образования общей электронной пары неспаренными электронами натрия и хлора (по одному от каждого атома):
Примеры решения задач
| Задание | При сгорании 7 г органического вещества получили 11,2 л (н.у.) CO2 и 9 г H2O. Относительная плотность вещества по кислороду равна 1,313. Найдите молекулярную формулу вещества. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м.
Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль
m(C) = [11,2 / 22,4]×44 = 6 г;
Определим химическую формулу соединения как CxHy:
Значит простейшая формула соединения CH2и молярную массу 14 г/моль [M(CH2) = Ar(C) + 2×Ar(H)= 12 + 2×1 = 14 г/моль].
Значение молярной массы органического вещества можно определить при помощи его плотности по кислороду:
Msubstance = 32 × 1,313 = 42 г/моль
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Msubstance / M(CH2) = 42 / 14 = 3
Значит индексы атомов углерода и водорода должны быть в 3 раза выше, т.е. формула вещества будет иметь вид C3H6.
| Задание | Найдите молекулярную формулу вещества, если плотность его паров по водороду равна 67,5, а состав выражается следующими массовыми долями элементов: 23,7% серы, 23,7% кислорода, 52,6% хлора. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%
Обозначим количество моль элементов, входящих в состав соединения за «х» (сера), «у» (хлор) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(S)/Ar(S) : ω(Cl)/Ar(Cl) : ω(O)/Ar(O);
x:y:z= 23,7/32 : 52,6/35,5 : 23,7/16;
x:y:z= 0,74 : 1,48:1,48 = 1 : 2: 2
Значит простейшая формула соединения серы, хлора и кислорода будет иметь вид SCl2O2 и молярную массу 135г/моль[M(SCl2O2) = Ar(S) + 2×Ar(Cl) + 2×Ar(O) = 32 + 2×35,5 + 2×16 = 32 + 71 + 32 = 135г/моль].
Значение молярной массы органического вещества можно определить при помощи его плотности по водороду:
Msubstance = 2 × 67,5 = 135 г/моль
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит формула соединения серы, хлора и кислорода имеет вид SCl2O2.
Урок 25. Соли
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
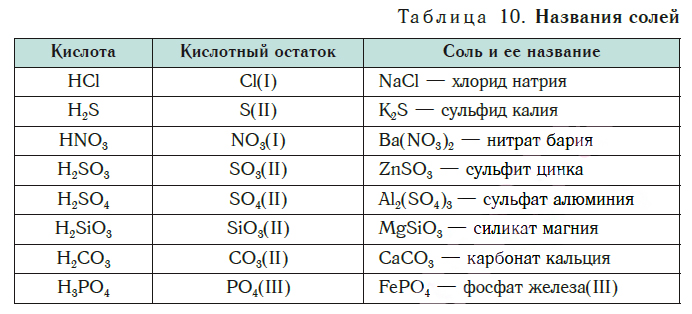
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Формула и свойства поваренной соли. Применение поваренной соли
Поваренная соль, формула которой NaCl, является пищевым продуктом. В неорганической химии данное вещество называют хлоридом натрия. В измельченном варианте поваренная соль, формула которой приведена выше, представляет собой белые кристаллы. Несущественные серые оттенки могут появляться при наличии иных минеральных солей в качестве примесей.
Производят ее в различных видах: неочищенном и очищенном, мелком и крупном, йодированном.
Биологическое значение
Кристалл поваренной соли, имеющий ионную химическую связь, необходим для полноценной жизни и деятельности человека, иных живых организмов. Хлорид натрия принимает участие в регулировании и поддержании водно-солевого баланса, щелочного обмена. Биологические механизмы контролируют постоянство концентрации хлористого натрия в различных жидкостях, например, в крови.
Разность концентраций NaCl внутри клетки и снаружи – основной механизм для попадания внутрь питательных веществ, а также вывода продуктов жизнедеятельности. Аналогичный процесс применяется в генерации и передаче нейронами импульсов. Также анион хлора в данном соединении – основной материл для образования соляной кислоты, важнейшего компонента желудочного сока.
Дневная потребность в этом веществе составляет от 1,5 до 4 граммов, а для жаркого климата доза хлорида натрия возрастает в несколько раз.
Организм нуждается не в самом соединении, а в катионе Na+ и анионе Cl-. При недостаточном количестве этих ионов происходит разрушение мышечной и костной тканей. Появляются депрессии, психические и нервные заболевания, нарушения в деятельности сердечно-сосудистой системы и процессах пищеварения, спазмы мускулатуры, анорексия, остеопороз.
Племена скотоводов и охотников еще в древности для удовлетворения потребности организма в соли, употребляли в сыром виде мясопродукты. Земледельческие племена потребляли растительную пищу, в которой незначительное количество хлористого натрия. В качестве признаков, сигнализирующих о нехватке соли, выделяют слабость и головную боль, тошноту, головокружение.
Особенности производства
В далеком прошлом добыча соли осуществлялась путем сжигания в кострах определенных растений. Образующуюся золу применяли в виде приправы.
Очистка поваренной соли, полученной путем выпаривания морской воды, не проводилась, полученное вещество сразу же употреблялось в пищу. Такая технология возникла в странах с жарким и сухим климатом, где подобный процесс происходил без вмешательства человека, а затем, когда его переняли иные страны, морская вода стала подогреваться искусственным путем.
На берегах Белого моря строились солеварни, в которых путем выпаривания и замораживания получали концентрированный рассол и пресную воду.
Природные месторождения
Среди мест, характеризующихся большими запасами поваренной соли, выделим:
Соляная шахта
Биологические свойства поваренной соли сделали ее важным экономическим объектом. На 2006 год на российском рынке использовалось порядка 4,5 миллионов тонн данного минерала, причем 0,56 млн тонн шло на пищевые расходы, а оставшиеся 4 миллиона тонн уходили на нужды химической промышленности.
Физические характеристики
Рассмотрим некоторые свойства поваренной соли. Данное вещество достаточно хорошо растворяется в воде, причем на процесс влияет несколько факторов:
Кристалл поваренной соли содержит примеси в виде катионов кальция, магния. Именно поэтому хлорид натрия впитывает воду (сыреет на воздухе). Если такие ионы не входят в состав поваренной соли, такое свойство отсутствует.
Например, 100 г льда и 30 г поваренной соли могут снижать температуру до −20 °C. Причина подобного явления в том, что раствор поваренной соли замерзает при температуре ниже 0 °C. Лед, для которого это значение является температурой плавления, плавится в подобном растворе, поглощая тепло окружающей среды.
Высокая температура плавления поваренной соли объясняет ее термодинамические характеристики, а также высокую диэлектрическую проницаемость – 6,3.
Получение
Учитывая, насколько важны биологические и химические свойства поваренной соли, ее существенные природные запасы, нет необходимости разрабатывать вариант промышленного производства данного вещества. Остановимся на лабораторных вариантах получения хлорида натрия:
Взаимодействия
Каковы химические свойства поваренной соли? Данное соединение образовано сильным основанием и сильной кислотой, поэтому гидролиз в водном растворе не протекает. Нейтральность среды и объясняет применение поваренной соли в пищевой промышленности.
При электролизе водного раствора данного соединения на катоде выделяется газообразный водород, а на аноде идет процесс образования хлора. В межэлектродном пространстве накапливается гидроксид натрия.
Учитывая, что получаемая щелочь – вещество, востребованное в различных производственных процессах, это также объясняет применение поваренной соли в промышленных масштабах на химическом производстве.
Галит
Так как плотность поваренной соли в этом соединении достаточно высока (2,1—2, 2 г/см³), галит – твердый минерал. Процентное содержание катиона натрия в нем составляет 39,34 %, аниона хлора – 60, 66%. Помимо этих ионов, в составе галита есть в виде примесей ионы брома, меди, серебра, кальция, кислорода, свинца, калия, марганца, азота, водорода. Этот прозрачный бесцветный минерал, имеющий стеклянный блеск, образуется в замкнутых водоемах. Галит является продуктом сгона на кратерах вулканов.
Каменная соль
Он представляет собой горную осадочную породу из группы эвапоритов, которая состоит более чем на 90 процентов из галита. Для каменной соли характернее белоснежный цвет, лишь в исключительных случаях присутствие глины дает минералу серый оттенок, а наличие оксидов железа придает соединению желтый, оранжевый цвет. В каменной соли присутствует не только хлорид натрия, но и множество иных химических соединений магния, кальция, калия:
В зависимости от условий формирования, основные месторождения каменной соли подразделяют на несколько видов:
Морская соль
Она является смесью сульфатов, карбонатов, хлоридов калия и натрия. В процессе ее испарения при диапазоне температур от +20 до +35 °C первоначально происходит кристаллизация менее растворимых солей: карбонатов магния и кальция, а также сульфата кальция. Далее в осадок выпадают растворимые хлориды, а также сульфаты магния и натрия. Последовательность кристаллизации этих неорганических солей может меняться с учетом температурного показателя, скорости процесса испарения, иных условий.
В промышленных объемах морская соль получается из воды морей путем выпаривания. Она существенно отличается по микробиологическим и химическим показателям от каменной соли, имеет большое процентное содержание йода, магния, калия, марганца. Из-за различного химического состава есть отличия и в органолептических показателях. Применяют морскую соль в медицине в качестве средства при лечении кожных заболеваний, например, псориаза. Среди распространенных продуктов, предлагаемых в аптечной сети, выделим соль Мертвого моря. Также морская соль в очищенном виде предлагается и в пищевой промышленности как йодированная.
Обычная поваренная соль имеет слабые антисептические свойства. При процентном содержании данного вещества в диапазоне 10-15 процентов можно предотвратить появление гнилостных бактерий. Именно для этих целей хлорид натрия добавляют в виде консерванта к пище, а также иным органических массам: древесине, клею, коже.
Злоупотребление солью
По информации Всемирной организации здравоохранения, избыточное потребление хлорида натрия приводит к существенному повышению кровяного давления, в результате чего нередко развиваются болезни почек и сердца, желудка, формируется остеопороз.
Вместе с другими солями натрия хлорид натрия является причиной появления заболеваний глаз. Поваренная соль задерживает внутри организма жидкость, что приводит к повышению внутриглазного давления, формированию катаракты.
Вместо заключения
Хлорид натрия, называемый в повседневной жизни поваренной солью, является широко распространенным в природе неорганическим минералом. Этот факт существенно упрощает его применение в пищевой, химической промышленности. Нет необходимости тратить временные и энергетические ресурсы на промышленное получение данного вещества, что сказывается на его стоимости. Для того чтобы не допускать переизбытка данного соединения в организме, необходимо контролировать ежедневное употребление соленых продуктов.
Общие сведения
Все соли имеют сложный химический состав и в зависимости от него могут быть органическими или неорганическими. В теоретической химии существует несколько определений этой группы веществ:
Кроме металлов, к кислотным остаткам могут присоединяться ионы аммония (NH4)+, гидроксония (Н3О)+, фосфония (РН4)+ и некоторые другие. С физической точки зрения чаще всего соли — это твердые кристаллические вещества. Встречаются вещества разной окраски. Прозрачные единичные кристаллы в большом количестве имеют белый цвет, например, поваренная соль NaCl.
Их строение представляет собой кристаллическую решетку, в узлах которой находятся анионы, а катионы занимают пространство между узлами. Другое распространенное строение — анионные фрагменты из кислотных остатков, соединенные в бесконечную цепочку, в трехмерных полостях которых находятся катионы. Такую структуру имеют силикаты, что отражается и на их свойствах: высокая температура плавления и неспособность проводить электрический ток.
Кроме ионных, в молекулах солей встречаются и молекулярные ковалентные связи, и промежуточные между ковалентными и ионными. В особую группу солей выделяются так называемые ионные жидкости, температура плавления которых ниже 100 °C, отличающиеся повышенной вязкостью.
Для изучения химических и физических свойств этой группы соединений важным критерием служит их растворимость в воде: полностью, частично или нерастворимые.
Классификация и номенклатура
Основные классы этой группы веществ были описаны французским химиком и аптекарем Г. Руэлем еще в 1754 году, а по мере развития химии к ним добавились новые. Главный принцип классификации солей основан на том, что при взаимодействии металла и кислоты в ней происходит частичное или полное замещение атомов водорода.
Общие характеристики
Формулы солей всегда образуются одним или несколькими металлами, кислотными остатками и гидроксильными группами. В зависимости от этого все солевые соединения делят на такие классы:
Средними считаются те, у которых все атомы водорода образующей кислоты заменены атомами металла. К такому типу соединений относятся и те, в которых водород замещается одновалентной группой аммония NH4. Согласно принятой номенклатуре, названия этих веществ образуются из латинского названия кислотного остатка и русского названия металла. Кислородосодержащие остатки оканчиваются на «ат», бескислородные — на «ид». Например:
Если одному химическому элементу соответствует не одна кислота, то может использоваться и окончание «ит». Это относится к таким кислотам, как серная H2SO4 (сульфаты) и сернистая H2SO3 (сульфиты).
Кислые вещества образуются только от двух- или полиосновных кислот: серной, фосфорной, угольной. Они относятся к неустойчивым соединениям и при нагревании происходит их разложение на составляющие элементы. В названии таких веществ всегда используют приставку «гидро», а если незамещенных атомов водорода осталось два — приставку «ди»:
Образование основных солей происходит при частичном замещении гидроксильных групп кислотными остатками, причем валентность основного остатка всегда будет равна числу замещенных гидроксильных групп. Номенклатура названий таких химических соединений образуется в зависимости от количества гидроксогрупп приставками «гидроксо» и «дигидроксо»:
В двойных солях атомы водорода замещаются двумя разными металлами, соответственно и образовываться могут только от двух и более основных кислот: MgK (SO4)2, NaKCO3, KAl (SO4)2.
Комплексные соединения и кристаллогидраты
Этот класс химических соединений отличается большим разнообразием. В изучении комплексных солей (КС) большую роль сыграли швейцарский ученый А. Вернер и русский химик немецкого происхождения В. Освальд. КС состоят из комплексных частиц. Центральный элемент в комплексе называется комплексообразователем, а связанные с ним элементы — лигандами. Их число — это координационное число соединения. Лигандами могут быть как нейтральные молекулы, так и разнообразные ионы и катион водорода H+.
КС так и классифицируются на нейтральные, анионные и катионные. Разными лигандами образуются такие группы химических веществ:
Кристаллы, образующиеся в водном растворе при выпадении в осадок солей, называются кристаллогидратами. При этом между молекулами воды и солевыми ионами формируются прочные связи, образующие кристаллическую решетку. Химические формулы кристаллогидратов записывают в виде количественного соотношения соли и воды, разделенных точкой — Na2SO4⋅10H2O. В номенклатуре для обозначения количества воды употребляются греческие числа — ди, три, тетра, гекса и так далее, с которых и начинается название. Число выступает приставкой к слову «гидро», а затем следует стандартное название соли: CaSO4⋅2H2O — дигидрат сульфата кальция.
Исторические наименования
Названия химических веществ соответствуют международной системе правил, позволяющей давать им названия, по которым можно правильно составить их формулу. Многие соединения солевой группы давно и хорошо известны, и в процессе их использования химики много лет назад уже как-то называли их. Традиционные или тривиальные названия полезно знать любому человеку. Их список приведен в таблице:
| Соль | Номенклатурное название | Тривиальное название |
| CuSO4⋅5H2O | Пентагидрат сульфата меди | Медный купорос |
| CaCO3 | Карбонат кальция | Известняк |
| AgNO3 | Нитрат серебра | Ляпис |
| NaHCO3 | Гидрокарбонат натрия | Питьевая сода |
| K2СO3 | Карбонат калия | Поташ |
| HgCl2 | Хлорид ртути | Сулема |
| Na2SiO3 | Силикат натрия | Жидкое стекло |
Это далеко не полный перечь общеизвестных наименований. Какой-либо системе они не подчиняются, и тем, кто изучает химию, их надо просто запомнить.
Химические свойства
Соли как химические соединения проявляют разные свойства в зависимости от их структурного состава. В водных растворах могут диссоциировать на анион металла и катион кислотного остатка. Степень диссоциации зависит от того, какую способность растворяться имеют разные виды солей: растворимые диссоциируют полностью, нерастворимые — частично или не диссоциируют. Ход такой реакции зависит от вида соли: средние, двойные и комплексные распадаются на ионы одномоментно, а кислые и основные — ступенчато. Примеры:
Некоторые соли под действием температуры могут разлагаться. Например, при нагревании из карбоната кальция СаСO3 получается оксид кальция СаO и кислотный оксид СО2. Солевые вещества, образованные от бескислородных кислот, разлагаются на простые элементы: хлорид серебра AgCl распадается на серебро Ag с выделением хлора Cl. Если солеобразующим соединением выступает кислота с сильными окислительными свойствами, то разложения до простых элементов не происходит: 2КNO3 → 2КNO2 + O2.
Взаимодействие с оксидами и кислотами
Соли реагируют путем сплавления с кислотными или амфотерными оксидами. При этом образуется новое солевое соединение, а оксиды замещаются менее летучими. С основными оксидами такая реакция не происходит. Например, карбонат калия K2CO3 сплавляется с оксидом кремния (IV) SiO2 с образованием силиката калия KSiO3 и выделением углекислого газа CO2: K2CO3 + SiO2 → KSiO3 + CO2↑. K2CO3 может взаимодействовать и с оксидом алюминия, при этом получается алюминат калия KAlO2 и углекислый газ CO2: K2CO3 + Al2O3 → 2KAlO2 + CO2↑.
Взаимодействие с кислотами может происходить только в том случае, если в реакцию вступает кислота и соль, образованная более слабой кислотой. Показателем возможного совместного реагирования солей с кислотами могут быть предполагаемые:
Например, нерастворимое соединение угольной кислоты карбонат магния MgCO3 вступает в реакцию с сильной серной кислотой: MgCO3 + H2SO4 → MgSO4 + 2H2O + CO2. Растворимый силикат калия как производное кремниевой кислоты может взаимодействовать с соляной кислотой, потому что в ходе реакции ожидается получение нерастворимой кремниевой кислоты: K2SiO3 + 2HCl → H2SiO3↓ + 2KCl.
Реакции с основаниями и другими солями
Со щелочами взаимодействуют в основном только соли аммония и тяжелых металлов, если при этом они относятся к растворимым. В результате получают новое солевое вещество и новое основание. Например, в реакцию с гидроксидом калия KOH вступает сульфат меди (II) CuSO4, в результате чего образуется сульфат калия K2SO4, а гидроксид меди Cu (OH) выпадает в осадок: 2KOH + CuSO4 → K2SO4 + Cu (OH)2.
Взаимодействие хлорида аммония с гидроксидом натрия описывается таким уравнением (NH4)2SO4 + 2KOH → 2H2O + K2SO4 + 2NH3↑. Если воздействовать основанием на кислую соль, то в результате получится средняя соль и вода. Например, гидрокарбонат натрия NaHCO3 взаимодействует с гидроксидом натрия NaOH: NaHCO3 + NaOH → Na3CO3 + H2O.
Реакции между солями возможны только в случае хорошей растворимости обоих веществ, при этом образуются две новые соли. С нерастворимым соединением взаимодействие не случается. Некоторые вещества, относящиеся к кислым, реагируют со слабокислыми солями и со своими средними соединениями.
Получение и применение
Многие соединения солей всех видов встречаются в виде залежей минеральных пород и рассолов. Например: известняк, разные виды селитры, поваренная и калийная соли, сильвин, карналлит, натрон, мирабилит и многие другие. Условно все способы получения солевых веществ разделяют на физическую переработку сырья (выпаривание, кристаллизация, флотация и тому подобное) и извлечение их из полупродуктов, отходов других производств и минералов химическими способами, основанными на свойствах солей.
Больше всего химическая промышленность выпускает солей для сельского хозяйства, причем они используются как в качестве удобрений для хорошего роста растений и повышения урожайности, так и для их защиты от сорняков и вредителей. Минеральные соли используют и как сырье для производства самых разнообразных химических веществ, применяемых в таких отраслях:
В качестве присадок и плавней соли применяются в металлургии для обогащения руд и при выплавке металлов. Производство цемента, одного из самых важных для строительной промышленности компонента, невозможно без известняка. Соли хрома используются при изготовлении огнеупорных материалов. Весь спектр разновидностей солей применяется и в фармацевтической промышленности.