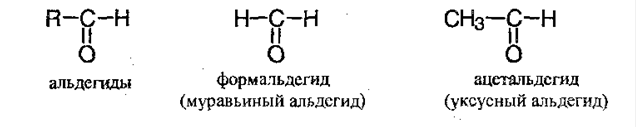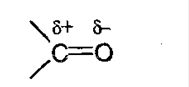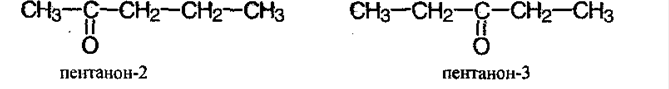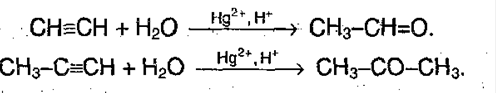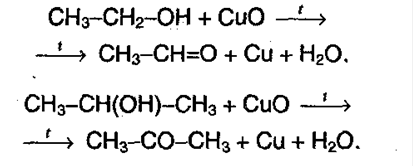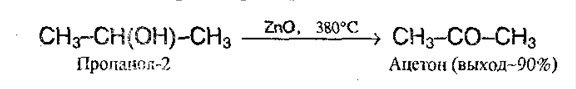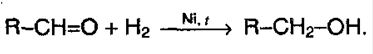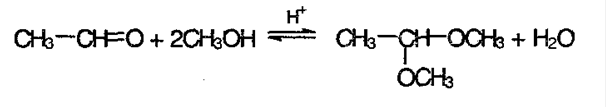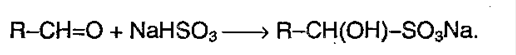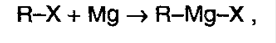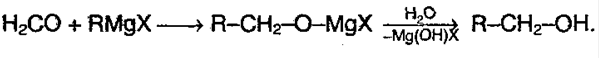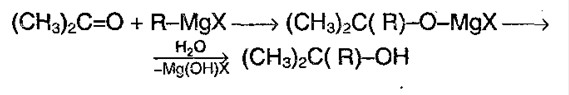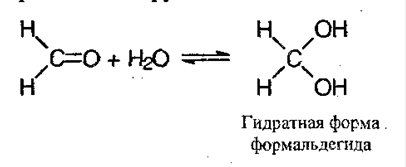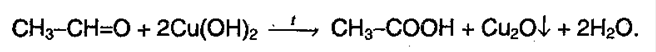Карбонильная группа сон входит в состав
Карбонильная группа
Карбонильная группа может входить в состав других функциональных групп, например, амидной или карбоксильной; соединения, в состав которых входит карбонильная группа, называют карбонильными соединениями.
| Класс соединений | Структура | Общ. формула |
|---|---|---|
| Альдегиды | 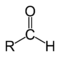 | RCHO |
| Кетоны | 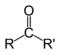 | RCOR’ |
| Сложные эфиры | 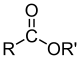 | RCOOR’ |
| Амиды | 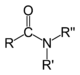 | RCONR’R» |
| Ацилгалогениды | 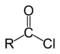 | RCOX, X=F,Cl,Br |
| Карбоновые кислоты | 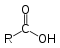 | RCOOH |
| Ангидриды карбоновых кислот | 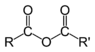 | (RCO)2O |
См. также
Полезное
Смотреть что такое «Карбонильная группа» в других словарях:
КАРБОНИЛЬНАЯ ГРУППА — карбонил, оксогруппа, двухвалентная группа у = С=О, характерная для альдегидов и кетонов; в кетонах атом С связан с двумя органич. радикалами, в альдегидах с органич. радикалом и с атомом водорода. К. г. входит также в состав молекул карбоновых… … Большой энциклопедический политехнический словарь
карбонильная группа — карбонил … Cловарь химических синонимов I
КАРБОНИЛ (КАРБОНИЛЬНАЯ ГРУППА) — двухвалентная гр. СО. Нередко входит в состав сложно построенных молекул, в т. ч. молекул угольного вещества. Присутствие К. в каменных углях высокой степени углефикации, не содер. иных форм кислородных функциональных гр., указывает на… … Геологическая энциклопедия
Функциональная группа — Бензил ацетат имеет эфирную функциональную группу (показанно красным), ацетильную группу (зелёная) и бензильную группу (оранжевая). Функциональная группа структурный фрагмент органическо … Википедия
ФУНКЦИОНАЛЬНАЯ ГРУППА — структурный фрагмент молекулы, характерный для данного класса орг. соед. и определяющий его хим. св ва. Примеры Ф. г.: азидная, гидроксиль ная, карбонильная, карбоксильная, азогруппа, аминогруппа. К Ф. г. не относят такие группы, как, напр.,… … Химическая энциклопедия
карбонил — карбонильная группа … Cловарь химических синонимов I
карбонильный — [ C = O, наличием которой в молекуле характеризуются кетоны Большой словарь иностранных слов. Издательство «ИДДК», 2007. карбонильный ая, ое ( … Словарь иностранных слов русского языка
Карбонильная группа сон входит в состав
Карбонильная группа
входит в состав альдегидов, кетонов, карбоновых кислот, хлорангидридов карбоновых кислот, их ангидридов и амидов. Атом углерода в этой группе 
Атом углерода в карбоксильной группе связан с атомом кислорода 

Небольшой положительный заряд на атоме углерода делает его восприимчивым к нуклеофильной атаке.
АЛЬДЕГИДЫ И КЕТОНЫ
Группы 

Физические свойства
За исключением метаналя (формальдегида), который представляет собой газ, остальные члены гомологических рядов альдегидов и кетонов при нормальных условиях
Таблица 19.9. Альдегиды и кетоны
находятся в жидком состоянии. Температуры кипения этих жидкостей, как правило, выше, чем у алканов с близкими значениями относительной молекулярной массы. Это объясняется наличием в альдегидах и кетонах межмолекулярных сил притяжения, обусловленных полярным характером карбонильной группы. Карбонильная группа не настолько полярна, чтобы образовывать водородные связи с другими молекулами того же соединения. Однако в воде карбонильная группа образует водородные связи с молекулами воды. Поэтому простейшие альдегиды и кетоны, например этаналь (ацетальдегид) и пропанон (ацетон), легко растворяются в воде:
Лабораторные способы получения альдегидов и кетонов
Альдегиды и кетоны в лабораторных условиях можно получать окислением спиртов с помощью подкисленного раствора бихромата (VI) калия (см. предыдущий раздел).
Рис. 19.1. Получение этаналя (ацетальдегида). Раствор бихромата!) натрия в этаноле приливают в горячую серную кислоту. Образующийся этаналь сразу же отгоняется, так как он имеет более низкую температуру кипения, чем этанол. Это предотвращает окисление этаналя до уксусной (этановой) кислоты. Этанол остается в растворе до тех пор, пока не окислится. Чистый этаналь получают повторной перегонкой.
Альдегиды получают из первичных спиртов:
Чтобы предотвратить дальнейшее окисление до карбоновой кислоты, образующийся альдегид отгоняют из реакционной смеси (рис. 19.1).
Кетоны получают из вторичных спиртов:
Кроме того, альдегиды и кетоны можно получать с помощью реактивов Гриньяра (см. разд. 19.1).
Химические свойства альдегидов и кетонов
Реакции присоединения. Альдегиды и кетоны вступают в реакции нуклеофильного присоединения. Общий механизм нуклеофильного присоединения к карбонильной группе описан в разд. 17.3.
Кетоны, как правило, обладают меньшей реакционной способностью по отношению к нуклеофильным агентам, чем альдегиды. Это объясняется электроно-донорными свойствами алкильных групп. Поскольку кетоны содержат две такие группы, положительный заряд на карбонильном атоме углерода у них меньше, чем у альдегидов.
Присоединение циановодорода. И альдегиды, и кетоны вступают в реакцию нуклеофильного присоединения с циановодородом, образуя 2-гидроксинитрилы (циан-гидрины). Например, при обработке этаналя (ацетальдегида) цианидом натрия, а затем избытком минеральной кислоты протекает следующая реакция:
Механизм этого нуклеофильного присоединения описан в разд. 17.3.
Присоединение гидросульфита. Альдегиды и метилкетоны, обрабатываемые при комнатной температуре насыщенным водным раствором гидросульфита натрия 

Этаналь (ацетальдегид) вступает в эту реакцию легче, чем пропанон (ацетон).
Присоединение водорода. Альдегиды и кетоны способны присоединять водород по карбонильной группе, образуя соответственно первичные и вторичные спирты. В этой реакции используется платиновый либо никелевый катализатор:
Вместо водорода в качестве восстановителя может использоваться 



Для завершения реакции к реакционной смеси добавляют воду, которая гидролизует продукт:
Кроме того, вода разрушает избыточное количество 
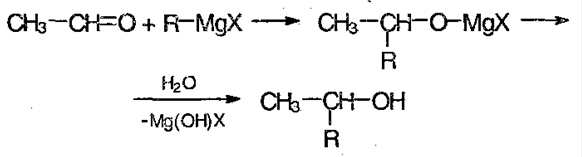
Присоединение реактивов Гриньяра. Метаналь (формальдегид) и другие альдегиды, а также кетоны реагируют с реактивами Гриньяра в безводном этоксиэтане (диэти-ловом эфире), образуя соответственно первичные, вторичные и третичные спирты (см. разд. 19.1).
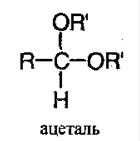
Присоединение спиртов. Альдегиды, но не кетоны, в присутствии хлороводорода соединяются со спиртами, образуя ацетали. Хлороводород в этой реакции выступает в роли катализатора:
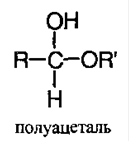
В этой реакции как спирт, так и хлороводород должны быть обезвожены. При добавлении разбавленной соляной кислоты реакция протекает в обратном направлении. В отсутствие катализатора продуктом реакции является полуацеталь:
Полимеризация. Альдегиды легко образуют целый ряд продуктов полиприсоединения. Например, испарением водного раствора метаналя (формалина) можно получить 
Поли(метаналь) имеет тривиальное название «параформальдегид».
При перегонке подкисленного раствора метаналя образуется триоксан (
При добавлении к этаналю нескольких капель концентрированной серной кислоты происходит бурная реакция, приводящая к образованию жидкого тримера:
Этаналь реагирует с холодным разбавленным раствором щелочи, например гидроксида натрия либо карбоната калия, образуя димер 3-гидроксибутаналь. Дегидратация этого продукта приводит к образованию бут-2-еналя:
Вся эта реакция, состоящая из двух стадий, называется алъдольной конденсацией.
В качестве примера приведем реакции между гидроксиламином и карбонильными соединениями. Продуктами этих реакций являются кристаллические вещества, называемые оксимами:
Альдегиды и кетоны вступают в реакции конденсации с 2,4-динитрофенилгидразинами, образуя 2,4-динитрофенилгидразоны, кристаллические вещества желтого или оранжевого цвета с четко выраженной температурой плавления:
Окисление карбонильных соединений. Альдегиды легко окисляются до карбоновых кислот под действием таких окислителей, как подкисленный раствор 
Для окисления альдегидов может использоваться также реактив Толлена. Он представляет собой водно-аммиачный раствор нитрата серебра. Этот раствор содержит комплексные катионы 
Алифатические альдегиды восстанавливают также ионы 

Ароматические альдегиды, например бензальдегид, не вступают в такую реакцию. Кетоны не вступают в реакцию ни с реактивом Толлена, ни с реактивом Фелинга. Кетоны окисляются только под действием таких сильных окислителей, как горячая азотная кислота и хромовая кислота:
Кетоны и альдегиды легко воспламеняются и горят чистым, некоптящим пламенем, образуя диоксид углерода и воду.
Галогенирование. Альдегиды и кетоны реагируют с пентахлоридом фосфора в безводной среде, образуя дихлороалканы:
Этаналь и метилкетоны вступают в реакции образования галоформов (см. предыдущий раздел):
Трихлорометан Этаноат-ион (хлороформ) (ацетат-ион)
Карбонильные соединения.
Органические соединения, в состав которых входит С=О группа, называют карбонильными соединениями. Они делятся на:
Углеводороды могут быть насыщенными и ненасыщенными, а также ароматическими.
Радикалы в кетоне могут быть различными и одинаковой длины, в таком случае они называются нессиметричными (смешанными) или симметричными.
Строение карбонильных соединений.
С-О образована π-электронами при перекрывании негибридных орбиталей. В силу большей электроотрицательности электронная плотность смещена в сторону атома кислорода:
Изомерия карбонильных соединений.
Для карбонильных соединений свойственна изомерия углеродного скелета и положением карбонильной группы:
Как называть карбонильные соединения?
По правилам ИЮПАК альдегид называют путем прибавления суффикса –аль, а кетон – он. Тот атом углерода, который связан с С=О группой является при нумерации первым.
Физические свойства карбонильных соединений.
Низшие альдегиды и кетоны – легкокипящие жидкости с резким запахом и хорошо растворимы в воде. Формальдегид является газом. Т.к. в молекуле нет водородных связей, значит температуры кипения и плавления у карбонильных соединений значительно ниже, чем у соответствующих алкенов, спиртов.
Получение карбонильных соединений.
Способ очень дорогой и продукты реакции весьма токсичны (т.к. в реакции участвует ртуть), поэтому применяется данный метод нечасто.
2. Окисление спиртов. Окисление проводят перманганатом калия, дихроматом, а также оксидом меди (II):
3. Щелочной гидролиз дигалогеналканов, в которых содержатся 2 атома галогена при одном атоме углерода. В результате образуется двухатомный спирт, который очень неустойчив и превращается в:
4. Дегидрирование спиртов. Этот метод имеет промышленное значение. В качестве катализаторов используют металлическую медь, серебро, хром, никель, оксид цинка:
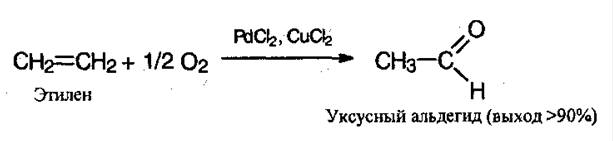
5. Окисление алкенов. Очень экономичный метод, используется в промышленных целях. Процесс проводят в присутствие хлоридов палладия (II) и меди (II):
Химические свойства карбонильных соединений.
В состав альдегидов и кетонов входит карбонильная группа с полярной связью. Поэтому карбонильные соединения вступают в реакции нуклеофильного присоединения. Активность соединений определяется величиной частично положительного заряда на атоме углерода. Электронодонорные группы понижают это значение. Самый активный – формальшегид.
Реакции присоединения карбонильных соединений.
1) гидрирование. Из альдегидов получаются первичные спирты, из кетонов – вторичные:
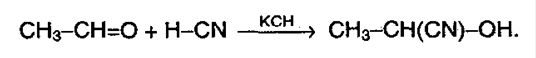
2) присоединение HCN (синильная кислота, циановодородная):
Эту реакцию используют для удлинения цепи.
3) Реакция со спиртами с образование ацеталей и полуацеталей:
Полуацеталь – соединение, в котором у одного атома углерода содержится гидроксильная и алкоксильная группы:
Ацеталь – соединение, в котором у атома углерода содержится 2 алкоксильные группы:
4) Реакция с гидросульфитом:
5) Реакция с реактивом Гриньяра – металлоорганическое соединение. С помощью его можно получить спирты, а также из альдегида можно получить кетон:
6) Присоединение воды – гидратация:
Альдегиды при окислении легко образуют соответствующие карбоновые кислоты. В качестве окислителей можно использовать перманганат калия, гидроксиды серебра и меди. Кетоны более инертны по отношению к окислителям, они вступают в реакцию только с сильными окислителями, в результате которых связь С-С рвется.
Реакция серебряного зеркала – это взаимодействие с аммиачным раствором серебра или оксидом серебра или гидроксидом меди. Эти реакции являются качественными на карбонильные соединения:
Применение карбонильных соединений.
Формальдегид используют для получения полимерных материалов. В водном растворе формальдегида хранят анатомические препараты. Ацетон используют в качестве растворителя в лакокрасочной промышленности.
Карбонильные и карбоксильные соединения. Сложные эфиры
I. Карбонильные соединения
Карбонильные, или оксосоединения, содержащие в своем составе группу >C=O, делятся на две большие группы — альдегиды и кетоны.
Альдегиды содержат в молекуле карбонильную группу, связанную с атомом водорода, т.е. альдегидную группу — СН=О. Кетоны же содержат ту же группу, окруженную с двух сторон углеводородными радикалами, т.е. кетонную группу.
Способы получения
2. Окисление спиртов
3. Важным промышленным способом получения формальдегида (метаналя) является каталитическое окисление метана кислородом воздуха
Типичные представители класса
Химические свойства
Химические свойства альдегидов и кетонов обусловлены присутствием в их молекулах активной карбонильной группы, в которой двойная связь сильно поляризована в силу большой электроотрицательности кислорода, из-за чего для представителей класса карбонильных соединений характерны реакции присоединения по двойной связи С=О, большинство которых имеют нуклеофильный характер.
В результате реакции можно удлинить углеродную цепь, получив оксинитрил, служащий в последствии исходным веществом для синтеза гидроксикарбоновых кислот.
2. Взаимодействие со спиртами
Альдегиды взаимодействуют с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали.