криброзные структуры что это
Атипичные клетки – это рак или нет?
Атипичные клетки – это такие клетки, которые под воздействием различных неблагоприятных факторов из обычной нормальной клетки человеческого организма преобразовались в нехарактерную структуру, изменили свой размер и форму. Организм в свою очередь теряет контроль над такими клетками, поэтому существует риск перерождения атипических клеток, что может привести к образованию рака.
Что может повлиять на образование атипичных клеток:
Это некоторые факторы, которые могут привести к образованию атипичных клеток. К сожалению, точной причины их возникновения сказать никто не может. Даже какой-то незначительный сбой в организме может привести к возникновению не одной и даже не двух таких клеток, а тысяч.
Как происходит перерождение атипичных клеток в рак
Давно известно, что образование клеток с измененной ДНК появляются постоянно. Но появление атипичных клеток не всегда приводят к раку. В нашем организме есть защитный механизм, процесс старение и уничтожение клеток, так называемый апоптоз. Он отвечает за то, чтобы аномальные клетки исчезали из организма. Но любая система может дать сбой, и в результате атипичные клетки затаятся в организме. При таком раскладе есть вероятность их перерождения в раковые клетки.
Что делать, если обнаружили атипичные клетки во время биопсии? Рак это или нет?
В такой ситуации лучше перестраховаться, чем что-то пропустить. Ведь ранняя диагностика рака может спасти вам жизнь.
Иногда врач назначает какое-то конкретное лечение, чтобы постараться остановить образование атипичных клеток. Либо может понадобиться еще один образец ткани – дополнительная биопсия, чтобы быть уверенным в отсутствии рака или какого-то другого заболевания.
Всё что нужно знать об аденокарциноме (железистый рак)
Разбор заболевания мы начнем с самого термина «аденокарцинома». Это, другими словами, железистый рак. Данный тип рака располагается на поверхности многих внешних и внутренних органов. Его развитие ведет к неконтролируемому росту, таким образом и делению, клеток.
Аденокарцинома. Виды и стадии
Медики классифицируют железистый рак по нескольким критериям. Специалисты выделяют три вида аденокарцином:
Низкодифференцированная аденокарцинома. Самая небезопасная разновидность. Быстрое распространение, довольно плохо поддается какому-либо лечению и рано появляются метастазы.
Типы аденокарциномы онкологи выявляют по органам, в которых заболевание обнаруживается: поджелудочная железа, легкие, матка, желудок, печень и другие.
Стадий аденокарциномы существует пять:
Нулевая. Злокачественные клетки не выходят за эпителий, где появились.
Первая. Новообразование, размещенное в органе, достигает до 2 см в диаметре.
Вторая. Опухоль уже до 4 см. Плюс, от нее могут распространиться метастазы в самые ближайшие к опухоли лимфатические узлы.
Третья. Новообразование занимает всю толщину стенок органа, затем переходит на соседние органы, и дает больше метастаз.
Четвертая. На этой стадии обильное количество метастаз распространяются в отдаленные органы человека.
Какие причины развития аденокарциномы? Какие симптомы?
Факторы, из-за которых опухоль формируется, ситуационны и специфичны отдельно для каждого органа.
Основные же причины, способствующие развитию опухоли такие:
Заболевание определенного органа
Курение и чрезмерное употребление алкоголя
Основные симптомы, на которые стоит обратить внимание:
Боль в одном из органов;
Кровь в выделениях;
Какой прогноз выживаемости при аденокарциноме?
Специалисты отсчитывают его от пятилетней выживаемости (кол-во человек с раком, которые перешли отметку в пять лет после окончания лечения). Существуют следующие данные по стадиям:
Какие есть виды диагностики аденокарциномы?
Пациенту нужно пройти полное обследование:
Анализ крови на обнаружение онкомаркеров. Определяет наличие веществ, которые характерны для того или иного типа железистого рака.
Исследование крови в лаборатории (биохимический и общий анализ). Способствует выявлению нарушения в работе внутренних органов.
Рентген. С его помощью специалисты могут обнаружить метастазы.
Анализ мочи. Выявляет процессы воспаления.
Биопсия. Сбор тканей опухоли для исследования в лаборатории.
УЗИ. С его помощью медики изучают ткани зараженного органа и ближайшие к нему лимфатические узлы. Затем выявляется опухоль и устанавливается её размер.
Сцинтиграфия. Врачи используют этот метод визуализации, который заключается в том, что в организм вводят радиоактивные изотопы, а затем получают двумерное изображение. Это помогает находить воспалительные процессы.
Какие есть методы лечения аденокарциномы?
После полного обследования врачи выбирают нужную в конкретном случае методику лечения аденокарциномы.
Открытая операция для удаления опухоли. Специалист производит разрез (до двадцати см) и удаляет новообразование.
+ Метод один из самых дешевых
– Остается довольно большой шрам.
Лапароскопическое удаление. Операция выполняется с помощью пары небольших разрезов (до двух см). Щипцами удаляются ткани, которые поражены. Процесс контролируется прибором с камерой.
+ Шрамы почти незаметны. Реабилитация проходит быстрее в полтора раза, чем при открытой операции.
– Стоимость данного метода больше открытой операции.
Эндоскопическое удаление. Специалисты удаляют новообразования на начальных стадиях с помощью эндоскопа. При удалении используется трубка с камерой и щипцы. Они вводятся в тело через естественные отверстия.
– Опухоли больших размеров не поддаются удалению.
Лучевая терапия (радиотерапия). Злокачественные клетки уничтожают радиацией. При предоперационном облучения главное — это уменьшить опухоль. При послеоперационном главное — это убрать раковые клетки, которые остались. Вместо операции лучевую терапию назначают при небольших опухолях.
Удаление опухоли роботизированной системой Кибер-нож. Проводится радиохирургическая операция. Это означает, что аденокарциному удаляют без разрезов на теле. Точность воздействия — 99,6%.
Радиойодтерапия. Используется при нескольких видах аденокарциномы щитовидки. При этом уничтожаются оставшиеся злокачественные клетки. Терапия подразумевает пероральное принятие пациентом капсулы с радиойодом.
Фокусированная ультразвуковая абляция. Основное воздействие происходит через ультразвук. Назначают на ранних стадиях стадиях железистого рака простаты, почки, груди, печени и мочевого пузыря.
Химиотерапия при аденокарциноме. Раковые клетки уничтожаются химическими веществами.
Какие последствия лечения аденокарциномы? Как проходит реабилитация?
Последствия аденокарциномы довольно ситуационны. Часто после завершения лечения возникает спад в весе, анемия и слабость, а также нарушается работа пищеварения и ранее зараженного органа.
Для того, чтобы ускорить реабилитацию, постарайтесь не перенапрягаться, уходить от стрессовых ситуаций. Специалисты советуют хорошо отдыхать и придерживаться здоровой диеты, назначенной врачом.
Уменьшение вероятности появления аденокарциномы (железистого рака) поможет следующее:
Проходить полное обследование каждый год;
Добавлять физические нагрузки;
Придерживаться здорового питания;
Проходить обследования два раза в год, если аденокарциному обнаружили у родственников;
Проходить профилактику заболеваний, которые передаются половым путем.
Инновационное лечение криброзного рака молочной железы за границей
Криброзный рак молочной железы – один из наименее опасных видов онкологии груди. Он представлен небольшими клеточными островками, которые имеют достаточно чёткие очертания. На ранних стадиях болезнь в подавляющем большинстве случаев полностью вылечивается. А это значит, что каждая женщина должна регулярно проходить осмотр у доктора, что позволит выявить онкологию на начальном этапе.
Криброзный рак молочной железы: понятие и статистика
Представленный тип рака молочной железы характеризуется наличием патогенных клеток, состоящих из органического слоя, на котором можно наблюдать небольшие просветы.
Главное отличие этого вида онкологии от других заключается в благоприятном прогнозе для большинства пациенток.

Причины развития криброзного рака молочной железы
Учитывая, что криброзный рак вызван изменениями в гормональном фоне, в основном все причины сводятся к факторам, которые с этим связаны.
Речь идёт о:
Кроме этого, иногда к развитию заболевания приводит ряд косвенных факторов, которые сложно идентифицировать. Специалисты отмечают, что хронические болезни также могут повлечь за собой возникновение криброзного рака.
Предотвратить появление болезни очень сложно, но её возможно распознать на ранних стадиях. Для этого нужно регулярно проходить обследование у гинеколога или маммалога.
Симптомы криброзного рака молочной железы
Этот вид онкологии редко даёт о себе знать какими-то симптомами. Уже на более поздних стадиях женщина может нащупать у себя в груди какое-то уплотнение.
Иногда признаки заболевания похожи на симптомы ПМС, на которые женщины не обращают внимания.
Эти признаки следующие:
Если все эти симптомы длятся на протяжении нескольких месяцев, то необходимо обязательно посетить доктора! Не стоит затягивать с этим, поскольку от этого зависит здоровье и жизнь каждой женщины.
Современная диагностика криброзного рака молочной железы за рубежом
Иностранные медики уделяют большое значение не только лечению болезни, но и её диагностике. Поэтому, обращаясь в клиники Израиля или какой-нибудь другой страны, первым делом доктор проведёт осмотр и назначит целый ряд исследований.
Обычно все эти манипуляции включают в себя:
В зависимости от результата анализов и исследования, врач может назначить дополнительные манипуляции, которые позволят подтвердить диагноз.
Эффективные методы лечения криброзного рака молочной железы за границей
Лечение рака молочной железы за рубежом зависит от степени запущенности проблемы и индивидуальных особенностей организма женщины.
Самыми распространёнными способами лечения представленного вида онкологии являются:
Гормональная терапия
В первую очередь, диагностировав криброзный рак, назначают гормональную терапию. Согласно клиническим исследованиям, на поверхности опухоли наблюдается большое количество рецепторов с эстрогенами. Именно они напрямую взаимодействуют с гормонами, вырабатывающимися яичниками и жировой тканью. Во время сильного выброса веществ, а это случается перед менструацией, во время беременности или в период менопаузы, гормоны оказывают сильное влияние на рецепторы новообразования, которое начинает активно расти.
Сократив выработку интересующих гормонов, можно не только остановить рост опухоли, но и добиться её уменьшения.
Гормональная терапия призвана уменьшить действие гормонов, оказывающих своё действия на жировую ткань, надпочечники и яичники. Благодаря этой методике лечения, удаётся добиться хороших результатов даже на запущенной стадии заболевания.
Медики отмечают, что терапия достаточно хорошо переносится женщинами, лишь у некоторых отмечается угнетённость и эмоциональная подавленность. Однако это является абсолютно нормальным процессом, поскольку всё лечение построено на влиянии на гормональный фон.
Для того чтобы уменьшить выработку эстрогенов, оказывается воздействие на яичники, надпочечники и жировую ткань.
У этого метода есть преимущества – он помогает, особенно в случае описываемого новообразования. Но, конечно, есть и свои недостатки: общее ухудшение состояния, эмоциональная подавленность.
Таргетная терапия
Таргетная терапия позволяет остановить рост раковых клеток. Обычно она используется в комплексе с гормональной, что позволяет быстрее добиться положительных результатов.
Радиотерапия
Радиотерапия может быть назначена как эффективное дополнение к другим методикам, позволяющим лучше воздействовать на новообразование, останавливая его рост и разрушая вредоносные клетки.
Хирургическое лечение

Специфика лечения криброзного рака молочной железы в Израиле
В Израиле большое внимание уделяется исследованию проблемы, причём подходят к ней по-особому в каждом отдельном случае. Что касается специфики лечения, то учёные разрабатывают новые инновационные препараты, средства, позволяющие бороться с онкологией ещё эффективнее.
На сегодняшний день криброзный рак молочной железы в Израиле, как и в Германии, штатах и других странах, лечат с помощью гормональной терапии, речь о которой шла выше. Именно этот вид терапии зарекомендовал себя наилучшим образом.
Стоимость лечения криброзного рака молочной железы за границей
В различных странах мира – будь то США, Великобритания, Германия и других, стоимость на лечение значительно разнится. Если брать во внимание Израиль, то при лучшем медицинском обслуживании, высококлассных специалистах и самом современном оборудовании, цены находятся на уровне ниже среднего.
Причина заключается в том, что многие лучшие клиники Израиля являются государственными и ценовая политика строго регулируется правительством. Для того чтобы узнать стоимость на обследование и лечение, рекомендуется оставить свои контактные данные, по которым с вами свяжется специалист и, исходя из сложности проблемы, сориентирует по ценам.
РМЖ: морфологическая характеристика
В настоящее время рак молочной железы (РМЖ) является самым распространенным заболеванием у женщин. Ежегодно в мире выявляется более 1,7 миллионов случаев этого заболевания. Существует несколько патогенетических разновидностей РМЖ, которые принципиально отличаются друг от друга по эпидемиологии, факторам риска, ответу на лечение и прогнозам.
Наиболее частой категорией злокачественных образований молочной железы является ER/PgR-позитивный РМЖ. Риск возникновения таких опухолей напрямую зависит от современного образа жизни женщин, важными составляющими которого являются контроль рождаемости и ожирение. Непривычные условия функционирования молочной железы, заключающиеся в отсутствии постоянных беременностей и лактаций, избыточном питании и ведущие к ожирению, нарушают физиологические циклы колебаний уровня стероидных гормонов и обновления клеток.
Кроме того, вероятность заболевания раком молочной железы увеличивается с возрастом: опухоли, имеющие большее количество рецепторов к эстрогену и прогестерону, возникают в организме с большим количеством сопутствующих развитию РМЖ факторов и избыточным процентом жировой ткани, которая является значимым «производителем» женских половых гормонов, особенно после менопаузы.
Факторы риска других разновидностей РМЖ (HER2-позитивных или трижды негативных карцином) изучены в значительно меньшей степени, но их существование напрямую сказывается на результатах скрининга и лечения данного заболевания. Несомненным с точки зрения эпидемиологии является феноменальное улучшение отдаленных результатов лечения рака молочной железы. Смертность от РМЖ с 1990 по 2014 гг. в США упала на целых 34 % — беспрецедентная динамика за период, охватывающий всего лишь четверть века.
Этот колоссальный прогресс связывают с появлением тамоксифена и других препаратов для лечения гормон-чувствительных карцином, внедрением трастузумаба и иных антагонистов рецептора HER2, появлением тестирования генов наследственного рака BRCA1 и BRCA2, совершенствованием химиотерапии и т. д.
К сожалению, столь очевидный прогресс не затрагивает страны с ограниченными ресурсами, которые не имеют полного доступа ко всем разновидностям системного лечения РМЖ. Для лучшего понимания биологии рака молочной железы необходимы знания о факторах риска его развития. К таким относятся:
1. Генетические мутации
В некоторых случаях РМЖ передается в соответствии с классической Менделевской моделью наследования. Самые распространенные гены предрасположенности — BRCA1 и BRCA2, чей вклад в частоту наследственных заболеваний раком молочной железы составляет около 20 %. Исследования на семьях с таким типом карцином продемонстрировали фатальный риск развития рака у носительниц мутаций BRCA. Кроме того, в качестве генов предрасположенности к развитию РМЖ могут быть рассмотрены гены ATM, PTEN, p53 и др., поскольку было отмечено значительное увеличение частоты РМЖ среди их гетерозиготных носительниц.
2. Соматические изменения
Взаимодействие между различными факторами, предрасполагающими к возникновению РМЖ, приводит к аккумуляции соматических мутаций в эпителиальных клетках. Хромосомная нестабильность, проявляющаяся в патологическом количестве крупных хромосомных перестроек, отдельные изменения в генах, ассоциированных с РМЖ — все это служит пусковым механизмом для возникновения соматических изменений. Различные комбинации мутаций и эпигенетических событий являются причиной появления совокупности свойств, характерных для раковых клеток, таких как способность противостоять процессу апоптоза, неограниченное деление и самодостаточность в отношении ростовых факторов, возможность инвазии и метастазирования, непрерывный ангиогенез и т. д.
3. Образ жизни и влияние окружающей среды
Ожирение, сопровождающееся наличием висцерального жира, и постоянный набор веса неразрывно связаны с увеличением риска возникновения РМЖ как до наступления менопаузы, так и после. В тоже время было замечено, что у женщин, ведущих активный образ жизни с регулярными физическими нагрузками, риск возникновения РМЖ после менопаузы меньше. Кроме того, риск возрастает вместе с увеличением потребления алкоголя.
4. Воздействие облучения
Кроме того, опухоли, ограниченные базальной мембраной протока или дольки, получили название неинвазивных (карциномы in situ), а образования, обладающие способностью к проникновению через базальную мембрану в строму, назвали инвазивными (опухолевые клетки в строме могут инвазировать сосуды, что является причиной поражения лимфатических узлов и развития отдаленных метастазов).
Неинвазивная протоковая карцинома (DCIS — ductal carcinoma in situ)
Среди всех опухолей молочной железы примерно 20 % составляют неинвазивные протоковые карциномы. Их выявление в большинстве случаев происходит благодаря обнаружению микрокальцификатов. Однако клинически DCIS может проявляться в виде:
Неинвазивная протоковая карцинома представляет собой скопление злокачественных клеток, окруженных базальной мембраной протоков. Тем не менее DCIS может распространяться за пределы протока и инфильтрировать прилежащие ткани молочной железы. В зависимости от гистологического строения протоковый РМЖ in situ подразделяется на следующие типы:
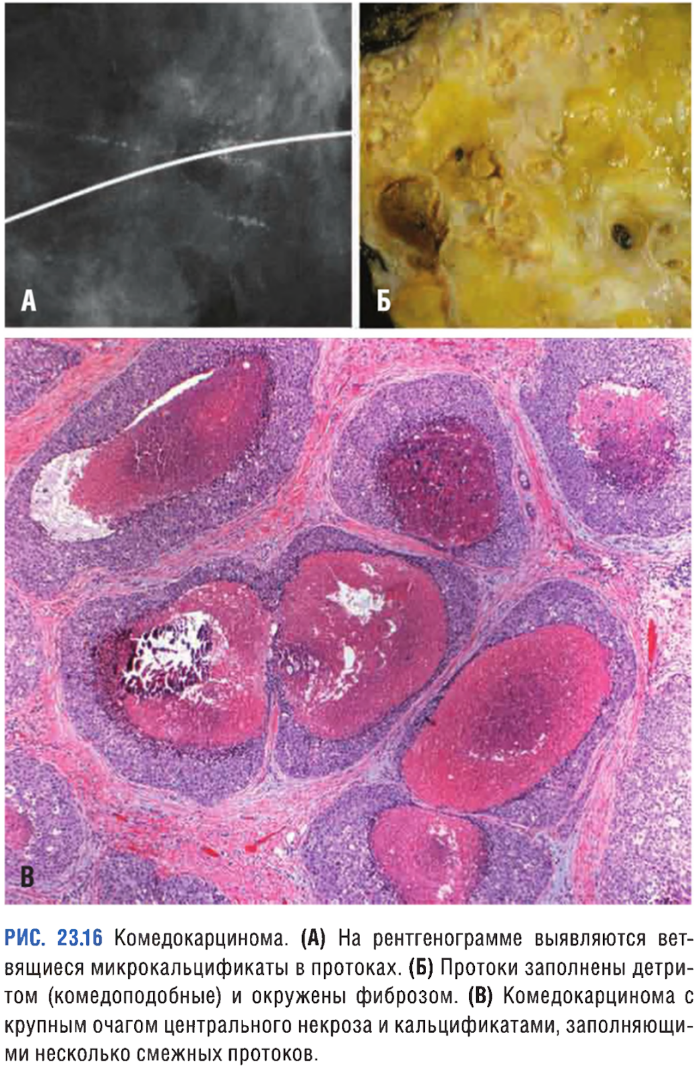
Комедокарцинома
Опухоль, характеризующаяся наличием очагов некроза, солидных полей плеоморфных клеток с ярко выраженной гиперхроматией ядер и кальцификацией мембран, которые можно выявить при маммографии (линейные и/или ветвящиеся микрокальцификаты). Вследствие обтурации протоков возникает перидуктальный фиброз, сопровождающийся хроническим воспалением.
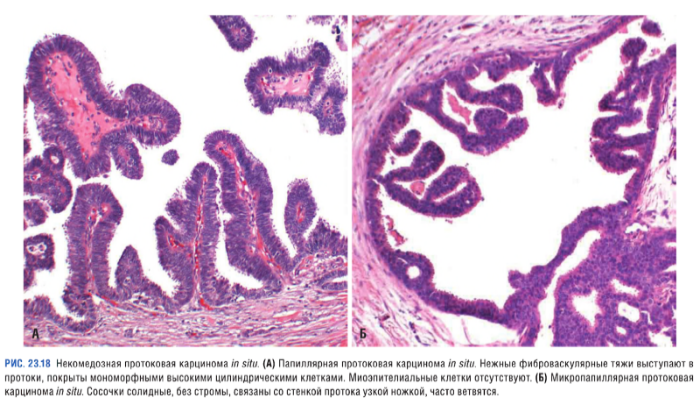
Некомедозные карциномы
Опухоли, отличающиеся отсутствием выраженной атипии у злокачественных клеток:
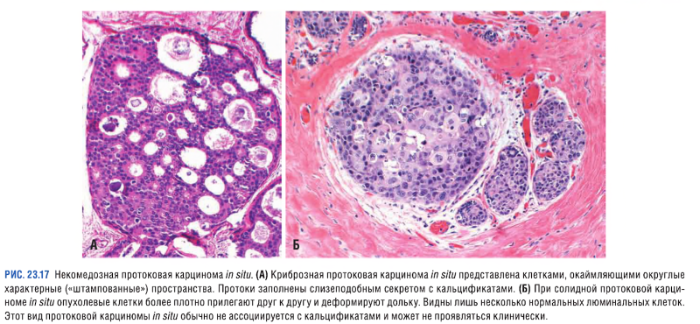
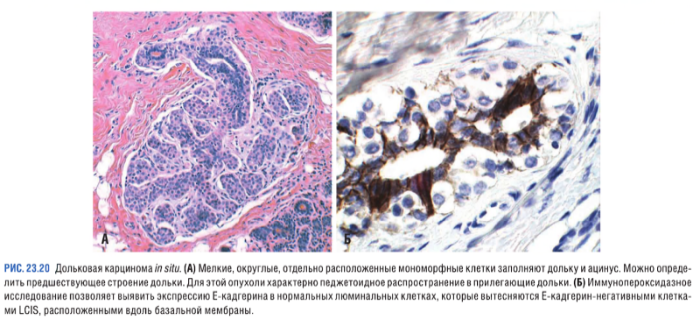
Неинвазивная дольковая карцинома (LCIS — lobular carcinoma in situ)
Такие опухоли клинически никак не не проявляются (микрокальцификаты и уплотнения отсутствуют), поэтому даже после внедрения скрининга распространенность LCIS не изменилась — 1–6 % от общего числа карцином. LCIS характеризуются наличием идентичных атипичных клеток с измененными круглыми ядрами. Клетки достаточно слабо связаны между собой вследствие нарушения экспрессии E-кадгерина, участвующего в образовании межклеточных контактов. Кроме того, клетки неинвазивных дольковых карцином характеризуются негативной экспрессией рецепторов к факторам роста и наличием гиперэкспрессии рецепторов к эстрогенам и прогестероны (ER+/Pgr+, HER2-).
Инвазивные карциномы
Инвазивная протоковая карцинома является самым распространенным типом карциномы и представляет 80 % всех РМЖ. Макроскопически такие опухоли отличаются плотной, твердой консистенцией (объясняется наличием очагов и некроза и скоплениями кальцификатов), разрезание или скобление сопровождается характерным звуком. Карциномы могут содержать клетки различной степени дифференцировки:
Инвазивная дольковая карцинома (ILC — invasive lobular carcinoma) состоит из клеток, которые утратили способность образовывать межклеточные контакты и поэтому либо «разбросаны» в строме молочной железы, либо расположены в одну линию. На основании морфологических различий ILC можно поделить на несколько гистологических типов, однако все они будут характеризоваться нарушениями контактов между клетками.
Источник:
Devita Jr V. T., Lawrence T. S., Rosenberg S. A. DeVita, Hellman, and Rosenberg’s cancer: principles & practice of oncology. – Lippincott Williams & Wilkins, 2015.
Гистологические варианты инвазивного рака молочной железы
Международные названия
Содержание
Для РМЖ характерен широкий круг специфических гистологических вариантов, имеющих определенный прогноз и клиническую характеристику.
I. Инвазивный (инфильтрирующий) протоковый РМЖ
Этим термином называют группу злокачественных опухолей из эпителия протоков, которые разрушают базальную мембрану протоков и образуют очаги роста в окружающей строме. Часто, кроме инвазии базальной мембраны, отмечают инвазию стенки лимфатических и кровяных сосудов, что создает условия для образования отдаленных метастазов. Это наиболее распространенная форма РМЖ. По разным данным инвазивный протоковый рак составляет от 40 до 70% всех случаев РМЖ [1, 8, 203].
На сегодня полагают, что все эпителиальные опухоли образуются в эпителии концевой протоково-дольковой единицы. Понятие о протоково-дольковой единице сформировалось в последние годы на основании результатов исследования гистогенеза эпителиального компонента молочной железы. Терминальные протоки и ацинусы было принято называть «концевой протоково-дольковой единицей». Каждая из них окружена рыхлой внутридольковой соединительной тканью, отличающейся от междольковой стромы.
Инвазивный протоковый рак возникает чаще в левой молочной железе (соотношение примерно 1,7:1). В 40–50% случаев опухоль расположена в верхненаружном квадранте молочной железы, реже — в центральном или верхневнутреннем и очень редко — в верхненаружном или верхневнутреннем квадрантах.
Большинство случаев РМЖ имеет клиническое проявление и многие женщины сами способны прощупать опухолевое уплотнение в железе. Однако бывают случаи бессимптомного РМЖ, поэтому введение скрининга повышает выявление бессимптомного рака.
Не существует надежных клинических признаков, отличающих РМЖ от доброкачественных процессов. Для диагностики рака необходимо гистологическое исследование опухоли. Цитологический метод помогает выявить большинство морфологических вариантов рака, хотя не является абсолютно достоверным для всех вариантов и зависит от качества забора материала.
Оценивая клинические данные, необходимо помнить, что доброкачественные процессы характерны скорее у женщин молодого возраста. Наиболее частым симптомом является уплотнение в грудной железе, которое может сопровождаться или не сопровождаться болью. Изменения соска (втяжение, деформация или изъязвление) отмечают не так часто.
В перечень необходимых исследований входят маммография, УЗИ, морфологическая верификация. Но начинают исследование с опроса и осмотра пациентки. Желательно выяснить причину и время возникновения уплотнения, оценить изменение кожи, формы молочной железы и соска, а также состояние лимфатических узлов.
Маммография является методом периодического исследования женщин в возрасте старше 35 лет. Редко целесообразна у пациенток молодого возраста, за исключением случаев серьезного подозрения опухоли или очевидных признаков рака. Маммографические проявления
инвазивного протокового РМЖ различны и включают наличие хорошо обозначенной границы опухоли, очагов кальцинатов, нарушение структуры паренхимы. Наиболее частым рентгенографическим проявлением РМЖ является звездчатая или округлая опухолевая масса без кальцинатов (64%). В 20% случаев опухоль проявляется только кальцинатами без прочих видимых изменений паренхимы.
Инвазивный протоковый РМЖ без особенных специфических признаков (« not otherwise specified ») — наиболее часто выявляемый рак молочной железы. Эта группа разнородная и включает опухоли, не имеющие специфических свойств, позволяющих выделить их в отдельную группу. Приставка « not otherwise specified » позволяет отличить эти типы рака от специфических. В гистологическом диагнозе это дополнение не является обязательным, достаточно указать термин «инвазивный протоковый рак».
Эпидемиологические признаки протокового РМЖ одинаковы для всех гистологических вариантов инвазивного рака в целом. Протоковый вариант инвазивного РМЖ поражает преимущественно женщин в возрасте старше 40 лет.
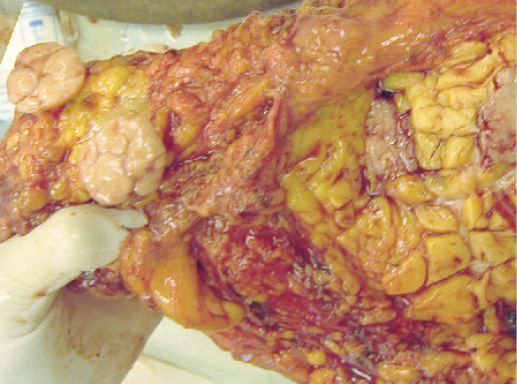
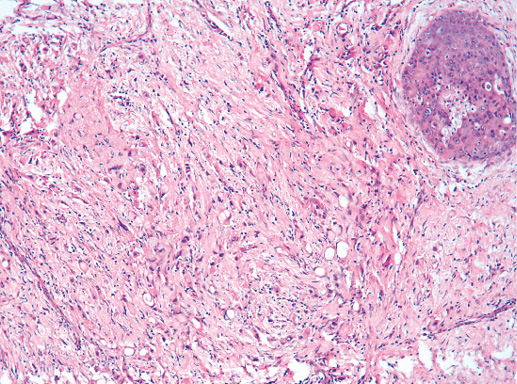
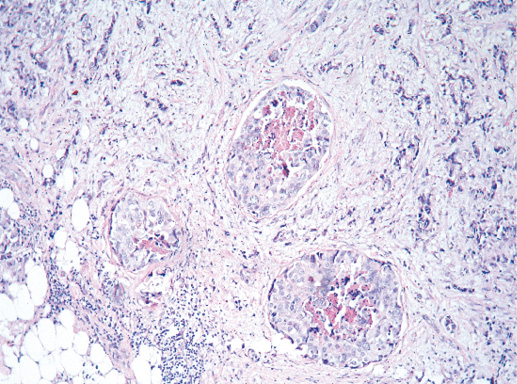
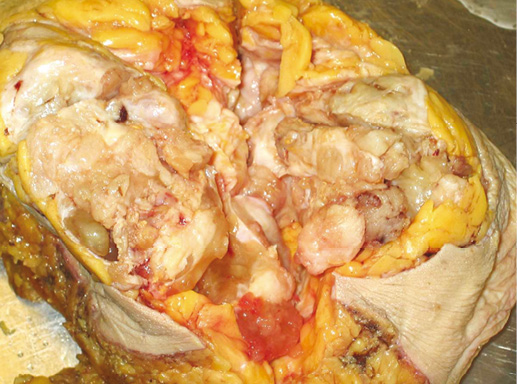
Макроскопический вид инвазивного рака не имеет специфических признаков, характерных для протокового варианта. Как правило, на разрезе опухоль в виде узла различной формы и размера (менее 10 мм — более 100 мм). Может иметь неправильную, звездчатую форму или быть четко очерченным узлом (фото 33). В классических случаях протоковая карцинома плотная при пальпации или даже твердая, как хрящ. В случаях возникновения рака на фоне предопухолевой патологии края рака могут быть нечеткими (фото 35).
Фото 33. Внешний вид опухоли и метастаза в подмышечной области. Первичная опухоль и метастаз в виде узла дольчатого строения, белесоватого цвета с четкими границами
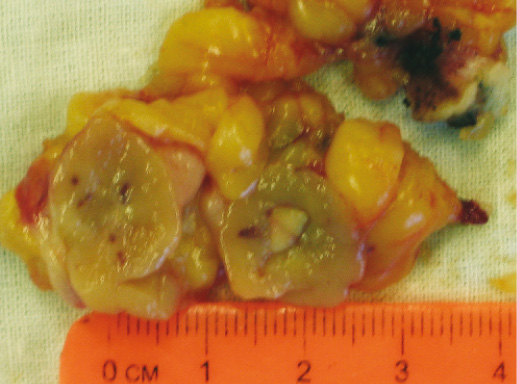
Фото 34. Внешний вид слизистого рака. Опухоль в виде желе серого цвета с мелкими кровоизлияниями и некрозом в центре, с четкими границами
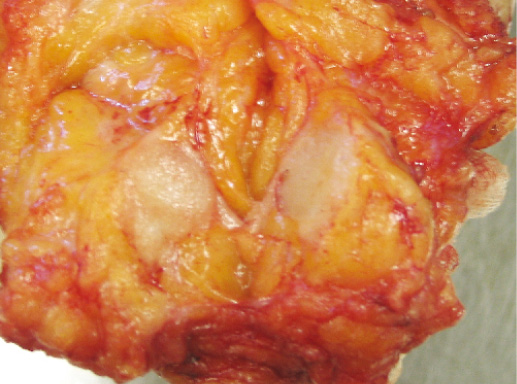
Фото 35. Внешний вид опухоли, возникшей на фоне очаговой мастопатии. Нет четкой границы между участком мастопатии и рака. Однако видно, что за счет высокой плотности ткани рак имеет ровную поверхность среза и острый край
Характерным признаком опухоли является серый цвет поверхности разреза.
Совокупность признаков: плотная серая опухоль с острым краем разреза позволяет с высокой достоверностью определить инвазивный РМЖ. Наиболее сложны случаи диагностики рака на фоне хронического воспалительного процесса. Липогранулема, как правило, тоже может быть плотной и иметь острый край разреза. Однако поверхность разреза липогранулемы желтая с белесоватыми прожилками, переплетающимися между собой. Рак на фоне воспалительного процесса крайне трудно диагностировать.
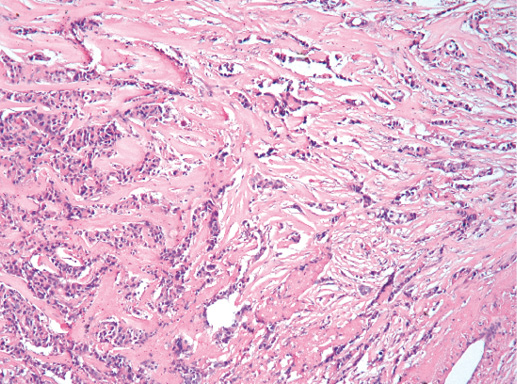
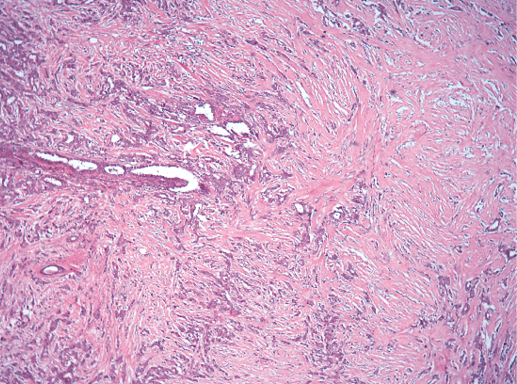
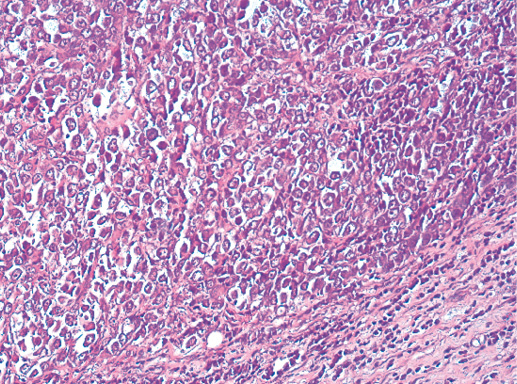
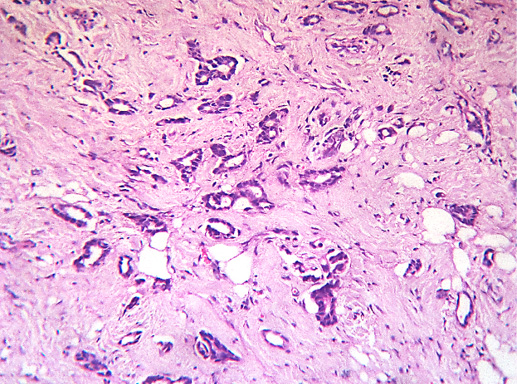
Гистологическое строение инвазивного протокового рака часто повторяет предсуществующее строение протоков (фото 36). В случаях высокой гистологической дифференцировки опухолевые клетки образуют преимущественно железистые, тубулярные структуры. Умеренно дифференцированная протоковая карцинома молочной железы характеризуется формированием альвеолярных структур, тяжей, трабекул (фото 37). В некоторых случаях преобладает фиброзная строма, а опухолевые клетки представлены отдельными клетками или цепочками клеток (фото 38, 39).
Фото 36. Инвазивный протоковый РМЖ G-1. Структуры рака повторяют строение протоков молочной железы, однако в строме есть отдельные комплексы опухолевых клеток, что подтверждает инвазивный тип роста. Отмечается инфильтрация жировой ткани. Гематоксилин-эозин, х 100
Фото 37. Инвазивный протоковый РМЖ G-2. Солидно-альвеолярный тип строения, инвазия жировой ткани, гиалиноз стромы. Гематоксилин-эозин, х 100
Фото 38. Инвазивный протоковый РМЖ G-2. Скиррозный тип роста опухоли: гиалиноз стромы, клетки рака формируют цепочки, мелкие железистые структуры, небольшие солидные скопления. Гематоксилин-эозин, х 200
Фото 39. Инвазивный протоковый рак скиррозного строения. Опухолевые клетки формируют цепочки на фоне гиалинизированной стромы. х 200
По мере снижения дифференцировки рака объемное включение стромы уменьшается, раковые клетки формируют солидные поля. Иногда преобладают относительно обособленные железистые комплексы (фото 40).
Фото 40. Инвазивный протоковый РМЖ G-3. Строма сохранена в виде отдельных коллагеновых волокон и клетки рака вытесняют строму, формируя причудливые ветвистые структуры, местами напоминающие железы. Гематоксилин-эозин, х 200
Опухолевые клетки протокового рака более крупные, чем клетки долькового рака, с выраженной цитоплазмой. Клеточный полиморфизм представлен в разной степени, в зависимости от степени гистологической дифференцировки (фото 41, 42).
Фото 41. Инвазивный протоковый РМЖ G-3. Рак состоит из крупных клеток, утративших характерное для протоков распределение эпителия в виде слоев, но сохранивших тенденцию к адгезии. В клетках хорошо видна широкая цитоплазма, ядра полиморфные крупные. Гематоксилин-эозин, х 400
Фото 42. Инвазивный недифференцированный РМЖ, вероятно из эпителия протоков G-4. Клетки рака крупные со светлым большим ядром и обильной эозинофильной цитоплазмой. Гематоксилин-эозин, х 400
Фото 43. Инвазивный смешанный дольково-протоковый РМЖ G-2. В правом верхнем углу участок протокового рака, остальная часть опухоли представлена дольковым раком скиррозного строения. Гематоксилин-эозин, х 200
Фото 44. Инвазивный смешанный дольково-протоковый РМЖ G-2. В центре три участка протокового (угревидного, комедо-) рака, вокруг участки долькового рака. Гематоксилин-эозин, х 200
Фото 45. Плеоморфный РМЖ. Опухоль состоит из клеток разных размеров и формы. Гематоксилин-эозин, х 200
В случае плеоморфного рака > 50% массы опухоли занимают крупные полиморфные, веретеновидные клетки, а также гигантские многоядерные клетки или клетки с дифференцировкой плеоморфной рабдомиосаркомы. Этот вариант всегда оценивают как низкодифференцированный ( G- 3), характеризуется склонностью к агрессивному течению (у 50% пациенток ≥ 3 пораженных лимфатических узлов к моменту установления диагноза). Средний возраст пациенток составляет около 50 лет. Опухоль дает позитивную реакцию на цитокератины, антиген эпителиальных мембран ( EMA ), негативную реакцию с рецепторами прогестерона и эстрогена.
Рак с гигантскими клетками типа остеокластов — это редкая опухоль с более благоприятным прогнозом, чем протоковый рак. Гистологическое строение опухоли похоже на инвазивный протоковый рак, однако отмечают наличие отдельных многоядерных гигантских клеток или их скопления в виде очагов (фото 46). Возможны варианты с другими формами рака, такими как муцинозный, папиллярный и прочие [205]. Согласно результатам иммуногистохимического, электронномикроскопического исследования принято считать, что гигантские клетки происходят из гистиоцитов — макрофагов (в клетках негативная реакция на цитокератины, позитивная на CD 68).
Средний возраст пациентов с этой патологией составляет 51 год. Кроме наличия гигантских клеток в строме отмечают признаки воспаления: клеточную инфильтрацию из лимфоцитов, моноцитов, мононуклеарных и стромальных гистиоцитов, в том числе двухъядерных, экстраваскулярное расположение эритроцитов, а также пролиферацию фибробластов. Гигантские клетки, как правило, выявляют возле эпителиального компонента или внутри протоков. Причем такие особенности строения отмечают в рецидивах и метастазах опухоли. Эпителиальный компонент, как правило, представлен высокодифференцированной инфильтрирующей протоковой карциномой. Однако возможны криброзные, дольковые, муцинозные, тубулярные участки карциномы. Пятилетняя выживаемость пациентов с этим видом рака несколько выше, чем у больных инвазивным протоковым раком, и составляет в среднем 70%. Однако некоторые авторы считают, что наличие остеокластов в опухоли не имеет прогностического значения [227–230].
Фото 46. Инвазивный рак с наличием гигантских клеток типа остеокластов. Клетки рака — железистые структуры, однако на этом фоне видны гигантские многоядерные клетки. Гематоксилин-эозин, х 200
Клетки CD 68+, S 100- крупные, в них отсутствует экспрессия цитокератинов, эпителиальных мембран антигена, гладкомышечного актина, рецепторов эстрогена и прогестерона [231]. Однако содержится кислая фосфатаза, неспецифическая эстераза, лизоцим, а щелочная фосфатаза отсутствует.
Данные ультраструктурных и иммуногистохимических исследований показывают, что эти клетки являются гистиоцитами с остеокластической дифференцировкой. Результаты исследований in vitro свидетельствуют о том, что остеокласты могут происходить непосредственно из моноцитов и макрофагов. Это явление чрезвычайно важно при метастазировании в кости, когда опухолеассоциированные макрофаги, дифференцируясь во многоядерные клетки, обусловливают резорбцию кости.
В строме большое количество сосудов, полиморфная клеточная инфильтрация с наличием лимфоцитов, моноцитов, плазматических клеток, гистиоцитов. Вокруг структур рака большое количество крупных многоядерных клеток типа остеокластов, CD 68+, цитакератин-негативных. В ядрах клеток рака выявлены рецепторы эстрогена и прогестерона.
Следует отметить, что многоядерные гигантские клетки типа остеокластов выявляют не только при раке, но злокачественной листовидной опухоли и остеогенной саркоме молочной железы.
При проведении дифференциальной диагностики этих опухолей необходимо учитывать следующие признаки. При злокачественной листовидной опухоли с участками типа остеогенной саркомы характерна более четкая граница между опухолью и тканью молочной железы, чем при остеогенной саркоме, наличие структур листовидной опухоли, часто выявляют другие виды сарком, больше 10 митозов в одном поле зрения, более благоприятное клиническое течение, как правило, отсутствие эффекта гормональной терапии.
Остеогенная саркома молочной железы характеризуется инфильтративным типом роста, отсутствием других видов сарком и эпителиального компонента в опухоли. Эта опухоль более склонна к гематогенным метастазам, не имеет рецепторов эстрогена и прогестерона.
В отличие от стромальных опухолей с наличием остеогенной дифференцировки, в карциноме молочной железы многоядерные гигантские клетки не опухолевые, а реактивные, возможно проявление иммунной реакции.
Прогностическое значение их еще предстоит изучить. Детальное исследование эпителиального компонента в опухоли позволяет дифференцировать этот вид карциномы от злокачественной листовидной опухоли с наличием остеокластов.
В единичных сообщениях описывается так называемый рак с меланоцитарной характеристикой (фото 47, 48). Поскольку генетический анализ выявил LOH ( loss of heterozygosity ) в одних и тех же локусах хромосом всех клеток опухоли, можно сделать вывод о трансформации одного типа клеток в другие. При диагностике этой формы рака необходимо исключить первичную меланому кожи молочной железы (особенно при поражении кожи раком) (фото 49–51). Также необходимо исключить болезнь Педжета, при которой могут выявлять клетки, содержащие меланин [205] (фото 88, 89).
Фото 47. Рак с меланоцитарной характеристикой. РМЖ инфильтрирует эпидермис, создает картину, характерную для меланомы. Сходство с меланомой усиливается за счет наличия отдельных клеток, содержащих в цитоплазме коричневый пигмент (в правом верхнем углу). Гематоксилин-эозин, х 200
Фото 48. Рак с меланоцитарной характеристикой. Опухоль состоит из мелких клеток типа меланоцитов. Гематоксилин-эозин, х 200
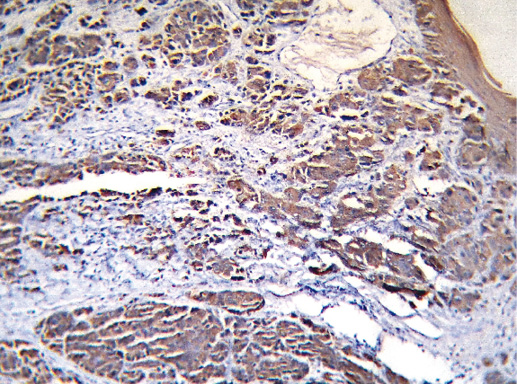
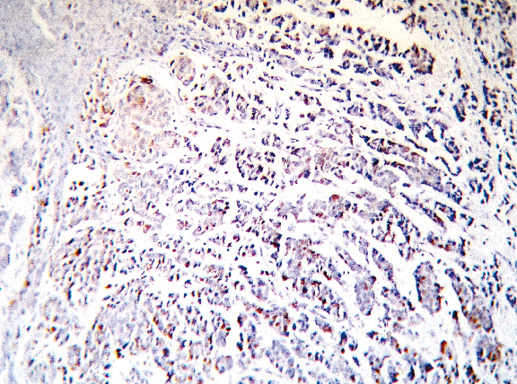
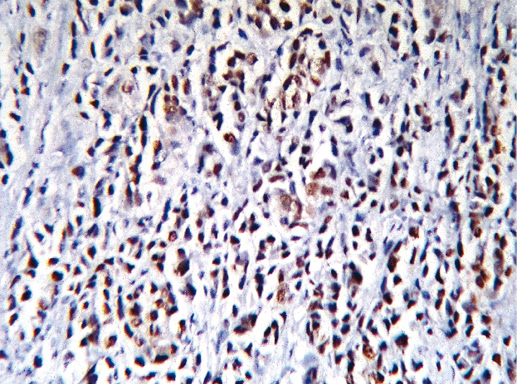
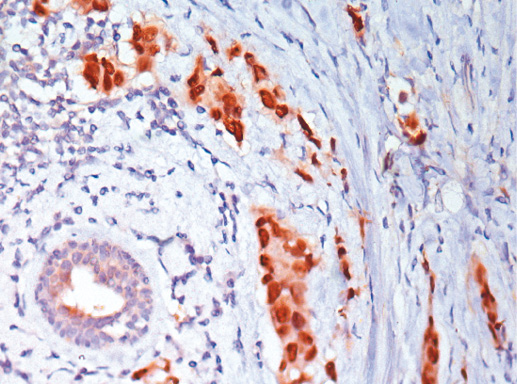
Фото 49. Рак с меланоцитарной характеристикой. Экспрессия Cytokeratin pan (клон AE1/AE3, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Окрашивание цитоплазмы опухолевых клеток позитивное, что характерно для рака, а не для меланомы, х 200
Фото 50. Рак с меланоцитарной характеристикой. Экспрессия рецептора эстрогена (клон 1D5, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Отмечается позитивное окрашивание ядра опухолевых клеток, что характерно для РМЖ, х 200
Фото 51. Рак с меланоцитарной характеристикой. Экспрессия рецептора эстрогена (клон 1D5, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Отмечается позитивное окрашивание ядра опухолевых клеток, что характерно для РМЖ, х 400
Фото 88. Рак Педжета. Гематоксилин-эозин, х 100
Фото 89. Рак Педжета. Гематоксилин-эозин, х 200
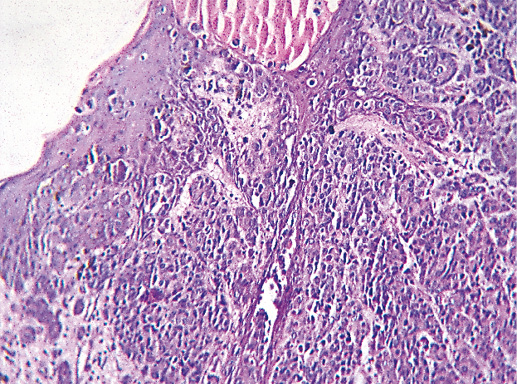
II. Инвазивный дольковый рак молочной железы
Инвазивный дольковый рак составляет до 15% всех форм инвазивного РМЖ. По нашим наблюдениям его истинная частота выше, особенно с учетом наличия полей долькового рака в опухолях с преобладающим протоковым строением. Последние 20 лет ряд исследователей отмечают повышение частоты долькового РМЖ у женщин в возрасте младше 50 лет, особенно у применяющих гормонзаместительную терапию [1, 206, 207].
Нет существенных особенностей клинического течения этого варианта рака, хотя отмечено более частое вовлечение центральных отделов молочной железы, а также мультицентричное или билатеральное поражение [208].
Иногда возникают трудности диагностики этой опухоли. Это обусловлено спецификой гистологического строения долькового рака в отдельных случаях. Прежде всего это наличие массивных полей фиброза в скиррозных подвариантах опухоли, что не позволяет получить информативный материал при пункционной биопсии. Частый мультицентричный тип роста опухоли, состоящей из очень мелких очагов поражения, затрудняет проведение прицельной биопсии.
Для инвазивного долькового рака характерным является пролиферация мелких однотипных клеток, в той или иной степени потерявших способность к адгезии между собой (фото 52, 53). Типичной является инфильтрация фиброзной стромы в виде линейных тяжей или концентрических структур вокруг нормальных протоков (фото 54, 55, 56). Выделяют несколько вариантов роста долькового рака: солидный, альвеолярный и вариант плеоморфного долькового рака. В основе этого роста лежит потеря опухолевыми клетками Е-кадгеринов. В спорных случаях с целью дифференциальной диагностики между протоковым и дольковым РМЖ рекомендовано проводить иммуногистохимическое исследование с антителом против белка Е-кадгерина. Протоковый рак экспрессирует этот белок, а дольковый рак нет. Когда выявление Е-кадгеринов недоступно, исследователю может помочь изучение гистологического строения опухоли. Если определяют отдельные нормальные протоки, а рак состоит из мелких мономорфных клеток, формирующих тубулярные и линейные структуры в виде цуг, радиально расположенных вокруг протоков типа структур «мишени», то такой рак следует трактовать как инвазивный дольковый рак [1]. В некоторых случаях строение рака настолько меняется, что его трудно отличить от крупноклеточной лимфомы (фото 57–59).
Фото 52. Инвазивный дольковый РМЖ G-1. Строение опухоли повторяет строение ацинусов молочной железы. Гематоксилин-эозин, х 200
Фото 53. Инвазивный дольковый РМЖ G-2. Опухоль состоит из солидных участков, имеющих тенденцию к формированию долек. Гематоксилин-эозин, х 200
Фото 54. Инвазивный дольковый РМЖ скиррозного строения G-2. Опухоль имеет плотную гиалинизированную строму, клетки рака формируют отдельные цепочки и цуги. Гематоксилин-эозин, х 200
Фото 55. Инвазивный дольковый РМЖ скиррозного строения G-2. Опухоль имеет плотную гиалинизированную строму, клетки рака формируют отдельные цепочки. Имеется инвазия жировой ткани. Гематоксилин-эозин, х 200
Фото 56. Инвазивный дольковый РМЖ скиррозного строения G2. Переневральная опухолевая инвазия. Гематоксилин-эозин, х 200.
Фото 57. Инвазивный дольковый РМЖ G-3. Опухолевые клетки весьма похожи на лимфоциты, отмечается диффузная инфильтрация. Размеры клеток разные, однако преобладают мелкие клетки. Гематоксилин-эозин, х 200
Фото 58. Инвазивный недифференцированный рак, вероятно из клеток долек G-4. Клетки рака полиморфные, цитоплазма скудная, однако они более мелкие, чем в протоковом раке, и располагаются разрозненно. Гематоксилин-эозин, х 200
Фото 59. Инвазивный дольковый РМЖ G-2. Клетки рака мелкие и формируют отдельные цепочки. В строме очаги гиалиноза. Гематоксилин-эозин, х 200
В 70–95% инвазивного долькового РМЖ отмечают позитивную экспрессию рецептора эстрогена, в то время как в протоковом раке этот рецептор выявляют в 70–80% случаев (фото 60). Рецептор прогестерона в обоих гистологических вариантах рака определяют с одинаковой частой — 60–70%. В высокодифференцированном дольковом РМЖ экспрессия рецептора эстрогена является наиболее высокой доходя до 100%. В плеоморфном варианте долькового рака ( G- 3) уровень экспрессии рецепторов стероидных гормонов снижается до 10% [209].
Фото 60. Инвазивный дольковый РМЖ. Экспрессия рецептора эстрогена (клон 1D5, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Отмечается позитивное окрашивание ядра опухолевых клеток, х 200
Исследование долькового рака с помощью проточной цитометрии позволило получить данные, свидетельствующие о том, что около 50% случаев долькового РМЖ являются диплоидными. Другие методы исследования, такие как цитогенетические или сравнительная геномная гибридизация, подтвердили снижение частоты хромосомных аномалий в дольковом раке по сравнению с протоковым. Наиболее частым геномным изменением долькового рака является потеря длинного плеча 16-й хромосомы (выявляют в 63–87% всех случаев).
Ген, кодирующий Е-кадгерин, находится в локусе 16 q 22. Нормальная работа этого гена обусловливает образование белка, обеспечивающего адгезию зрелого эпителия и дифференцировку клеток. Выявлена четкая корреляция между делецией 16 q и потерей экспрессии Е-кадгерина. Данные иммуногистохимического исследования долькового рака свидетельствуют о том, что в 80–100% случаев происходит полная потеря способности к синтезу указанного белка. В то же время при протоковом раке данные изменения отмечают только в 30–60% случаев. Учитывая результаты молекулярного анализа, можно отметить, что отсутствие экспрессии к Е-кадгерину в раковых клетках коррелирует с мутацией в сочетании с инактивацией аллеля дикого типа [1, 211]. Альтернативные механизмы также могут вызывать повреждение самого белка и/или кадгеринассоциированных белков.
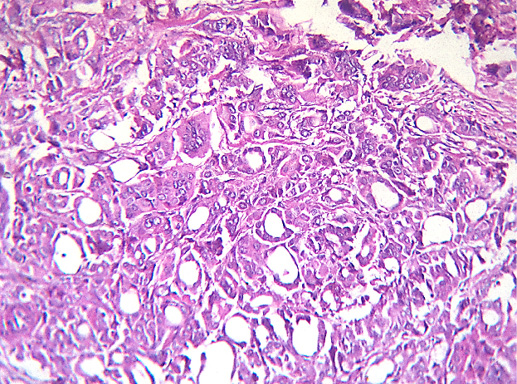
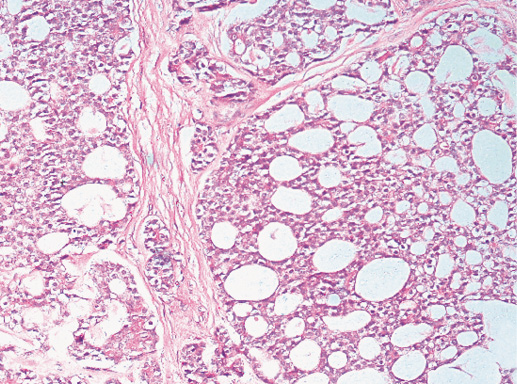
III. Тубулярный РМЖ
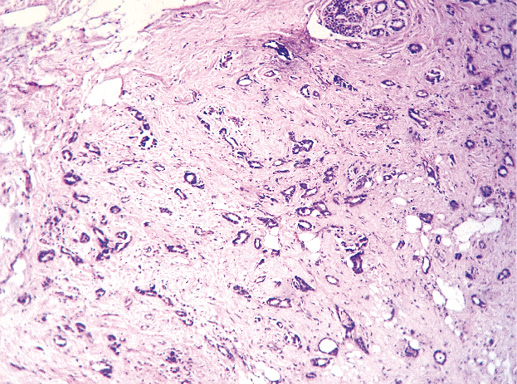
Этот вид РМЖ выделяют в отдельный вариант из-за особенностей клинического течения. Тубулярный РМЖ отличается благоприятным прогнозом, почти все пациентки с этим раком живут 10 лет и более. Морфологической отличительной чертой рака является тубулярное строение. Рак состоит из округлых трубочек, выстланных однорядным мономорфным эпителием, равномерно расположенных на фоне фиброзной стромы. Для тубулярного РМЖ всегда характерна высокая гистологическая дифференцировка.
Истинный тубулярный рак выявляют в 2% случаев инвазивных вариантов РМЖ. В случаях раннего рака (Т1) доля тубулярного рака повышается до 7%. По сравнению с типичным протоковым раком тубулярный рак диагностируют у больных пожилого возраста, он меньшего размера и редко дает метастазы в лимфатических узлах [1]. Нередко этот вариант рака ассоциирован с радиальным рубцом, дольковой неоплазией, внутрипротоковым раком высокого уровня дифференцировки.
По гистологическому строению тубулярный РМЖ похож на высокодифференцированный протоковый рак. Отличие состоит в том, что опухолевые трубочки построены исключительно из одного слоя клеток, причем клеточный полиморфизм в таких видах рака слабо выражен.
Нет единого мнения исследователей в отношении необходимой минимальной доли участков, имеющих типичное тубулярное строение, для установления диагноза «тубулярный рак». Для практических целей принято считать, что 90% всей опухоли должны занимать тубулярные структуры. Случаи рака, имеющего от 50 до 90% площади тубулярное строение, следует трактовать как смешанный рак.
Структуры склерозирующего аденоза, радиального рубца и микрогландулярного аденоза весьма сходны с тубулярным раком. Для дифференциальной диагностики в этих случаях необходимо провести иммуногистохимическое исследование. В доброкачественных процессах обязательно выявляют слой миоэпителия вокруг дольковых и протоковых структур.
Генетические аномалии при этой форме рака определяют реже, чем при других вариантах РМЖ. При использовании методов LOH и CGH наиболее частые изменения выявлены в локусах 16 q (потеря), 1 q (усиление), 8 p (потеря), 3 p FHIT- локус, 11 q ATM- локус. Важно отметить, что геномные изменения при тубулярном раке и других вариантах рака, по-видимому, свидетельствуют о генетических отличиях тубулярного рака (фото 61–63).
Фото 61. Тубулярный РМЖ. Опухолевые клетки формируют трубочки, их выстилка однорядная. Гематоксилин-эозин, х 100
Фото 62. Тубулярный РМЖ. Гематоксилин-эозин, х 200
Фото 63. Тубулярный РМЖ. Трубочки разного размера, эпителий преимущественно однорядный. Гематоксилин-эозин, х 200
Прогноз тубулярного РМЖ благоприятный, продолжительность жизни пациенток приближается к продолжительности жизни в популяции. Метастатическое поражение лимфатических узлов диагностируют крайне редко.
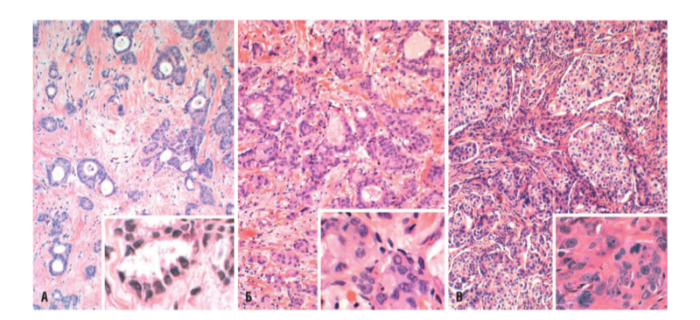
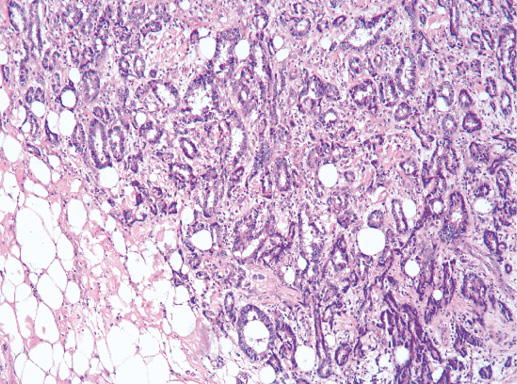
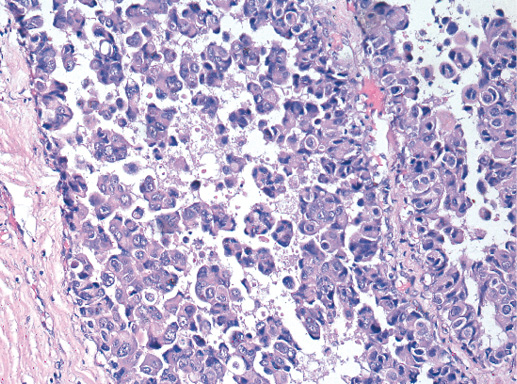
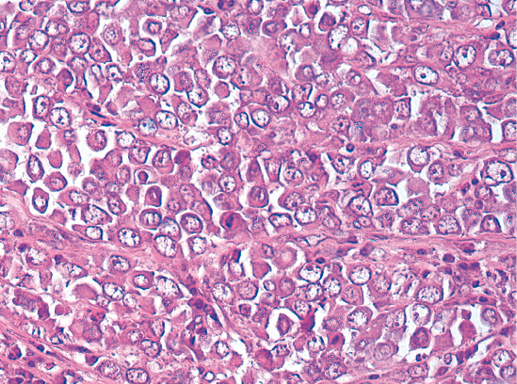
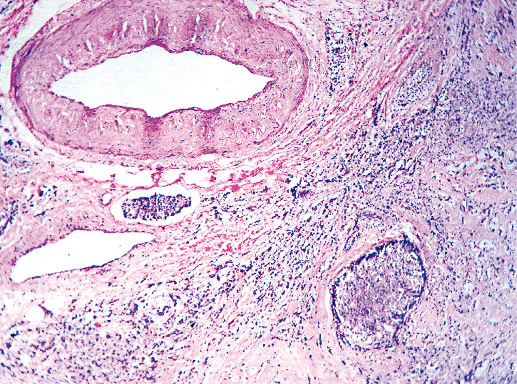
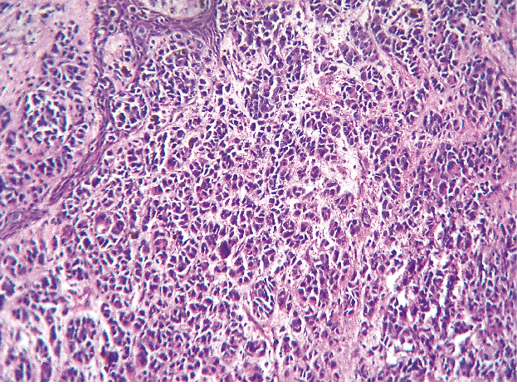
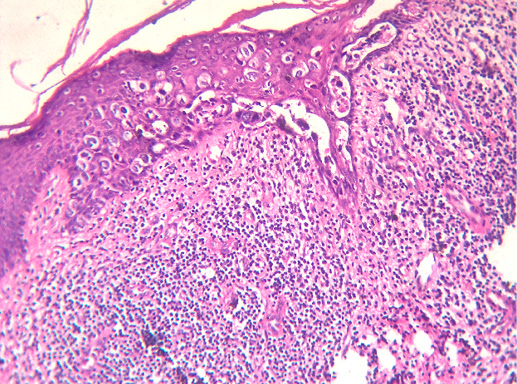
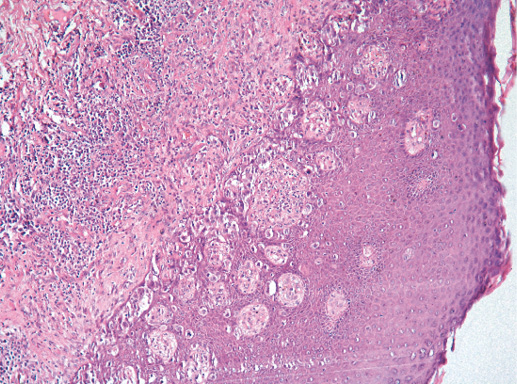
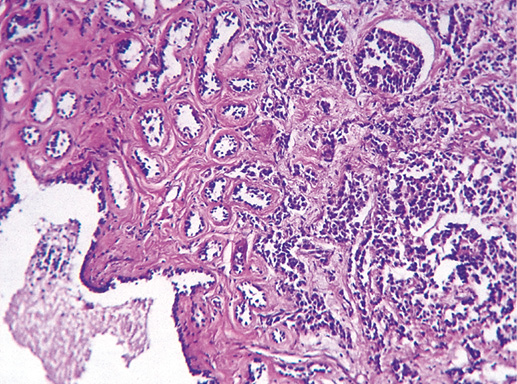
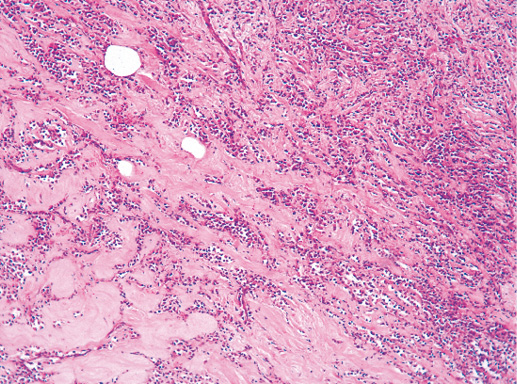
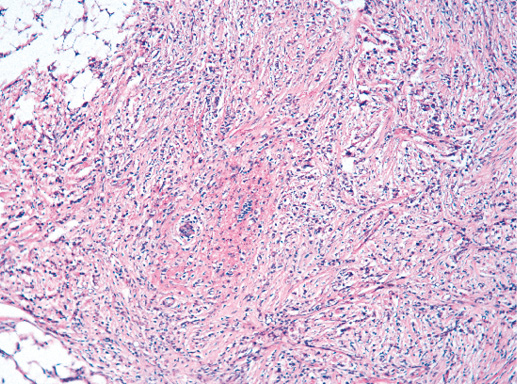
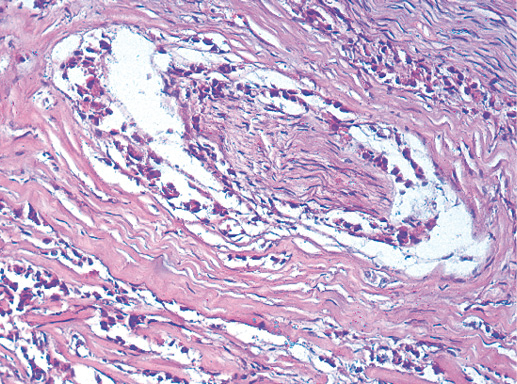
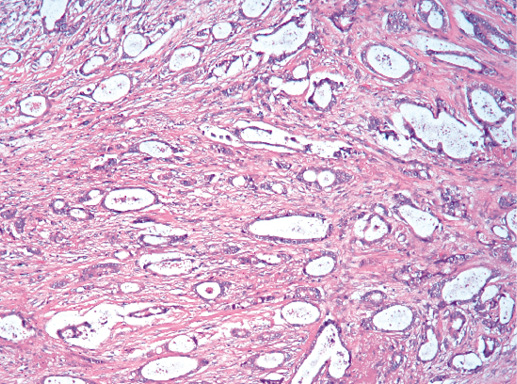
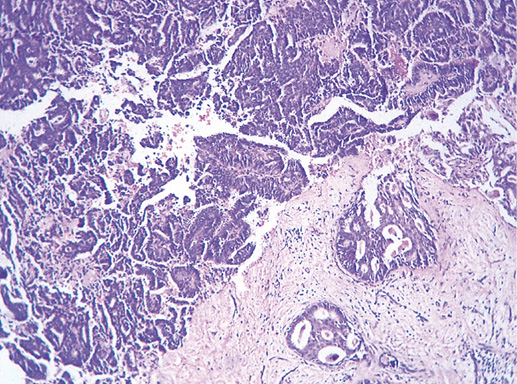
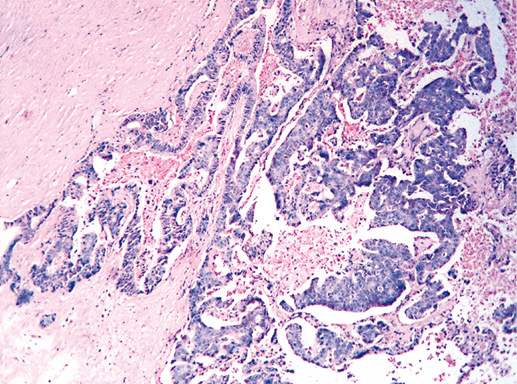
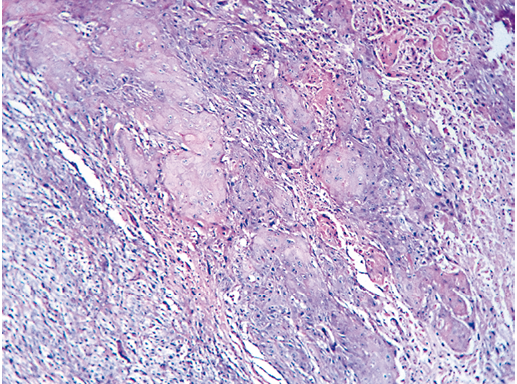
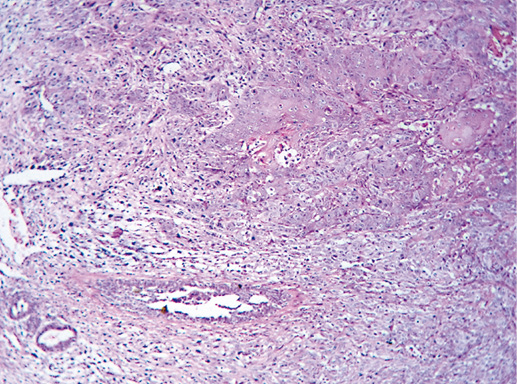
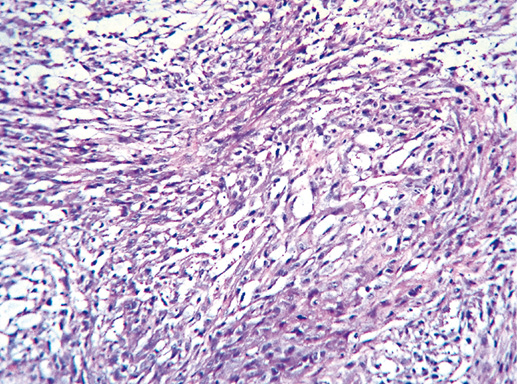
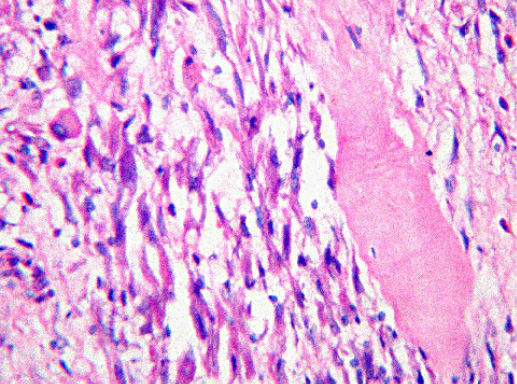
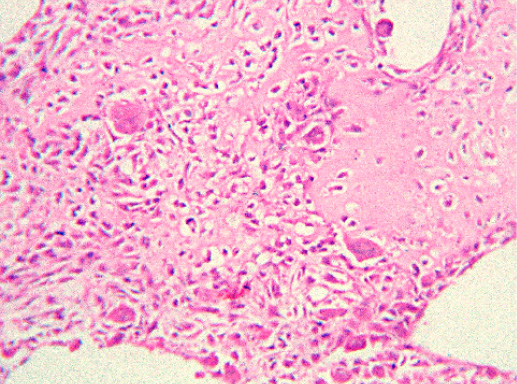
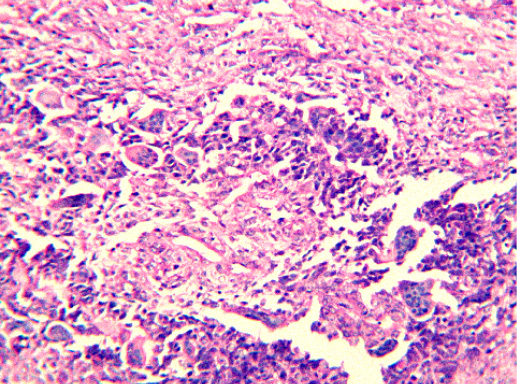
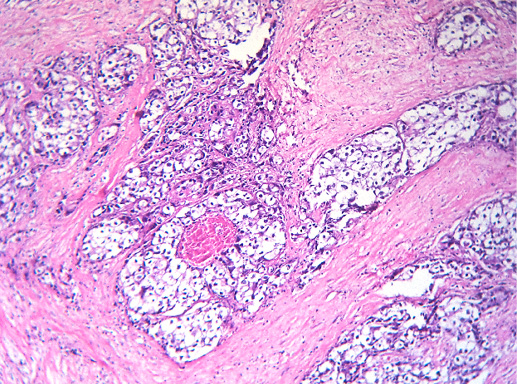
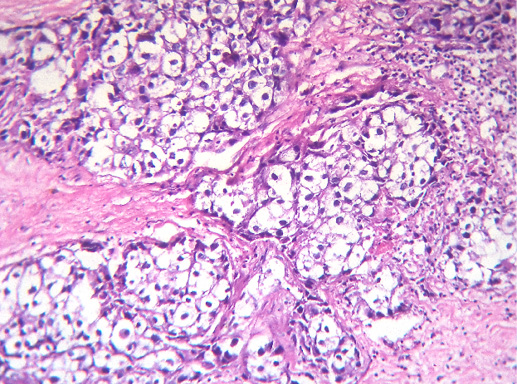
IV. Криброзный рак молочной железы
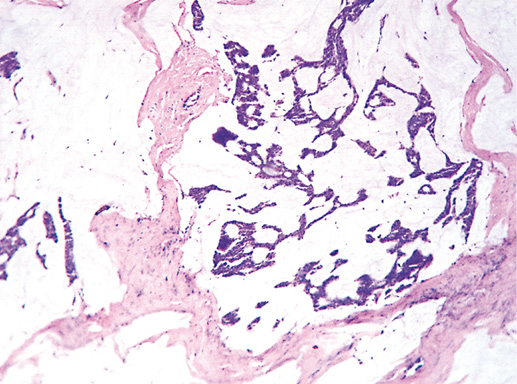
Криброзный РМЖ — редкий гистологический вариант, составляет от 0,8 до 3,5% всех случаев РМЖ. Этот вариант рака чаще выявляют у пациенток в возрасте 53 года–58 лет. Криброзный РМЖ характеризуется благоприятным клиническим течением и высокими показателями 10-летней выживаемости (от 90 до 100%). Довольно типичным признаком криброзного рака является наличие микрокальцинатов, в 20% случаев определяют мультифокальный тип роста.
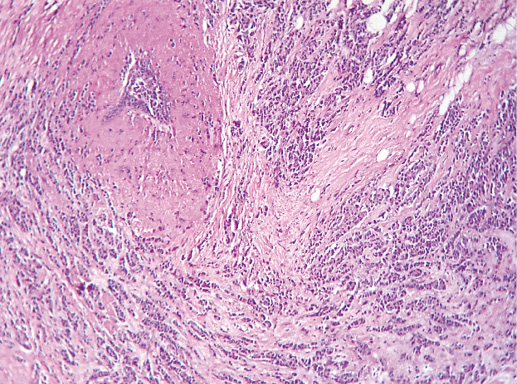
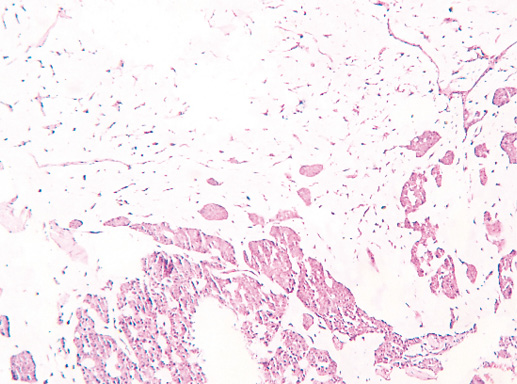
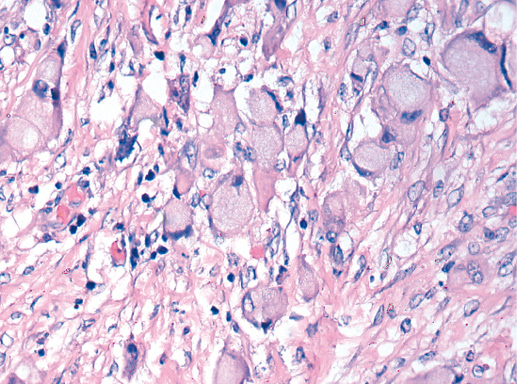
В опухоли преобладает характерный паттерн протоковой карциномы с внутрипротоковыми структурами в виде арок или сита, отмечают очаги инвазии. Некоторые протоки имеют вид причудливой решетки, определяют участки, характерные для внутрипротокового папиллярного рака и сосочкового рака. Данный гистологический вариант РМЖ похож на цилиндрому слюнной железы, поэтому иногда данный рак называют решетчатым раком или цилиндромой молочной железы.
Опухолевые клетки в основном дифференцированные, с незначительным ядерным полиморфизмом, митозы редки. В строме отмечают реактивную пролиферацию фибробластов.
Очаговые криброзные структуры часто выявляют во внутрипротоковых карциномах. Небольшие участки криброзной карциномы могут быть в структуре тубулярного рака.
Для криброзного рака характерна примесь различных гистологических вариантов рака в разном соотношении. Диагноз «инвазивный криброзный рак молочной железы» правомочен в случаях наличия протоковых структур с типичным криброзным строением в более чем 90% объема опухоли. В случаях сочетания участков криброзного и тубулярного морфологического строения диагноз «криброзный рак» устанавливают, если он составляет ≥ 50%. В остальных случаях рекомендуется пользоваться термином «смешанный рак».
Криброзный рак редко дает метастазы в лимфатических узлах (до 14,3%).
Клинический прогноз криброзного рака сходен с прогнозом для тубулярного РМЖ.
Дифференцировать криброзный РМЖ необходимо от аденоидно-кистозного рака и карциноидом. Для последнего характерны внутрицитоплазматические аргирофильные гранулы. Для аденоидно-кистозного рака типичным является сохранность белка ламинина в базальных мембранах, а при криброзном раке отмечают участки ее инвазии и соответственно разрушения целостности базальной мембраны (фото 64, 65).
Фото 64. Криброзный РМЖ. Опухоль имеет вид сита, преобладают протоковые структуры. Гематоксилин-эозин, х 100
Фото 65. Криброзный РМЖ. Гематоксилин-эозин, х 200
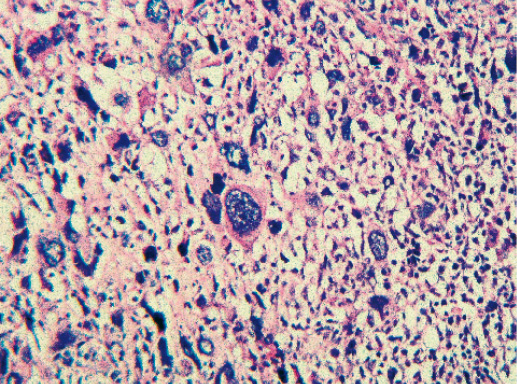
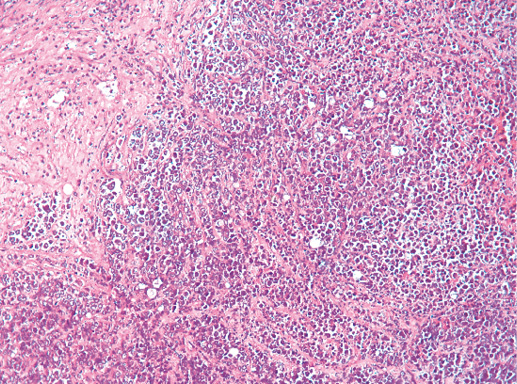
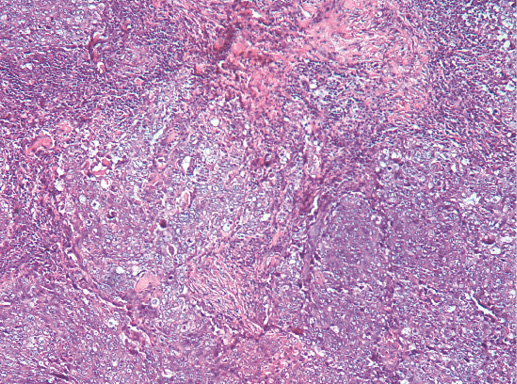
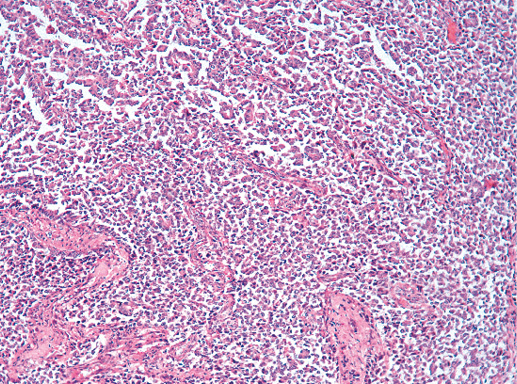
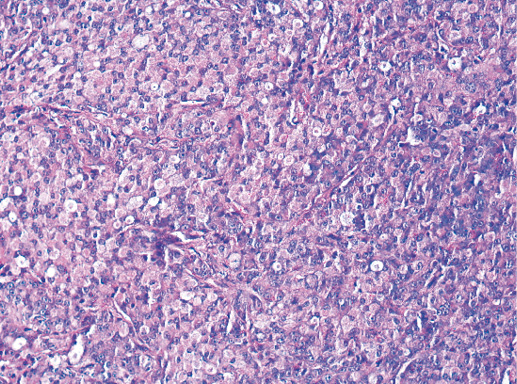
V. Медуллярный рак
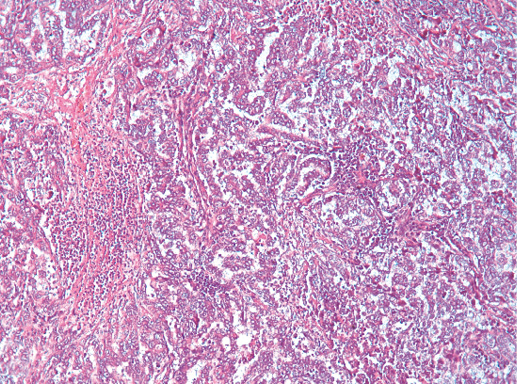
Медуллярный РМЖ — это хорошо отграниченная опухоль, построенная из низкодифференцированных клеток, которые формируют крупные пласты без железистых структур, строма скудная с выраженной лимфоплазмоцитарной инфильтрацией.
Медуллярный рак выявляют в 1–2% всех карцином молочной железы. Средний возраст женщин, у которых выявлен медуллярный рак, составляет 45 лет–52 года.
Опухоль хорошо очерчена, мягкая при пальпации. При маммографии этот вариант карцином может быть принят за доброкачественное поражение, поскольку имеет отчетливо округлую форму с четкой границей и мягкую консистенцию. Цвет опухоли различный: от телесно-коричневого до серого. Часто отмечают фокусы некроза и кровоизлияний. Средний диаметр колеблется в пределах от 2,0 до 9,0 см.
Выделяют 5 классических морфологических черт медуллярной карциномы:
1) синцитиальные структуры отмечают в более чем в 75% площади опухолевого среза. Опухолевые клетки формируют пласты, обычно в четыре-пять и больше слоев клеток, разделенных небольшим количеством соединительной ткани. Возможны фокусы некроза и плоскоклеточной дифференцировки;
2) опухолевые клетки не формируют железы и трубочки даже в небольшом количестве;
3) обращает внимание выраженная лимфоплазмоцитарная инфильтрация стромы. Плотность этого инфильтрата изменяется от случая к случаю, при этом мононуклеарные клетки могут быть единичными или настолько многочисленными, что полностью скрывают клетки опухоли. Возможны лимфоидные фолликулы и/или эпителиоидные гранулемы;
5) полная гистологическая картина опухоли лучше всего представлена при изучении ее на малом увеличении микроскопа. Края опухоли могут быть сдавлены за счет фиброза периферической ткани.
Кроме этих типичных морфологических признаков медуллярного РМЖ в опухоли часто присутствует компонент внутрипротокового рака, который расположен в окружающих опухоль, не связанных с опухолевой массой, тканях.
Эти диагностические признаки, особенно состояние краев, иногда трудно оценить на практике, что может привести к гиподиагностике медуллярной карциномы. Синцитиальный вид роста опухолевых клеток, отсутствие трубчатых образований, лимфоплазмоцитарный инфильтрат, редкость (менее 25%) некрозов в опухоли являются наиболее явными и характерными чертами медуллярной карциномы.
В случаях когда опухоль помимо явно медуллярного строения имеет и другую гистологическую картину, разные авторы предлагают различные формулировки диагноза [212–214]. При сочетании синцитиального компонента с лимфоидным инфильтратом и тубулярного компонента предложен термин «атипичный медуллярный рак» [214]. Однако в связи с отсутствием четких морфологических и клинических различий между атипичным медуллярным РМЖ и протоковым раком ряд исследователей предлагают не применять термин «атипичный медуллярный рак», а заменить его термином «инвазивный протоковый рак с медуллярными характеристиками».
Профиль цитокератинов типичной и атипичной медуллярной карциномы сходен и не имеет значительных отличий от обычной протоковой карциномы. Опухолевые клетки медуллярного рака имеют высокую адгезию, формируют пласты, что контрастирует с низкодифференцированным видом самих клеток и высоким митотическим индексом. Для рака характерна экспрессия межклеточных молекул адгезии-1 и Е-кадгерина. Это может считаться причиной медленного распространения опухоли и позднего поражения подмышечных лимфатических узлов.
В то время как протоковый РМЖ ассоциирован с вирусом Эпштейна — Барр в 31–51% случаев.
Фото 66. Медуллярный РМЖ. Пласты опухолевых клеток на фоне лимфоцитарной инфильтрации стромы. Гематоксилин-эозин, х 100
Фото 67. Медуллярный РМЖ. Клетки рака округлой формы со светлой цитоплазмой и пузырьковидным ядром, содержащим одно или несколько ядрышек. Гематоксилин-эозин, х 200
Медуллярная карцинома также характеризуется высоким уровнем повреждений ТР53. В 39–100% случаев выявляют соматическую мутацию и в 61–87% мутация связана с накоплением белка. Это отличает данную форму РМЖ от обычного протокового рака: там повреждения ТР53 определяют в 25–30% случаев. Неспецифическая мутация ТР53 характерна для медуллярной карциномы, сверхэкспрессия белка ТР53 может являться биологическим маркером вышеуказанной карциномы [219].
Считается, что медуллярный рак имеет более благоприятный прогноз, чем обычная инвазивная протоковая карцинома молочной железы, однако этот вопрос продолжает дискутироваться. В разных источниках прогноз оценивают по-разному [220]. 10-летняя выживаемость пациенток с медуллярной карциномой колеблется от 50 до 90%. Эти колебания могут объяснять различия в диагностических критериях. Медуллярная карцинома может давать метастазы в подмышечные лимфатические узлы, однако поражение лимфатических узлов выявляют менее чем в 10% случаев.
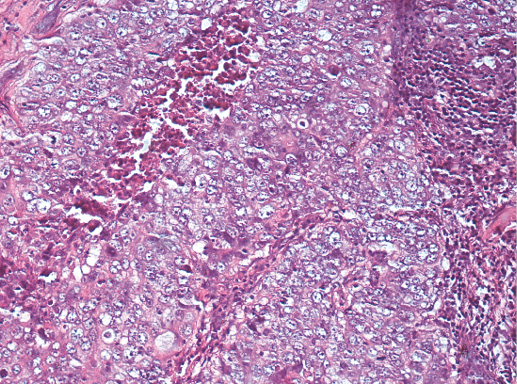
Эту группу составляют опухоли, в которых выражена вне- или внутриклеточная гиперпродукция слизи. В зависимости от уровня нарушения метаболизма гликопротеинов, составляющих основной компонент слизи, выделяют слизистый рак, цистаденокарциному, рак из цилиндрического эпителия со слизепродуцированием (из мукоцитов), перстневидно-клеточный рак.
Виды слизепродуцирующего рака составляют 2% в структуре всех типов РМЖ. Их могут диагностировать в любом возрасте, но наиболее часто у женщин старше 60 лет.
Вид опухоли довольно характерный. Она очень мягкая (в виде желе), представляет собой четко отграниченный от окружающих тканей узел серого цвета, иногда опухоль не отграничена (см. фото 34).
Характерной гистологической картиной слизистого рака являются обширные поля слизи, в которых находятся комплексы мелких клеток. Нежные фиброзные перегородки могут разделять поля слизи на участки. В опухолевых клетках слабо выражена цитоплазма, расположены как по отдельности, так и группами, формируя мелкие тубулярные, редко микропапиллярные комплексы. В слизистом раке, как правило, нет атипии клеток, содержится большое количество митозов, микрокальцинатов. Внутрицитоплазматический муцин практически всегда отсутствует, в то же время внеклеточная слизь обильна и хорошо окрашивается муцикармином. Значительная часть слизистых карцином имеет нейроэндокринную дифференцировку, которая подтверждается позитивной реакцией с антителами, выявляющими хромогранин А и синаптофизин [221].
Некоторые авторы для слизистого рака с нейроэндокринной активностью предлагают термин «клеточный слизистый рак», хотя не существует корреляции между гормональной активностью рака и клеточностью опухоли.
Традиционно типы слизистого РМЖ разделяют на истинные и смешанные. В смешанных вариантах слизистого рака в диагнозе должны быть указаны все типы роста рака в долевом соотношении. Типичным компонентом, сочетающимся со слизистым раком, является инвазивный протоковый рак.
Истинно слизистый рак в свою очередь подразделяют на клеточный и малоклеточный. Как уже упоминалось, иногда клетки клеточного подтипа истинного слизистого рака содержат внутрицитоплазматический муцин и аргирофильные гранулы (фото 68, 69).
Фото 68. Слизистый РМЖ. Комплексы опухолевых клеток среди муцина. Гематоксилин-эозин, х 100
Фото 69. Слизистый РМЖ. Папиллярные структуры раковых клеток на фоне муцина. Гематоксилин-эозин, х 100
Прогноз слизистого РМЖ в целом благоприятный. Степень нейроэндокринной активности не коррелирует с прогнозом. Высокая клеточность рака является факторам, ухудшающим прогноз. В случае смешанного типа слизистого рака прогноз менее благоприятный, чем при истинном типе. Так, 5-летняя смертность вследствии истинного типа составила 10% в противовес 29% при смешанном типе слизистого рака. Вовлечение аксиллярных лимфатических узлов отмечали в 3–15% случаях истинного слизистого рака и в 33–46% — смешанного типа.
Описана казуистическая причина смерти у пациентки, связанная с инфарктом головного мозга вследствие эмболии муцином мозговых артерий [222].
Цистаденокарцинома и рак из цилиндрических мукоцитов по своему гистологическому строению очень сходны с раком яичника. Это редкие формы РМЖ. Так, муцинозная цистаденокарцинома описана только в четырех наблюдениях, а рак из цилиндрических мукоцитов в двух [223].
Гистологическое строение этих опухолей похоже на аденокарциному яичника. Вид клеток также аналогичен таковым при раке яичника. Муциноциты — это высокие клетки с оптически пустой цитоплазмой и со смещенным в базальную часть клетки ядром. Включение в ряд типичных клеток вышеуказанного строения клеток с эозинофильной трансформацией цитоплазмы является неблагоприятным прогностическим маркером, так как инвазия и метастазирование осуществляется в основном за счет клеток именно этого типа. В 2-летних наблюдениях ни у одной из женщин не выявлено признаков рецидива или метастазирования [1].
Перстневидно-клеточный рак имеет два типа роста: в виде мишени, как при классическом дольковом раке, и в виде диффузного роста опухолевых клеток, как при диффузном перстневидно-клеточном раке желудка. Клетки рака со светлой обильной цитоплазмой (фото 70, 71).
Фото 70. Перстневидно-клеточный РМЖ, рост клеток рака в виде мишени. Гематоксилин-эозин, х 100
Фото 71. Перстневидно-клеточный РМЖ, диффузный рост клеток рака. Гематоксилин-эозин, х 400
Гистологическое строение опухоли из нейроэндокринных клеток одинаковое независимо от органа поражения. Они могут иметь типичный карциноидный или недифференцированный вид. В раке недифференцированного нейроэндокринного типа отмечают способность к слизепродуцированию, что может затруднить диагностику этого гистологического варианта.
Выявление белков-маркеров, характерных для нейроэндокринной дифференцировки, в отдельных клетках рака не дает права для выделения такого случая в группу нейроэндокринных опухолей. Для постановки диагноза необходимо доказать продукцию нейроэндокринных гранул у 50% и выше клеточной популяции рака.
Нейроэндокринные опухоли диагностируют у 2–5% пациенток с РМЖ. В клинике нейроэндокринного рака крайне редко отмечают проявление синдрома нейроэндокринной секреции, в то же время при лабораторных исследованиях определяют повышенный уровень в крови хромогранина А.
В зависимости от вида роста и степени анаплазии клеток выделяют солидный нейроэндокринный рак, мелко/овсяноклеточный рак, нейроэндокринный крупноклеточный рак.
Солидный нейроэндокринный рак характеризуется сплошным типом роста с гнездными или трабекулярными структурами, с тонкими фиброваскулярными перегородками. Редко можно отметить образование структур типа розеток или палисадов. В соседних участках можно видеть внутрипротоковый папиллярный или дольковый рак. Митотическая активность клеток возрастает в альвеолярных участках рака.
Мелко/овсяноклеточный РМЖ по морфологической характеристике и иммунофенотипу неотличим от мелко/овсяноклеточного рака легкого. Часто отмечают метастазирование по ходу лимфатических сосудов.
Нейроэндокринный крупноклеточный рак построен из крупного или среднего размера клеток, расположенных хаотично. В опухоли выражен полиморфизм клеток и высокий уровень митотической активности.
Иногда трудно бывает отличить первичную нейроэндокринную опухоль молочной железы от метастаза. Для первичного поражения молочной железы типичным является позитивная реакция опухолевых клеток к цитокератину 7 и негативная к цитокератину 20, также характерно наличие в близлежащих тканях внутрипротокового рака. Важна также информация о наличии рецепторов эстрогена и прогестерона в ядрах клеток рака. При нейроэндокринных раках в 100% клеток сохраняется экспрессия Е-кадгерина, что позволяет дифференцировать его от долькового рака [1].
Прогноз зависит исключительно от степени атипии клеток, причем следует учитывать, что мелкоклеточные варианты всегда рассматривают как недифференцированные (фото 72).
Фото 72. Нейроэндокринный (овсяноклеточный) РМЖ из мелких клеток, недифференцированный тип. Гематоксилин-эозин, х 100
Специфических генных аномалий при нейроэндокринных раках не выявлено.
VIII. Инвазивный папиллярный рак
Это форма РМЖ с более благоприятным прогнозом. Составляет 1–2% в структуре РМЖ. Термин не следует использовать для определения инвазивного РМЖ, утратившего папиллярное строение в своем инвазивном компоненте, даже при условии сохранения его в небольших неинвазивных участках рака. Среди пациенток с этим раком преобладают женщины в постменопаузальный период.
Опухоль характеризуется прежде всего мягкой консистенцией, но не такой как консистенция медуллярного рака. Структура опухоли более рыхлая, напоминающая рак мочевого пузыря. В случае внутрикистозной локализации опухоли можно четко выявить папиллярный тип роста.
Характерным микроскопическим признаком данной опухоли является образование сосочковых структур. Это классические папиллярные структуры, более грубые или более нежные в зависимости от степени развития стромы. По периферии инвазивного папиллярного рака отмечают поля солидного роста. Клетки опухоли имеют апокриновый тип строения, с более или менее выраженной цитоплазмой. В ⅓ случаев выявляют инвазию лимфатических сосудов. В 23% случаев отмечено вовлечение в опухолевый процесс кожи или соска, но без педжетоидной трансформации [224].
Результаты разных исследований показывают разную выживаемость [224, 225]. Достоверно прогнозировать клиническое течение рака только на основании гистологического строения опухоли невозможно, и только наличие метастазов в аксиллярных лимфатических узлах позволяет создать предварительную картину выживаемости (фото 73–75).
Фото 73. Инвазивный папиллярный РМЖ. Гематоксилин-эозин, х 100
Фото 74. Инвазивный папиллярный РМЖ. Гематоксилин-эозин, х 100
Фото 75. Инвазивный папиллярный РМЖ. Гематоксилин-эозин, х 100
IX. Инвазивный микропапиллярный рак
Характеризуется наличием мелких гнезд опухолевых клеток, лежащих в ячейках светлой стромы. Анализ показывает большую склонность к инвазии стенки сосудов.
Частота заболеваемости этим видом рака составляет менее 2%, хотя в 3–6% случаев инвазивного РМЖ также можно выявить участки микропапиллярного роста.
Типичным является расположение мелких желез как бы в пустоте, клеточный полиморфизм слабо выражен, нехарактерны некрозы и лимфоидная инфильтрация стромы (фото 76). Довольно часто в инвазивном микропапиллярном раке выявляют инвазию стенки сосудов (60%). В 72–77% первично выявленного рака отмечают наличие метастазов в периферических лимфатических узлах (фото 76).
Фото 76. Инвазивный микропапиллярный РМЖ. Опухолевые клетки с признаками апокринизации. Гематоксилин-эозин, х 200
Х. Апокриновый рак
При апокриновом раке более 90% опухолевой массы составляют клетки с признаками апокринизации. Нужно отметить, что данная форма не имеет практического значения, а только теоретический интерес. Апокриновый рак не имеет особенностей клинического течения и прогноза.
Апокриновый рак может быть представлен двумя типами клеток: А и В. Клетки типа А — крупные, с выраженной монотонной эозинофильной цитоплазмой, их ядра крупные, светлые, похожие на клетки зернисто-клеточной опухоли. Клетки типа В подобны клеткам гистиоцитарно-макрофагального происхождения и клеткам сального ( sebaceous ) рака. Отличие клеток от рака последнего типа заключается в отсутствии мелких светлых вакуолей липидов, цитоплазма апокринового рака монотонно светлая.
ХI. Метапластический рак
Под термином «метапластический рак» объединяют гетерогенную группу опухолей, для которых характерно наличие участков опухоли различного строения: аденокарциномы, плоскоклеточной карциномы, опухоли из веретеновидной клетки, участков мезенхимальной дифференцировки.
Метапластические карциномы составляют менее 1% всех инвазивных РМЖ. По имеющимся данным средний возраст больных 55 лет.
Клинические признаки данной опухоли не отличаются от инвазивной протоковой карциномы. В большинстве случаев отмечают хорошо отграниченную опухоль размером 3–4 см, однако существуют образования более 20 см, которые могут смещать сосок и изъязвлять кожу. На маммаграмме большинство случаев рака метапластического типа выглядит в виде четко очерченного узла, иногда с микрокальцинатами.
Опухоль плотная на ощупь, хорошо отграничена от окружающей ткани. Зоны с плоскоклеточной или хондроидной дифференцировкой на поверхности разреза серого цвета, блестящие. В толще больших плоскоклеточных опухолей могут находиться одна большая киста или несколько мелких (фото 80).
Фото 80. Внешний вид злокачественной листовидной опухоли, содержащей малигнизированный эпителиальный и стромальный компонент
В зависимости от морфологического строения метапластические карциномы разделяют на подтипы: плоскоклеточный рак, аденокарцинома с веретеноклеточной метаплазией, аденосквамозная (железисто-плоскоклеточная) карцинома, смешанная эпителиально/мезенхимальная метапластическая карцинома, высокодифференцированная железисто-плоскоклеточная карцинома и другие.
Метапластическая плоскоклеточная карцинома молочной железы полностью построена из малигнизированного плоского эпителия с признаками ороговения или без них. Как и в других органах, плоскоклеточный рак может быть представлен веретенообразными клетками (фото 77, 78). Однако для установления диагноза необходимо исключить рак кожи или метастаз плоскоклеточного рака.
Фото 77. Метапластический рак. Видны очаги плоскоклеточной метаплазии с ороговением. Гематоксилин-эозин, х 100
Фото 78. Метапластический рак. Опухоль из веретенообразных клеток с очагами плоскоклеточной метаплазии. Гематоксилин-эозин, х 100
Плоскоклеточный РМЖ делят на фенотипы: крупноклеточный ороговевающий, неороговевающий, веретеноклеточный и акантотический. Возможны комбинации этих типов. Наиболее высокодифференцированные клетки часто ограничивают кистозные полости, в ходе распространения опухолевых клеток в окружающую строму эти клетки принимают веретеновидную форму и теряют черты, характерные для плоского эпителия. В участках веретеноклеточной карциномы нередко отмечают пролиферацию стромальных клеточных элементов. Степень дифференцировки плоскоклеточной карциномы молочной железы зависит в основном от ядерной атипии.
Веретеноклеточный и акантотический варианты рака требуют иммуногистохимического подтверждения их эпителиальной природы. Эпителиальные опухолевые клетки дают позитивную реакцию с высокомолекулярными цитокератинами (CK5 и CK34betaE12), но негативную с маркерами сарком. Практически во всех метапластических карциномах молочной железы не выявляют рецепторов эстрогена и прогестерона (фото 77–79).
Аденокарцинома с веретеноклеточной метаплазией — это инвазивная карцинома с выраженной веретеноклеточной трансформацией (фото 79). Веретеновидные клетки скорее всего образуются из железистого эпителия.
Фото 79. Метапластический рак. Опухоль из веретенообразных клеток. Гематоксилин-эозин, х 100
Эту опухоль диагностируют главным образом у женщин в постменопаузальный период.
Опухоль состоит из тубулярных структур аденокарциномы, смешанных с опухолевыми веретеновидными клетками. Веретеновидные клетки имеют позитивную реакцию с эпителиальными маркерами, в том числе с цитокератином 7, но не с цитокератинами 5 и 6 или другими маркерами плоскоклеточной и миоэпителиальной дифференцировки.
Аденосквамозная (железисто-плоскоклеточная) карцинома — инвазивная карцинома с зонами хорошо развитых трубчато-железистых образований и широко распространенными солидными гнездами плоского эпителия.
Плоскоклеточный компонент дает отрицательную реакцию с антителами, выявляющими рецепторы эстрогена и прогестерона, в то время как протоковый компонент этих опухолей чаще позитивную.
Высокодифференцированная железисто-плоскоклеточная карцинома — это вариант метапластической карциномы, морфологическое строение которой похоже на аденосквамозную карциному кожи. Поэтому этот тип рака классифицировался некоторыми авторами как сирингоматозная плоскоклеточная опухоль. Другие авторы обозначали ее как инфильтративную сирингоаденому с часто рецидивирующим после локального иссечения течением.
Возрастной диапазон заболевания широк. Опухоль, как правило, выявляют в виде небольшой пальпируемой массы размером от 5 до 80 мм.
Данный тип опухолей состоит из мелких железистых и солидных структур эпителиальных клеток, расположенных в веретеноклеточном стромальном компоненте. Соотношение всех этих компонентов отличается от случая к случаю. Солидные гнезда клеток могут содержать плоские клетки, роговые «жемчужины» или кистозные образования из плоских клеток.
Аденосквамозный рак, как правило, имеет очень хороший прогноз, но в ряде случаев может давать рецидивы, что связано с неадекватностью локального иссечения. Метастатическое поражение лимфатических узлов отмечают редко.
Смешанные эпителиально-мезенхимальные метапластические карциномы (карцинома с остеоидной метаплазией, карцинома с хондроидной метаплазией, карциносаркома ).
Это большая группа опухолей, для которых характерна смесь инфильтративной карциномы с гетерологическими мезенхимальными элементами в виде участков хрящеобразования, а также с костной мышечной, жировой, фиброзной дифференцировкой. Термин «карциносаркома» используют в случаях озлокачествления мезенхимального компонента. Определение степени злокачественности базируется на ядерных признаках и в меньшей степени на признаках цитоплазмы (фото 80–84).
Фото 81. Смешанная эпителиально-мезенхимальная опухоль с участком рабдоидной дифференцировки. Гематоксилин-эозин, х 100
Фото 82. Смешанная эпителиально-мезенхимальная опухоль, рабдоидная дифференцировка. Экспрессия Myogenina (клон F5D, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Отмечается позитивное окрашивание ядра опухолевых клеток, что характерно для РМЖ, х 200
Фото 83. Смешанная эпителиально-мезенхимальная опухоль, участок с остеогенной дифференцировкой. Гематоксилин-эозин, х 100
Фото 84. Карциносаркома молочной железы. Гематоксилин-эозин, х 100
Веретеноклеточные элементы часто экспрессируют цитокератины, хондроидные элементы белок S-100, однако могут отмечать коэкспрессию цитокератинов. Гладкомышечный актин в этих опухолях не выявляют. Как правило, рецепторы эстрогена и прогестерона как в участках аденокарциномы, так и мезенхимальной дифференцировки отсутствуют.
В случаях низкой дифференцировки карциносарком мезенхимальный компонент теряет любую иммунореактивность.
Дифференциальную диагностику между различными вариантами сарком и карциносаркомой проводят с помощью иммуногистохимических исследований.
Ангиосаркома по морфологическому строению похожа на веретеноклеточную плоскоклеточную карциному, однако наличие участков сквамозной дифференцировки облегчает диагностику. Наличие участков эпителиальной опухоли подтверждает негативная реакция с сосудистыми эндотелиальными маркерами ( CD 34, CD 31) и позитивная — с цитокератинами.
Плоскоклеточную и железисто-плоскоклеточную карциному следует отличать от плеоморфной карциномы, для которой характерна смесь любого вида роста с большим количеством причудливых гигантских клеток; это важно, так как плеоморфная карцинома более агрессивна, чем любая разновидность плоскоклеточной или железисто-плоскоклеточной карциномы молочной железы.
Аденокарциному с хондроидной дифференцировкой нужно отличать от плеоморфной аденомы. Последняя неизменно имеет миоэпителиальный компонент (который иногда может доминировать), растущий вокруг пространств, ограниченных доброкачественными эпителиальными клетками. Миоэпителиальные клетки не определяют в аденокарциномах с хондроидной дифференцировкой.
Большинство известных метапластических карцином имели размер более 3–4 см. Метастазы в регионарных лимфатических узлах выявляли относительно редко. В подмышечные лифатические узлы метастазируют приблизительно 10–15% опухоли с плоскоклеточной метаплазией, около 19–25% с костно-хрящевой. Отдаленные метастазы отмечены в 21% случаев смешанной эпителиально-мезенхимальной метапластической карциномы.
Метапластические карциномы в лимфатических узлах сохраняют кроме участков рака и очаги метаплазии, как и в первичной опухоли.
Карциносаркомы очень агрессивные опухоли. При этом эпителиальный и мезенхимальный компоненты опухоли могут метастазировать как совместно, так и поодиночке.
5-летняя выживаемость больных карциносаркомами с костно-хрящевой дифференцировкой составляет 28-68%. Выживаемость больных с веретеноклеточной или плоскоклеточной карциномой составляет 5 лет в 63% случаев. Вовлечение лимфатических узлов в опухолевый процесс всегда связано с более агрессивным клиническим течением.
Среди плоскоклеточных карцином акантотический вариант является самым агрессивным.
На сегодня существует недостаточно информации об эффективности лечения метапластических карцином.
XІІ. Редкие варианты рака молочной железы
При раке, богатом липидами, 90% клеток опухоли содержат в цитоплазме нейтральные жиры (фото 85, 86). Их ядра, в отличие от липоцитов, четко определяются и находятся в центре клеток. Существуют разные сообщения относительно частоты выявляемости этой формы опухоли: от 1 до 6%, хотя за 12-летний период в AFIP наблюдали только четыре достоверно изученных случая [1].
Фото 85. Рак из клеток, богатых липидами. Гематоксилин-эозин, х 100
Фото 86. Рак из клеток с высоким содержанием липидов. Гематоксилин-эозин, х 200
Фото 87. Рак с высоким содержанием гликогена. Гематоксилин-эозин, х 200
Надо отметить, что у >75% случаев РМЖ выявляют в незначительной доле клеток жировые капли, но это не позволяет поставить диагноз рака с высоким содержанием липидов.
В типичных случаях диагностируют опухоль высокой степени злокачественности ( G- 3). Противоречивые данные получены относительно гормонального статуса.
Несмотря на позитивную корреляцию между накоплением жиров и низкой степенью дифференцировки опухоли, нельзя сказать, что липидсодержащие формы рака более агрессивны. Однако для оценки прогноза получено еще недостаточное количество материала.
Секреторный рак, или ювенильный рак, — это оригинальная форма рака, выявляемая преимущественно у женщин в возрасте младше 30 лет. Типичной является морфологическая структура рака в виде «пчелиных сот», при этом формируются так называемые микрокисты. Частым местом локализации секреторного рака является область вблизи соска.
Не следует использовать термин «секреторный рак» для иных форм рака, так как это может внести путаницу в понимание сути процесса.
Опухоль может достигать больших размеров (до 12 см), особенно у пациенток более старшего возраста. Поверхность разреза опухоли серо-белого или желтого цвета. При микроскопическом исследовании часто можно видеть инвазию жировой ткани. Рак может формировать три вида морфологических структур:
Клетки, составляющие секреторный рак, представлены двумя принципиальными типами:
У детей и подростков прогноз благоприятный, у них не описано ни одного летального случая. Но клинический прогноз ухудшается по мере увеличения возраста пациенток.
Онкоцитарный рак — это опухоль, состоящая на 70% из «набухших» клеток с эозинофильной цитоплазмой. Отличительным признаком этого рака является выраженная иммунореактивность с антимитохондриальными антителами.
На ультраструктурном уровне выявлено, что 60% цитоплазмы занято митохондриями.
Клетки онкоцитарного рака имеют четко очерченную цитоплазму с эозинофильными зернистыми включениями.
Заболевание редкое, описаны единичные случаи онкоцитарного РМЖ, что не позволяет оценить прогноз заболевания. Морфологическая картина этого рака похожа на апокриновый рак. Достоверная верификация онкоцитарного рака возможна только при применении иммуногистохимических методов исследования.
Аденоидно-кистозный рак аналогичен раку слюнной железы, легких и цервикального канала. Отличается от криброзного протокового рака сохранной базальной мембраной и сохранным слоем миоэпителия.
Только 0,1% случаев всех типов РМЖ представлены именно этой формой. В ряде исследований показана гипердиагностика аденоидно-кистозного рака, что нежелательно, так как эта форма более благоприятно протекает по сравнению с классическим протоковым инвазивным раком.
Обычно в процесс вовлекаются суб- и периареолярные зоны, размеры опухоли могут достигать 12 см.
Выделяют следующие гистологические варианты аденоидно-кистозного РМЖ:
Такая морфология отражает наличие клеток двух типов. Базалоидные клетки, образующие криброзные структуры, имеют скудную цитоплазму, округлое ядро. При электронной микроскопии выявлено наличие тонких филаментов в цитоплазме с фокальной конденсацией. Отмечена экспрессия белка актомиозина, что свидетельствует в пользу фенотипического сходства с миоэпителием. Если железистые клетки кубовидной формы, их строение типично секреторное (наличие микроворсинок), если же веретенщиков формы, в цитоплазме выявляют тонофиламенты. Секреторный тип клеток дает позитивную реакцию с цитокератином 7. Железистые клетки характеризуются более эозинофильной цитоплазмой. Описан также еще один тип клеток — это себацейные клетки или сходные с ними.
Для аденоидно-кистозного рака нетипично наличие протокового рака in situ по периферии. Иногда отмечают ассоциацию с аденомиоэпителиомой и зрелой аденосквамозной карциномой. Экспрессия рецепторов эстрогена и прогестерона не характерна.
Светлоклеточный рак, богатый гликогеном, состоит из светлых клеток, неотличимых от рака почки или мезонефрального рака матки. Диагноз правомочен при выявлении гликогена и при исключении метастатического происхождения опухоли. Частота возникновения составляет 1–3% всех типов РМЖ. Более 90% клеток опухоли содержат в цитоплазме существенное количество гликогена. В 58% случаев РМЖ выявляют интрацитоплазматический гликоген, но без светлоклеточного вида роста. Структура опухоли может быть как сплошная (солидная), так и с сохранением протокового расположения клеток. Рецепторный статус эстрогена и прогестерона не отличается от такового при протоковом раке. В литературе есть указания на большую агрессивность этих видов рака, но достоверный прогноз течения заболевания указать сложно вследствие редкости светлоклеточного рака (табл. 1).
Дифференциальная диагностика форм РМЖ со светлоклеточным видом роста