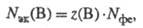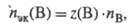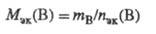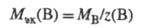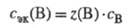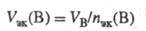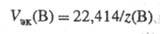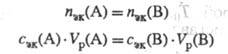Мэк в химии что это
Метилэтилкетон
(Бутанон)
Метилэтилкетон, также известен как бутанон или МЭК, представляет собой органическое соединение с формулой CH3C(O)CH2CH3. Бесцветный жидкий кетон имеет резкий, сладковатый запах напоминает ириску и ацетон. Он производится промышленно в заводских условиях, а также встречается в небольших количествах в природе. Трудно растворим в воде, широко используется в качестве промышленного растворителя. Бутанон является эффективным и распространенным растворителем и используется в процессах с участием камеди, смолы, ацетилцеллюлозы, для производства нитроцеллюлозных покрытий и виниловой пленки. По этой причине он находит применение в производстве пластмасс, текстиля, в производстве парафина, и в бытовых изделиях, таких как лак, олифа, смывки, денатурирующий агент для денатурированного спирта, клеев и в качестве чистящего средства. Он имеет схожие свойства растворителя с ацетоном, но кипит при более высокой температуре и имеет значительно более медленную скорость испарения. Бутанон также используется в легко стираемых маркерах в качестве растворителя для стираемой краски. Поскольку бутанон растворяет полистирол, он продается как «модель цемент» для использования в соединении частей масштабных моделей-копий. Хотя он часто рассматривается как клей, на самом деле в данном применении он функционирует как сварной агент. Поскольку бутанон растворяет полистирол, он продается как «модель цемент» для использования в соединении частей масштабных моделей-копий. Хотя он часто рассматривается как клей, на самом деле в данном применении он функционирует как сварной агент.
Описание
Химическое соединение класса кетонов, бесцветная легколетучая жидкость с запахом, напоминающим запах ацетона, но более слабым по силе.
Применение
Метилэтилкетон используют как растворитель для нитроцеллюлозных, полиакриловых, перхлорвиниловых лкм, в производстве линолеума, а также клеев, депарафинизации масел для смазки, краски для типографии, чернил, а также в качестве обемасливающего состава для парафинов (для того, чтобы удалить низкоплавкий парафин в смеси с маслами).
Основные физические свойства метилэтилкетона
Информация о токсичности
Влияние высоких концентраций
Вещество раздражает глаза и дыхательные пути. Может оказывать действие на центральную нервную систему. Воздействие на уровне, значительно превышающем ПДК может вызвать потерю сознания.
Опасность при постоянном контакте
Жидкость обезжиривает кожу. Исследования на животных показывают, что вещество, возможно, оказывает токсическое действие на репродуктивную функцию человека.
Пожарная опасность
Пар тяжелее воздуха и может стелиться по земле; возможно возгорание на расстоянии.
Реагирует бурно с сильными окислителями и неорганическими кислотами с опасностью пожара и взрыва. Агрессивно в отношении некоторых пластиков.
Метилэтилкетон должен соответствовать требованиям и нормам, указанным в таблице
Что такое Метилэтилкетон?
Метилэтилкетон – бесцветная и легколетучая жидкость с определенным запахом, который напоминает ацетон, химическое соединение класса кетонов. Эта жидкость обладает всеми химическими свойствами, которые характерны для алифатических кетонов и применяется в качестве растворителя и сырья в органическом синтезе.
Метилэтилкетон применяется как промежуточный продукт, в производстве пероксида метилэтилкетона, втор-бутиламина и др. Также эту жидкость применяют как растворитель нитроцеллюлозных, перхлорвиниловых, полиакриловых лакокрасочных материалов, а также клеев, депарафинизации смазочных масел, типографических красок и обезмасливания парафинов.
Недостатками процесса получения МЭК являются – образования сточных вод в момент гидратации и, соответственно, высокие энергетические затраты, обусловленные присутствием особо концентрированной серной кислоты в процессе.
В процессе получения МЭК в Германии и Японии, происходит процесс прямой гидратации, при котором применяют сульфокатионы и гетерополикислоты в качестве катализаторов, которые не имеют недостатков. В лаборатории метилэтилкетон получают при помощи дегидрирования два-бутанола. Для того чтобы идентифицировать МЭК, производят такой продукт, как семикарбазон, который является производной метилэтилкетона.
Мы уверены, что после прочтения этой статьи Вы обязательно захотите метилэтилкетон и можете сделать это у нас прямо сейчас!
Метилэтилкетон 99,9%
 | Растворители Европейского пр-ва | |
|---|---|---|
| Вещество: | метилэтилкетон | |
| Синонимы: | бутанон-2 бутан-2-он торговая марка MEK | |
Каталожный номер на метилэтилкетон CAS: 78-93-3
Фасовка: бочки 165 кг. (200 л).
Описание метилэтилкетона
Химическое соединение класса кетонов, бесцветная легколетучая жидкость с запахом, напоминающим запах ацетона, но более слабым по силе.
Спецификация
| Содержание основного вещества метилэтилкетона, не менее: | 99,5% |
| Кислотность метилэтилкетона в пересчете на уксусную кислоту, не более: | 0,002% |
| Содержание воды, в метилэтилкетоне, не более: | 0,05% |
| Сухой остаток г/100 мл, не более: | 0,002 |
Применение
Метилэтилкетон используют как растворитель для нитроцеллюлозных, полиакриловых, перхлорвиниловых лкм, в производстве линолеума, а также клеев, депарафинизации масел для смазки, краски для типографии, чернил, а также в качестве обемасливающего состава для парафинов (для того, чтобы удалить низкоплавкий парафин в смеси с маслами).
Основные физические свойства метилэтилкетона
| Температура кипения: | 80°C |
| Температура плавления: | -86°C |
| Относительная плотность (вода = 1): | 0.8 |
| Растворимость в воде, г/100 мл при 20°C: | 29 |
| Давление паров, кПа при 20°C: | 10.5 |
| Относительная плотность пара (воздух = 1): | 2.41 |
| Относительная плотность смеси пар/воздух при 20°C (воздух = 1): | 1.1 |
| Температура вспышки: | -9°C (c.c.) |
| Температура самовоспламенения: | 505°C |
| Пределы взрываемости, объем% в воздухе: | 1.8-11.5 |
| Koэффициент распределения октанол/вода как lg Pow: | 0.29 |
| Молярная масса метилэтилкетона: | 72,12 г/моль |
Информация о токсичности
| Влияние высоких концентраций: | Вещество раздражает глаза и дыхательные пути. Может оказывать действие на центральную нервную систему. Воздействие на уровне, значительно превышающем ПДК может вызвать потерю сознания. |
| Опасность при постоянном контакте: | Жидкость обезжиривает кожу. Исследования на животных показывают, что вещество, возможно, оказывает токсическое действие на репродуктивную функцию человека. При концентрации: 1 мг/л в течение 3-5 минут воздействия на человека вызывает раздражение слизистых оболочек глаз, носа и горла. При концентрации: 30 мг/л раздражение становится невыносимым. |
| ПДК рабочей зоны по ГОСТ 12.1.005-88: | 200 мг/м3 |
Пожарная опасность
Относят к легко воспламеняющимся веществам.
Взрывоопасен в смеси с воздухом при концентрации 1,97-10,2 %.
Пар тяжелее воздуха и может стелиться по земле; возможно возгорание на расстоянии.
Реагирует бурно с сильными окислителями и неорганическими кислотами с опасностью пожара и взрыва. Агрессивно в отношении некоторых пластиков.
ЭКВИВАЛЕНТ ХИМИЧЕСКИЙ
где где V п =>22,414 л/моль, то
Т. обр., V ЭК(B) в конкретной хим. р-ции, протекающей в нормальных условиях, всегда в z(В) раз меньше объема 1 моля идеального газа.
Закон Э. х. гласит: элементы всегда соединяются между собой в определенных массовых кол-вах, соответствующих их Э. х., или: в р-циях всегда участвуют равные кол-ва в-ва Э. х. Поэтому для р-ции, в к-рой взаимод. в-ва А и В, будут справедливы равенства:
Раньше под Э. х. понимали кол-во в-ва, к-рое присоединяет или замещает 1 моль атомов водорода в ходе хим. р-ции. Однако это понятие относится не к самому Э. х., а к кол-ву в-ва Э. х. взятого в-ва В, как это видно из приведенных выше др. физ. величин, связанных с понятием Э. х. Ранее использовали также понятие «грамм-эквивалент», равный Э. х., выраженному в граммах.
Лит.: Степин Б. Д., Применение Международной системы единиц физических величин в химии, М., 1990; Степин Б. Д., Цветков А. А., Неорганическая химия, М., 1994.
Полезное
Смотреть что такое «ЭКВИВАЛЕНТ ХИМИЧЕСКИЙ» в других словарях:
Эквивалент химический — Эквивалент вещества его масса (выраженная в углеродных единицах), которая присоединяет или замещает атомную массу водорода (1,008 г) или половину атомной массы кислорода (15,9994/2 г.) Эквивалент кислоты равен ее молярной массе, деленной на… … Википедия
Эквивалент химический — элемента, его масса (выраженная в углеродных единицах (См. Углеродная единица)), которая присоединяет или замещает одну атомную массу водорода или половину атомной массы кислорода. Э. х. кислоты равен её молярной массе, деленной… … Большая советская энциклопедия
Эквивалент электрохимический — количество вещества, подвергающееся химическому превращению на электродах в результате прохождения через электролит 1 кулона электричества. Выражается обычно в г/к. Э. э. связан с эквивалентом химическим (См. Эквивалент химический) А и… … Большая советская энциклопедия
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ — численно равен массе вещества (в атомных единицах массы), реагирующей с 1 ионом Н+ или ОН? в реакциях нейтрализации, с 1 электроном в окислительно восстановительных реакциях, с 1/n частью металла с валентностью n в комплексонометрии и т. д. Напр … Большой Энциклопедический словарь
ЭКВИВАЛЕНТ — (ново лат., от aeque равно, и valere стоить). 1) в химии: число, обозначающее количество какого нибудь вещества, которое может заменить собою другое вещество в известном химическом соединении, причем характер и свойства последнего останутся те же … Словарь иностранных слов русского языка
ХИМИЧЕСКИЙ — (от слова химия). К химии относящийся, ей принадлежащий. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ХИМИЧЕСКИЙ имеющий отношение к химии к исследованию свойств простых тел; производящий изменения в веществе… … Словарь иностранных слов русского языка
химический эквивалент — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN chemical equivalent … Справочник технического переводчика
химический эквивалент — – реальная или условная частица вещества x, которая эквивалентна одному иону водорода в данной кислотно основной реакции или одному электрону в данной окислительно восстановительной реакции. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ЭКВИВАЛЕНТ — (1) химический масса хим. элемента, которая присоединяет или замещает массу водорода, равную его атомной массе (1,0079) (или массу кислорода, равную половине его атомной массы). Так, хим. Э. хлора в НСl равен атомной массе хлора (35,45).… … Большая политехническая энциклопедия
химический эквивалент элемента — [chemical equivalent of element] его масса (выраженная в углеродных единицах), которая присоединяет или замещает одну атомную масса водорода или половину атомной массы кислорода. В реакциях окисления восстановления химический эквивалент… … Энциклопедический словарь по металлургии
главная > справочник > химическая энциклопедия:
Эквивалент химический
В обменных реакциях значения z(B) определяются стехиометрией реакции. Напр., для реакции Al2(SO4)3+12KOH 
где Nфе — число формульных единиц вещества В. Следовательно:
Значение МЭК(В) можно найти, исходя из молярной массы вещества В (Мв, г/моль):
Т. обр., VЭК(B) в конкретной химической реакции, протекающей в нормальных условиях, всегда в z(В) раз меньше объема 1 моля идеального газа.
Закон химических эквивалентов гласит: элементы всегда соединяются между собой в определенных массовых количествах, соответствующих их химическим эквивалентам, или: в реакциях всегда участвуют равные количества вещества химических эквивалентов. Поэтому для реакции, в которой взаимодействуют вещества А и В, будут справедливы равенства:
Раньше под химическим эквивалентом понимали количество вещества, которое присоединяет или замещает 1 моль атомов водорода в ходе хим. реакции. Однако это понятие относится не к самому химическому эквиваленту, а к количеству вещества химического эквивалента взятого вещества В, как это видно из приведенных выше других физических величин, связанных с понятием химический эквивалент Ранее использовали также понятие «грамм-эквивалент», равный химическому эквиваленту, выраженному в граммах.
Лит.: Степин Б. Д., Применение Международной системы единиц физических величин в химии, М., 1990; Степин Б.Д., Цветков А.А., Неорганическая химия, М., 1994.