Мукацитоз у взрослого что это
Что такое муковисцидоз (кистозный фиброз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кольцова Е. В., пульмонолога со стажем в 6 лет.
Определение болезни. Причины заболевания
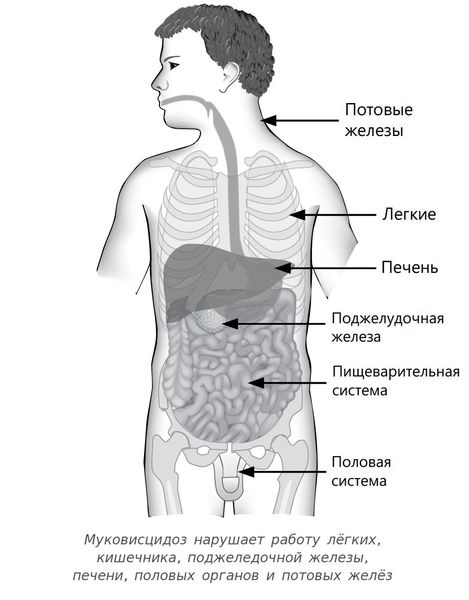
Муковисцидоз — это наследственное заболевание, при котором нарушаются функции желёз внешней секреции. Болезнь поражает весь организм, но сильнее всего страдает дыхательная система и поджелудочная железа.
Заболевание также называется кистозным фиброзом, синдромом Фанкони. Характеризуется системным поражением экзокринных желез: слизеообразующих (респираторных, кишечника, поджелудочной) и серозных (слюнных, потовых, слезных).
В некоторых случаях симптомы болезни проявляются не сразу. Это связано с тем, что тяжесть и форма заболевания у разных больных отличаются. Кроме того, признаки муковисцидоза могут напоминать симптомы других болезней, что затрудняет диагностику. Без лечения подавляющее большинство больных умирает в детском возрасте, но благодаря современным лекарственным препаратам и другим методам лечения продолжительность жизни пациентов постоянно растёт.
Чаще всего без адекватного лечения болезнь протекает тяжело и имеет плохой прогноз, на который во многом влияет развитие хронической инфекции в нижних дыхательных путях. Бактериальные агенты при муковисцидозе специфичны, например, для раннего возраста характерно развитие инфекции, вызванной золотистым стафилококком, в дальнейшем к нему присоединяются синегнойная и гемофильная палочки. Данные возбудители устойчивы к лекарственным препаратам, что осложняет лечение, поэтому важно своевременно идентифицировать возбудителя и подобрать подходящие антибактериальные средства.
Симптомы муковисцидоза
При муковисцидозе симптомы болезни зачастую видны сразу после рождения ребёнка и проявляются признаками непроходимости кишечника (мекониальным илеусом):
В возрасте одного года у ребёнка с муковисцидозом может наблюдаться обильный, зловонный стул непереваренной пищей, частый сухой кашель, отставание в физическом развитии и длительная желтуха.
Иногда признаки заболевания проявляются только в школьном возрасте. Дети с муковисцидозом из-за нехватки питательных веществ страдают дефицитом массы тела и отстают в росте.
Для заболевания также характерны:
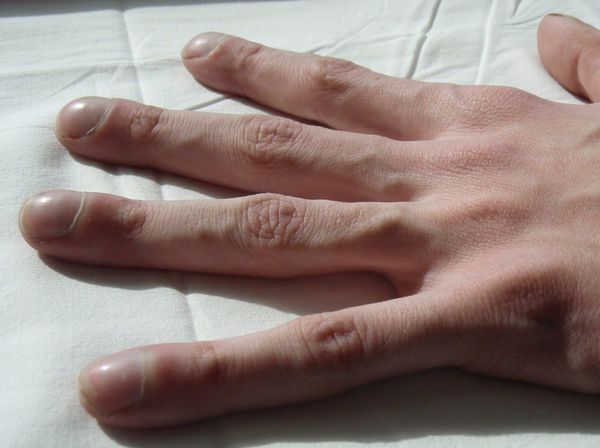
У заболевших в раннем детстве и доживших до взрослого возраста отмечаются постоянный сухой кашель, вне обострения чаще наблюдается постоянное отделение мокроты от 5-10 мл до 200 мл и более. Характер мокроты — от слизистой до гнойной. О дышка, которая в начале болезни может возникать только при небольшой нагрузке, но со временем усиливается, частые респираторные заболевания и гаймориты. У пациентов выражена задержка роста, фаланги пальцев и ногти изменяются по типу «барабанных палочек» и «часовых стёкол».
Грудная клетка чаще бочкообразной формы. Появляется бледность, одутловатость лица и цианоз видимых слизистых.
У больных может наблюдаться задержка в половом развитии или отсутствие вторичных половых признаков:
Патогенез муковисцидоза
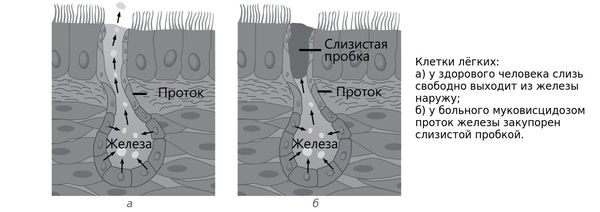
Патогенез муковисцидоза обусловлен мутацией гена CFTR (Cystic Fibrosis Transmembrane conductance Regulator) — муковисцидозного трансмембранного регулятора проводимости. Этот ген кодирует белок, который обеспечивает транспорт солей и воды в эпителиальном слое бронхолёгочной системы и в клетках, выстилающих железы, вырабатывающие секрет и выводящие его во внешнюю среду организма. Из-за дефекта структуры белка нарушается перемещение ионов натрия и хлора в клетках, что в итоге приводит к повышенной вязкости секрета экзокринных желез. Происходит увеличение всасывания ионов натрия и дефект секреции хлора, что ведёт к снижению или прекращению выделения жидкости в просвет бронхов. Из-за этого мокрота теряет свою жидкую часть, становится вязкой и густой. Впоследствии это ведёт к тому, что бронхи забиваются вязким секретом.
Таким образом, при муковисцидозе нарушаются функции желёз, которые вырабатывают пот, слизь, слёзы, слюну и пищеварительные соки. Через протоки этих желёз выделения выходят на поверхность тела или в полые органы, такие как кишечник или дыхательные пути. У пациентов с муковисцидозом в этих органах возникают серьёзные изменения, особенно они затрагивают бронхолёгочную систему — в язкий секрет закупоривает мелкие дыхательные пути.
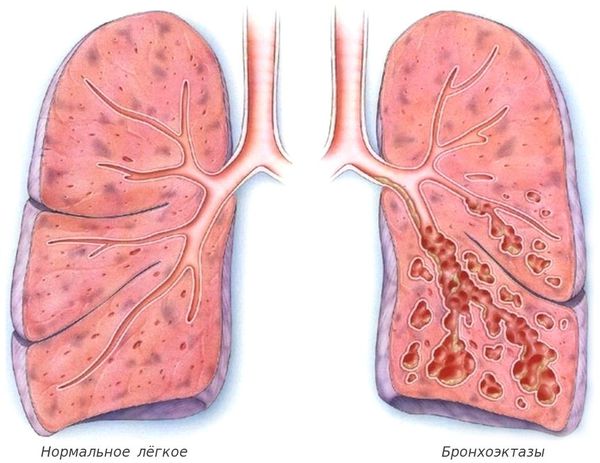
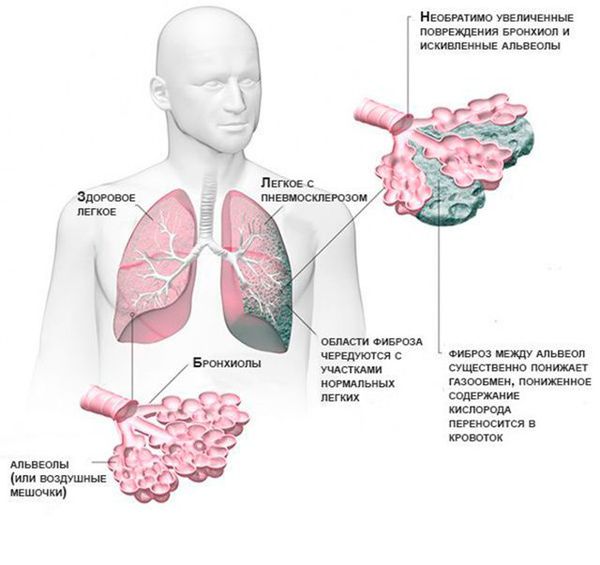
С лизь, выделяемая в дыхательных путях, необходима для удаления из них пыли и бактерий, но при муковисцидозе выработка и структура бронхиального секрета нарушаются. В результате на стенках дыхательных путей развивается хроническое воспаление, которое впоследствии приводит к формированию бронхоэктазов (расширения и деструкции бронхов) и рубцов в лёгочной ткани.
При муковисцидозе страдает не только дренажная функция дыхательных путей, но и клеточный и гуморальный иммунитет. Это происходит из-за нарушений в работе клеток и затруднённого движения ресничек мерцательного эпителия бронхов.
Помимо этого, при муковисцидозе ферменты, вырабатываемые поджелудочной железой, не поступают в кишечник. Они начинают разрушать ткань поджелудочной железы, в результате чего в ней формируются рубцы и кисты. Также необратимо нарушается весь процесс пищеварения. Это приводит к недостаточности массы тела, отставанию в росте и весе, хронической диарее и выпадению прямой кишки.
При муковисцидозе у мужчин отмечается обструкция (непроходимость) семявыносящих протоков, отсюда и высокий процент мужского бесплодия при заболевании.
Классификация и стадии развития муковисцидоза
В зависимости от преобладающих симптомов выделяют три основные клинические формы заболевания: кишечную, бронхолёгочную и смешанную.
Кишечная форма муковисцидоза. Кистозный фиброз с кишечными проявлениями Е84.1 (код по МКБ-10)
Из-за неправильной секреции ферментов нарушается работа органов желудочно-кишечного тракта. Ухудшается расщепление жиров, белков и углеводов, а также их усвоение. Не вся пища переваривается, стул становится обильным, частым и зловонным.
Бронхолёгочная форма муковисцидоза. Кистозный фиброз с лёгочными проявлениями Е84.0
Нарушения затрагивают всю бронхолёгочную систему. Вязкая мокрота скапливается в дыхательных путях и её тяжело откашлять. При инфицировании золотистым стафилококком, синегнойной и гемофильной палочками возникают тяжёлые бронхиты и пневмонии, для которых характерно осложнённое течение с развитием одышки, интоксикации и выраженной слабостью. Со временем развиваются следующие необратимые изменения:
Смешанная форма (лёгочно-кишечная)
Различают четыре стадии развития муковисцидоза:
1. Непостоянство симптомов, пациент жалуется на частый сухой кашель и небольшую одышку при физических нагрузках. Стадия может длиться до 10 лет.
2. Кашель с отделением мокроты, одышка появляется в покое и усиливается при физической нагрузке, фаланги пальцев и ногтевые пластины деформируются по типу «барабанных палочек» и «часовых стёкол». Стадия продолжается от 2 до 15 лет.
3. Бронхолёгочные симптомы прогрессируют, развиваются тяжёлые осложнения. У пациентов усиливается одышка и появляются признаки сердечной недостаточности: отёки на ногах, одышка при небольшой активности или в покое, быстрая утомляемость, непереносимость физических нагрузок. На УЗИ сердца видны признаки гипертрофии левых и правых отделов, а также снижение сердечной фракции выброса левого желудочка. На рентгенологических снимках можно обнаружить зоны пневмофиброза, бронхоэктазы и кисты. Формируется сердечная недостаточность по правожелудочковому типу, так называемое «лёгочное сердце». Длительность стадии от 3 до 5 лет.
4. Тяжёлая кардио-респираторная недостаточность. Из-за дисфункции левого желудочка нарушается работа сердца и лёгких, снижается фракция выброса левого желудочка, учащается сердцебиение, прогрессирует гипотензия. Стадия длится несколько месяцев и завершается смертью больного, вызванной развитием дыхательной недостаточности и остановкой сердечной деятельности.
Различают стадии обострения и ремиссии:
Осложнения муковисцидоза
Для муковисцидоза характерны следующие бронхолёгочные осложнения:
Пациенты жалуются на выраженную одышку, отмечаются симптомы сильной интоксикации, повышается температура и выделяется большое количество зловонной гнойной мокроты.
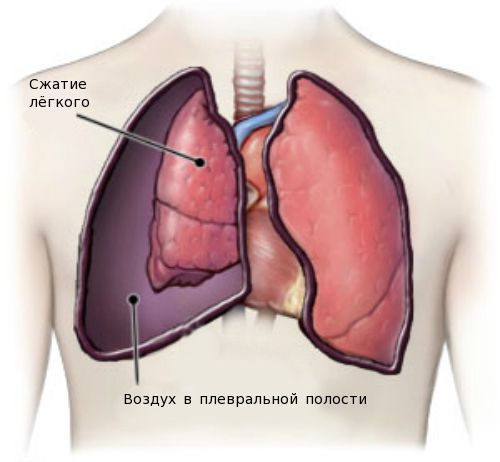
Одним из тяжёлых осложнений является спонтанный пневмоторакс — скопление воздуха в плевральной полости. Нарушение проявляется резкой колющей болью в грудной клетке, усиливающейся при дыхании, кашле и движениях. Больной начинает дышать часто и поверхностно, отмечается сильная одышка и чувство нехватки воздуха, беспокоит кашель, появляется синюшность кожных покровов лица.
У больных старше 12 лет высока вероятность развития сахарного диабета I типа, может наблюдаться остеопороз, артриты и отёки нижних конечностей.
Постоянные или частые боли в животе могут указывать на панкреатит, эзофагит или язвенную болезнь желудка и двенадцатиперстной кишки.
Диагностика муковисцидоза
Основной критерий постановки диагноза — увеличение концентрации ионов хлора в потовых железах более 60 ммоль/л вместе с одним или более из следующих критериев:
Характерные клинические проявления болезни:
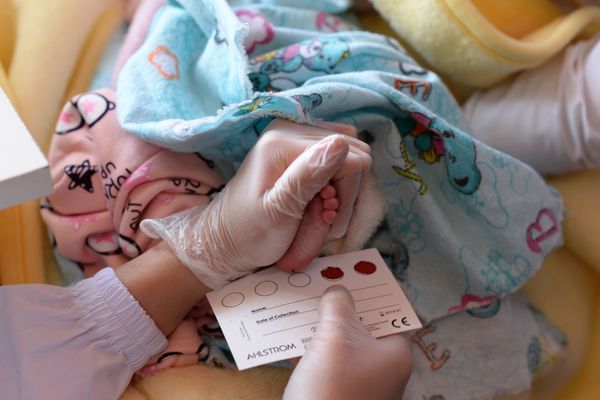
Скрининг на муковисцидоз проводится в роддоме всем новорождённым и направлен на выявление заболевания ещё до клинических проявлений. Для этого у ребёнка на 4-7 день жизни берётся кровь из пятки на фильтровальную бумагу и определяют уровень иммунореактивного трипсина (ИРТ). Если показатели ИРТ превышены (норма не более 65-70 нг/мл), то на 21-28 день анализ повторяют. Если показатели остаются повышенными, ребёнку проводится потовая проба и генетическое обследование.
Потовая проба — это один из методов диагностики муковисцидоза, с помощью которого определяется уровень хлоридов в секрете потовых желез. Анализ проводится троекратно. Положительным результатом для постановки диагноза считается показатель выше 60 ммоль/л.
Методика проведения потовой пробы: кожу правого бедра новорождённого протирают раствором натрия хлорида, дают высохнуть, после кладут салфетку, смоченную раствором пилокарпина для провоцирования гипергидроза и вторую салфетку, смоченную солёной водой. На салфетках закрепляются электроды, в течение 5 минут подаётся разряд 4 мА, после чего электроды снимаются, и кожа протирается. На простимулированном участке фиксируется кусочек фильтровальной бумаги. Выделяющийся пот собирается в течение 30 минут, после чего бумагу снимают и отсылают в лабораторию для определения концентрации электролитов хлора и натрия.
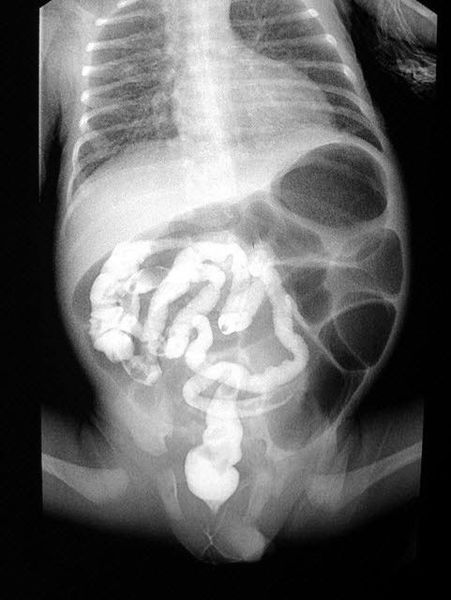
Обзорную рентгенограмму брюшной полости проводят для выявления вздутых петель кишечника и признаков кишечной непроходимости. При осмотре может быть обнаружено увеличение печени (гепатомегалия). Также у пациентов выявляют сахарный диабет I типа, который сочетается с респираторными симптомами: одышкой, частым кашлем с трудноотделяемой вязкой мокротой и панкреатитом, проявляющимся опоясывающими болями в области живота и частым стулом непереваренной пищей.
Молекулярно-генетический анализ позволяет диагностировать муковисцидоз приблизительно в 90 % случаев. Для его проведения нужна кровь из вены. Генетический метод обнаруживает в хромосомах пациента «дефектный» ген с мутацией F508del. При тестировании на муковисцидоз невозможно проверить все мутации, так как их более 1900, а большинство лабораторий выявляет только 20-30 самых частых вариантов.
Лечение муковисцидоза
Муковисцидоз носит наследственный характер, поэтому его лечение большей частью симптоматическое, оно направлено на восстановление функций дыхательного и желудочно-кишечного тракта и проводится на протяжении всей жизни пациента. Больным муковисцидозом важно соблюдать диету, выполнять специальный комплекс упражнений и принимать препараты, предотвращающие развитие инфекций.
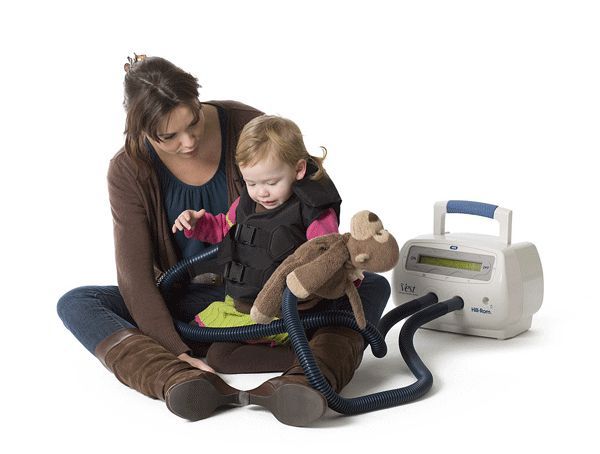
Основной целью лечения при муковисцидозе является удаление из дыхательных путей вязкой мокроты. Для этого применяют различные методики дренирования бронхиального дерева, например кинезотерапию — одну из форм лечебной физкультуры, способствующую очищению бронхов от вязкой и агрессивной слизи.
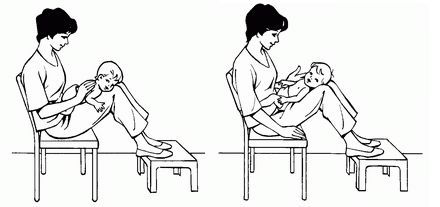
Физиотерапевтическое лечение младенцев и детей раннего возраста включает как активную, так и пассивную техники.
Пассивная техника:
• принятие телом ребёнка определённого положения на короткое время, затем его изменение;
• сопровождение и стимуляция дыхательных движений при помощи рук (контакт-дыхание) — техника, при которой рука физиотерапевта ведёт и стимулирует дыхательные движения;
• ручная вибрация на выдохе — для поддержки выдоха и помощи высвобождению мокроты потряхивается грудную клетку рукой;
• потряхивание — ритмические движения, выполняемые в одной из частей тела для возникновения реакции в грудной клетке;
• терапевтические положения тела — расположение грудной клетки в состоянии, при котором растягивается лёгочная ткань и расширяются дыхательные пути.
Активная техника:
• влияние на дыхание, например с помощью акустической стимуляции — поощряя ребёнка повторять громкие крики, которые он издаёт;
• упражнения для развития эластичности грудной клетки, позвоночника и мышечного баланса тела;
• упражнения, повышающие ловкость, выносливость и формирующие наслаждение от мышечной активности.
При муковисцидозе важно соблюдать диету — питание должно быть высококалорийным, с повышенным содержанием белков и жиров. Пищу принимают часто и небольшими порциями, дополнительно подсаливая. Из рациона исключается еда, которая тяжела для переваривания: грубая клетчатка, навары из супов, жареные блюда, шоколад, торты, пирожные. Суточный калораж должен превышать возрастную норму на 20—40 %, главным образом за счёт увеличенного количества белка (до 6 г на 1 кг массы тела в сутки). Из-за нарушенной функции поджелудочной железы у больных не усваиваются жиры и жирорастворимые витамины А, Д, Е и К, поэтому необходим их дополнительный приём.
Для облегчения отхождения мокроты применяют следующие препараты:
Для ингаляционной терапии используют бронхолитики:
Следует иметь в виду, что у трети больных бронхолитики оказывают положительный ответ, но у большей части может возникнуть коллапс мышц дыхательных путей и резкое снижение объёма выдыхаемого воздуха. В связи с этим больные, получающие такую терапию, должны находиться под наблюдением врача.
Антибактериальные препараты назначаются всем пациентам с лёгочными симптомами, при обострениях заболевания или выявлении возбудителей респираторных инфекций для подавления их роста.
Для лечения применяют эффективные комбинации антисинегнойных антибиотиков:
Парентеральные антибиотики:
Доза вводимого антибактериального препарата должна превышать среднюю терапевтическую в полтора раза. Курс антибактериальной терапии может продолжаться до 3-4 недель,в случае хронизации инфекционного процесса — до 12 недель.
Для улучшения функции пищеварения используют ферментные препараты, которые содержат липазу, протеазу и амилазу, облегчающие переваривание жиров, углеводов и белков, а также способствующие их лучшему всасыванию в тонком кишечнике. Подбор доз панкреатических ферментов проводится индивидуально исходя из клинических проявлений болезни. Применяются препараты: «Панкреатин», «Мезим», «Креон». Ферментные препараты назначаются в больших дозах, чем больным с другими заболеваниями желудочно-кишечного тракта — до 30 капсул «Креона» в сутки.
Лечение муковисцидоза пожизненное. Выбор схемы терапии зависит от вида бактерий, обнаруженных в бронхиальном секрете дыхательных путей, а также от преобладающих клинических форм заболевания.
В России оригинальные препараты для лечения муковисцидоза заменяются дженерикам отечественного производства. Дженерики сходны с оригинальными препаратами по составу действующего вещества. Многие пациенты жалуются на их плохое качество и появление побочных эффектов. В последнее время пациентами и родителями больных муковисцидозом проводятся кампании, цель которых — вернуть государственное обеспечение качественными иностранными лекарствами.
Назвать побочные эффекты дженериков на данный момент сложно, так как отсутствуют их сравнительные исследования с оригинальными препаратами.
В рамках 44-ого ФЗ закупки лекарственных препаратов идут по международному непатентованному названию. Перечень лекарственных препаратов утверждается правительством РФ. Врачам за назначение препаратов под торговыми названиями или купленными родителями и благотворительными фондами грозит ответственность. В рецептах, выписанных врачом, должны быть указаны только международные названия, а не торговые. За нарушение этого правила врачей ждет штраф.
Хотя есть одно условие: при наличии медицинских показаний (аллергия, индивидуальная непереносимость дженерика по жизненным показаниям) по решению врачебной комиссии пациент может получить лекарство под торговым названием. Поэтому возможность получить оригинальный препарат — индивидуальная непереносимость дженерика (которую нужно доказать) и решение врачебной комиссии.
Муковисцидоз — наиболее частое показание для трансплантации лёгких. Основные показания для этой операции: прогрессирующее снижение веса, ухудшение лёгочной функции, частые обострения, потребность в кислородотерапии. Противопоказания: аспергиллома ( опухолевоподобное неинвазивное новообразование шаровидной формы, состоящее в основном из клеток мицелия микроскопического плесневого гриба ), курение, психосоциальные факторы. Сахарный диабет и лечение кортикостероидами не являются препятствием для трансплантации.
Прогноз. Профилактика
Муковисцидоз — это неизлечимое хроническое заболевание, но при своевременной диагностике и адекватной постоянной терапии многие пациенты доживают до взрослого возраста.
Для больных муковисцидозом возможна полноценная жизнь, но только при условии постоянного получения необходимых препаратов. Основными причинами смертности этих пациентов являются бронхолёгочные осложнения: развитие инфекции в нижних дыхательных путях, бронхоэктазы и хроническая обструктивная болезнь легких (ХОБЛ).
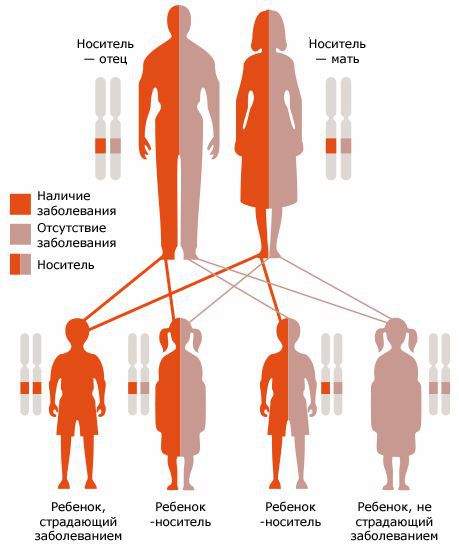
Главным способом профилактики является дородовая и неонатальная диагностика. Семейным парам, планирующим рождение ребенка, рекомендуется пройти ДНК-диагностику на носительство мутаций, приводящих к муковисцидозу, с последующей консультацией врача-генетика.
Пренатальная ДНК-диагностика выполняется при заборе околоплодных вод в ранний (13-14 недель) и поздний (16-20 недель беременности) сроки. Обследование проводят для семей, в которых выявлено носительство мутации гена CFTR и имеющих ребёнка больного муковисцидозом.
Муковисцидоз с точки зрения врача общей практики
У врачей МВ традиционно ассоциируется прежде всего с патологией легких, однако он представляет собой системное заболевание с поражением желудочно-кишечного тракта и других жизненно важных органов В медицинской практике МВ традиционно
 |
| У врачей МВ традиционно ассоциируется прежде всего с патологией легких, однако он представляет собой системное заболевание с поражением желудочно-кишечного тракта и других жизненно важных органов |
Муковисцидоз (МВ) — генетическое аутосомно-рецессивное (а/р) моногенное заболевание, обусловленное мутацией гена трансмембранного регулятора МВ (МВТР). Характеризуется нарушением секреции экзокринных желез жизненно важных органов с поражением прежде всего дыхательного и желудочно-кишечного тракта, тяжелым течением и неблагоприятным прогнозом [1, 2, 3]. Впервые выделено из группы целиакий в 1936 г. венским педиатром Гвидо Фанкони [9].
Первоначальная мутация возникла, вероятнее всего, где-то на границе современных Голландии и Германии. Ген обнаруживается, по европейским данным, с частотой 1 случай на 1500 человек, уступая по распространенности только синдрому трисомии [12]. Постепенно распространяется на восток, где заболеваемость явно нарастает одновременно как результат улучшения диагностических мер и как истинный показатель. Вероятность рождения больного ребенка, по европейским данным, составляет 1:2000 — 1:2500 живорожденных [13]. Число диагностированных больных в развитых странах равно 7-8 на 100 тыс. населения, из них количество больных старше 18 лет составляет 20%, а в США даже 32% [8]. В России большая часть этих больных не выявляется или выявляется поздно, нередко в запущенной стадии болезни, и поэтому распространенность МВ по нашей статистике не превышает 1:100 000, по расчетам же медико-генетического центра РАМН она должна быть 1:12 000 новорожденных [4].
После первых описаний МВ считался фатальным заболеванием, так как большинство детей не переживало пятилетний рубеж. До 80-х годов 80% больных не достигало возраста 20 лет [13]. Но и в современных условиях существует большой разброс ожидаемой продолжительности жизни больных, что обусловлено уровнем развития общества, осознанием актуальности проблемы, степенью организации специализированных центров. В Великобритании, США, Австралии новорожденным с МВ гарантируется 40 лет жизни, в других развитых странах — в среднем 31, в Латинской Америке — 10 лет (95% больных МВ здесь не выявляется), в России, по результатам работы центра МВ на базе республиканской детской больницы (Москва), — 16 лет. Лечение МВ требует больших финансовых вложений. Так, в США они составляют 15 тыс. долл. в год, в Великобритании — 11 тыс. ф. ст., в Российском центре МВ — 10 500 долл. в год [2].
Таким образом, МВ является важной медико-социальной проблемой, что обусловлено не только большими моральными, физическими и материальными затратами семьи, органов практического здравоохранения и общества в целом на диагностику, лечение и социальную адаптацию больных, но и достижениями научно-практической медицины, позволившими увеличить продолжительность жизни больных.
Ген МВ локализован на 7-й хромосоме (7q31). Передается а/р с различной степенью экспрессивности признаков. В одном гене может быть множество мутаций, каждая из которых характерна для определенной популяции или региона. Основная мутация дельта-F508, т. е. замена аминокислоты фенилаланина в 508-й позиции, встречается в России в 56% случаев, а в Москве — в 41%. Частота других мутаций — W1282X, N1303K и т. д. — 3-5% [4, 5, 11]. Тяжелое течение МВ свойственно гомозиготам по дельта-F508, а также при мутациях W1282X, G542X, N1303K как в гомозиготном состоянии, так и в сочетании с дельта-F508. Относительно легкое течение МВ наблюдается у детей с мутациями R334W, S1196X (даже в сочетании с дельта-F508). Но предсказать течение и прогноз болезни даже при одной и той же мутации сложно. Иногда при ранней диагностике МВ и адекватном лечении быстро развиваются необратимые изменения жизненно важных органов. В то же время у некоторых пациентов даже при поздней диагностике и соответственно позднем лечении наблюдалось благоприятное течение МВ, позволявшее им достичь взрослого, а иногда и зрелого возраста. Такой клинический полиморфизм можно объяснить генетическими особенностями самого ребенка, а также характером жизни, иммунными реакциями и т. д.
Патогенез МВ связан с дефектом синтеза белка, выполняющего роль хлоридного канала, участвующего в водно-электролитном обмене эпителиальных клеток дыхательных путей, желудочно-кишечного тракта, поджелудочной железы, печени, репродуктивной системы. В 70% мутаций в европейской популяции наблюдается потеря аминокислоты фенилаланина в белке. В связи с неспособностью дефектного белка адекватно выполнять работу хлоридного канала внутри клетки накапливаются ионы Cl–. Изменяется электрический потенциал в просвете выводных протоков, и внутрь клетки устремляется ион натрия. Последний в свою очередь выполняет роль насоса, что обусловливает усиленное всасывание воды из околоклеточного пространства [7]. В итоге сгущается секрет большинства желез внешней секреции, затрудняется его эвакуация, в органах возникают вторичные изменения, наиболее серьезные — в бронхолегочной системе. В стенках бронхиального дерева развивается хроническое воспаление различной выраженности, разрушается соединительнотканный каркас, формируются бронхиоло- и бронхоэктазы. В условиях постоянной обструкции вязкой мокротой и прогрессирующей деструкции легочной паренхимы бронхоэктазы становятся распространенными, нарастает гипоксия, развивается легочная гипертензия и так называемое «легочное сердце». Патогенез МВ включает в себя и другие механизмы. В частности, наблюдается уменьшение продукции IgА, снижение противовирусного иммунитета, образование интерферона, фагоцитарная активность лейкоцитов, особенно их микробицидное действие [1]. Альвеолярный макрофаг — основной фагоцит легких [7] — главный источник интерлейкина 8 (ИЛ8), ведущего хемоатрактанта для нейтрофилов. У больных МВ повышается концентрация ИЛ8 в мокроте и бронхоальвеолярной жидкости, положительно коррелирующая с тяжестью бронхолегочного процесса [10, 15]. Одновременно в большом количестве при МВ обнаруживают другие хемоатрактанты (С5а, лейкотриен В4), цитокины (ИЛ1, ИЛ6, альфа-фактор некроза опухоли), эластаза, играющие важную роль в формировании хронического воспаления [15]. Множество нейтрофилов, привлеченных в дыхательные пути, увеличивает количество гнойной мокроты. Разрушающиеся нейтрофилы освобождают ДНК, также увеличивающую вязкость мокроты. Эндо- и панбронхиту предшествует вирусное поражение носоглотки, гортани и бронхов, приводящее к гибели клеток мерцательного эпителия и открывающее путь для микробной флоры (тем более на фоне дефицита JgА). Как повреждающие агенты заявляют о себе бактерии, особенно синегнойная палочка, и эндогенные протеазы, прежде всего эластаза. Защитными факторами против последней являются альфа-один-антитрипсин и секреторный ингибитор лейкопротеаз, но у больных МВ они подавляются огромным количеством нейтрофильной протеазы. Это позволяет протеазам непосредственно разрушать эпителий и каркас бронхиального дерева, еще более изменяя мукоцилиарный клиренс. На ранних стадиях МВ в микробном пейзаже бронхов преобладает стафилококк, позднее — синегнойная палочка, что объясняется способностью патологического белка МВ изменять условия формирования и количественный состав «сахаров» на поверхности эпителиальной клетки дыхательных путей. Это облегчает адгезию микробов, особенно синегнойной палочки [11, 15, 16].
Бронхолегочные изменения преобладают в клинической картине и определяют прогноз у 95% пациентов [13, 16]. У врачей МВ традиционно ассоциируется прежде всего с патологией легких, однако он представляет собой системное заболевание с поражением желудочно-кишечного тракта, вторично — сердца, других жизненно важных органов. И хотя прогноз остается неблагоприятным и не все больные переживают 25-летний возрастной рубеж, МВ можно рассматривать как многодисциплинарную клиническую проблему, прежде всего на стыке педиатрии и терапии.
Пациенты с муковисцидозом и члены их семей должны наблюдаться в специализированных центрах. Но в нашей стране таких центров немного, а с учетом расстояний и отсутствия необходимых средств на дорожные расходы они и вовсе становятся малодоступными для пациентов. Поэтому принципы ведения больных с МВ должны быть знакомы врачам широкой лечебной сети.
Выраженный полиморфизм МВ определяет разные варианты его течения. В 8-20% гомозиготных случаев МВ манифестирует с рождения мекониальным илеусом с возможным исходом в мекониальный перитонит. В менее трагичных ситуациях стул обильный, с сильным отвратительным запахом, «жирный». У 1/3 больных наблюдается выпадение прямой кишки, но при назначении адекватной дозы современных пищеварительных ферментов это осложнение спонтанно проходит через 1,5-2 мес. Следует напомнить, что мекониальный илеус, как правило, указывает на наличие МВ у новорожденного (дифференциальная диагностика — ДД — проводится прежде всего [14] с синдромом семейной хлоридной диареи). У больных школьного возраста первыми симптомами могут быть «кишечные колики». При обследовании таких детей в брюшной полости пальпируются «плотные образования» (каловые массы, смешанные с густой плотной слизью), которые вызывают вздутие живота, повторные рвоты, запоры. Дистальная кишечная обструкция или эквивалент мекониального илеуса в его острой, подострой или хронической форме могут наблюдаться у подростков, юношей и даже взрослых [11, 14, 15], вызывая необходимость в проведении ДД с синдромами висцерального обкрадывания, верхней брыжеечной артерии, полипозов, врожденной и приобретенной интестинальной псевдообструкции.
После назначения ферментов кишечная симптоматика отодвигается на второй план, уступая место легочной. Острый дебют бронхолегочной патологии наблюдается нечасто. Обычно постепенно развивается хронический (в 1/3 случаев — обструктивный) бронхит. При рождении дыхательные пути интактны, но уже в периоде новорожденности и грудном возрасте возникает кашель, приступы удушья, одышка, иногда рвота, рецидивирующие бронхопневмонии. Затем формируются эмфизема, нередко — ателектазы, быстро появляются бронхоэктазы. Периодически возникает мучительный сильный кашель, особенно по ночам. Мокрота вязкая, иногда гнойная. Может быть симптоматика бронхиальной астмы. Вначале аускультативная картина вне обострений остается неизменной, но при тщательном обследовании обнаруживается небольшая одышка, увеличение объема грудной клетки в основном за счет переднезаднего размера, незначительное, но постоянное снижение экскурсии грудной клетки. Как следствие перегрузки малого круга развивается «легочное сердце». Хроническая гипоксия приводит к деформации концевых фаланг пальцев по типу «барабанных палочек» и ногтей — по типу «часовых стекол».
Поражение поджелудочной железы обусловливает синдром мальабсорбции с дистрофией, обильным жирным стулом. На поздних стадиях развивается сахарный диабет и — у 13% больных смешанной и кишечной формой МВ — цирроз печени. Цирроз печени типичен для мутаций W1282X, дельта-F508 и Х1303К. У 5-10% больных выявляют билиарный цирроз с портальной гипертензией. В целом же клинически, лабораторно, инструментально и морфологически изменения печени обнаруживают у 86% больных [2, 15, 16].
Так как поражаются все органы, содержащие слизеобразующие железы, типичны колитический синдром, хронический холецистит, синуиты.
1. Общие симптомы: дистрофия, отставание в физическом развитии, рецидивирующие хронические заболевания органов дыхания, полипы носа, упорно текущий хронический гайморит, хронический бронхит, рецидивирующий панкреатит, синдром мальабсорбции с «жирным стулом», «неясные» диспептические нарушения, цирроз печени, сниженная фертильность у женщин, дыхательная недостаточность, «тепловой коллапс». Хронические колиты, холециститы у родственников.
2. Потовый тест: ионофорез с пилокарпином. Повышение Cl более 60 ммоль/л — вероятный диагноз; концентрация Cl > 100 ммоль/л — достоверный диагноз. При этом разница в концентрации хлора и натрия не должна превышать 8-10 ммоль/л. Потовый тест для постановки окончательного диагноза должен быть положительным не менее трех раз. Потовую пробу необходимо проводить каждому ребенку с хроническим кашлем.
3. Химотрипсин в стуле [6]. Химотрипсины — группа эндопептидаз, образуются клетками поджелудочной железы как химотрипсиногены А, В и С. После поступления в желудочно-кишечный тракт активируются. Для определения химотрипсина в стуле необходимо не менее чем за 3 дня до исследования отказаться от приема пищеварительных ферментов. При МВ концентрация химотрипсина в каловых массах снижена. (Проба не стандартизована. Нормативные значения разрабатываются в конкретной лаборатории.) Дифференциальный диагноз проводится с экзокринной панкреатической недостаточностью любой другой этиологии, синдромом Швахмана, состоянием после резекции желудка по Бильрот II, белковым дефицитом.
Ложноотрицательные значения получают при незначительном и умеренном снижении экзокринной функции поджелудочной железы.
Ложноположительные значения могут быть при поздней отмене энзимных препаратов перед проведением пробы.
4. Определение жирных кислот в стуле [6]. В норме менее 20 ммоль/день. Пограничные значения — 20-25 ммоль/день. Проба положительна при снижении экзокринной функции не менее чем на 75%. Дифференциальный диагноз:
5. ДНК-диагностика. Наиболее чувствительная и специфическая. Ложные результаты получают в 0,5-3% случаев. Оправданна для стран, где частота дельта-F508 выше 80%. В России из-за относительно низкой частоты последней ДНК-диагностика затруднительна и дорога. Как отмечалось выше, частота разных мутаций варьирует среди этнических групп. Признано, что если ни одна из десяти «локальных» мутаций не обнаруживается на том или ином аллеле хромосомы ребенка и родители его не являются родственниками, вероятность МВ у данного пациента ничтожна. ДНК-обследование родителей и других членов семьи без клинических признаков болезни нецелесообразно, за исключением случаев пренатальной диагностики.
6. Пренатальная ДНК-диагностика. Исследование изоэнзимов интестинальной щелочной фосфатазы из околоплодных вод. Возможно с 18-20 недели беременности. Ложноположительные и ложноотрицательные значения получают в 4% случаев.
7. В настоящее время в нашей стране идентификации доступно около 75% мутантных хромосом, что не позволяет проводить массовый скрининг. Но возможно проведение каскадного скрининга [2], когда в центре находится семья больного МВ и родственники. Скрининг новорожденных может осуществляться методом IRT (иммунореактивный трипсин) или ВМ-лабстик-тест («Хехст»). Метод IRT относительно дорог и дает около 10% ложноположительных и ложноотрицательных результатов. ВМ-тест значительно дешевле, но может дать 15% ложноотрицательных результатов. Скрининг новорожденных представляется перспективным направлением, так как позволяет определить частоту МВ в стране, рано начать интенсивное лечение и идентифицировать семейные пары, нуждающиеся в генетическом консультировании.
Лечение МВ требует комплексного подхода. Еще раз следует подчеркнуть, что оно должно проводиться в специализированных центрах и под их контролем. Лечить ребенка невозможно без тесного сотрудничества с родителями. Поэтому родители должны быть информированы о сути заболевания, характере и особенностях течения процесса, методах лечения, обучены диагностике ухудшений, ряду лечебных и реабилитационных методов. В нашей стране дети с МВ имеют льготы, однако их перечень следует существенно расширить и продлить в возрастном аспекте. Визиты к врачу должны происходить не реже 1 раза в 3 мес. Оценивают антропометрические данные, функцию внешнего дыхания, общие анализы крови и мочи, копрограмму, анализ мокроты на флору и ее чувствительность к антибиотикам. По показаниям проводят рентгенографию грудной клетки, эхографию печени и сердца, исследуют иммунный статус. Желателен «дневной стационар», широко распространенный на Западе и хорошо принятый у нас пациентами и их родителями [2, 13, 15, 16]. Прежде всего вносится коррекция в лечебно-реабилитационный режим. Необходимо эффективно очищать бронхиальное дерево от вязкой мокроты, бороться с инфекцией и обеспечить хорошее физическое развитие больного. Кинезотерапия включает позиционный дренаж, клопф-массаж, вибрацию, специальные дыхательные упражнения, активные циклы дыхания, форсированную экспираторную технику, аутогенный дренаж, дыхание с положительным давлением на выдохе. Последняя процедура проводится под контролем врача, так как возможны осложнения вплоть до пневмоторакса. Обязательно применение бронходилятаторов, муколитиков (см. ниже), по возможности — амилорида (блокатор натрия) и/или «пульмозима» (ДНК-аза, производимая фирмой «Хоффман ля Рош»).
| Пациенты с муковисцидозом и члены их семей должны находиться под наблюдением в специализированных центрах. Но в нашей стране таких центров немного, а с учетом расстояний и крайней затруднительности дорожных расходов они становятся и вовсе малодоступными для пациентов. Поэтому принципы ведения больных с МВ должны быть знакомы врачам широкой лечебной сети |
Легочная патология. Частое применение антибиотиков. Они должны назначаться при ранних признаках активации воспаления с длительностью курсов до 2-3 недель. Многие антибиотики, эффективные по отношению к псевдомонадам, требуют внутривенного введения. При псевдомонадной инфекции (по антибиотикограмме!) эффективны аминогликозиды, цефалоспорины III поколения, фторхинолоны. Некоторые из цефалоспоринов и тобрамицин могут быть ингалированы. Последний в дозе 300 мг независимо от возраста 1 раз в сутки. При стафилококковом обсеменении эффективен котримаксозол, но клиренс его у пациентов с МВ повышен, поэтому надо увеличить обычную терапевтическую дозу.
Муколитики — непременный атрибут терапии МВ. Назначают как внутрь, так и в ингаляциях: N-ацетилцистеин 300-1200 мг/сутки. (Передозировка препарата ведет к лизису слизистой.) Бронхоскопическое введение муколитиков с последующей аспирацией секрета и антибиотиков в конце процедуры бронхиального лаважа (с дисперсией ультразвуком) — эффективный путь эндоскопического введения препаратов. Современные методики трансназальной гибкой бронхоскопии позволяют применять процедуру амбулаторно.
В случаях бронхоспастического синдрома — ингаляции бета-миметиков (длительное применение чревато развитием аритмий и дилятационной кардиомиопатии), а также кортикостероидов (системно или в ингаляциях) с целью уменьшить воспалительные процессы в легких (побочное действие — остеопороз, избыточный вес, инфекционные осложнения), нестероидных противовоспалительных препаратов. Эти средства снижают воспалительные реакции бронхиального дерева, которые приносят иногда больше вреда, чем собственно инфекционный агент. С этой точки зрения оправданно применение альфа-один-антитрипсина, сывороточного лейкоцитарного ингибитора протеаз, антицитокинов (прежде всего — антиинтерлейкины ИЛ2, ИЛ8). Альтернативные хлоридные каналы открывают АДФ и УДФ (уридиндифосфат).
В странах Северной Америки и в Европе производят пересадку легких или комплекса сердце—легкие, а также разрабатывают генно-инженерные подходы с коррекцией функции мутантного гена путем применения пневмотропных вирусов со встроенными в них генетическими конструкциями. В 1998 г. начата программа генной терапии МВ и в России.
Панкреатическая недостаточность. Хороший нутритивный статус — одна из основных целей в лечении детей с МВ. Поэтому необходима постоянная ферментная терапия. Пациенты с хорошим физическим развитием имеют лучший прогноз. Они более активны, лучше переносят физические нагрузки, имеют лучшие показатели функции внешнего дыхания и иммунитета. Эффективны (по нарастающей) панкреатин, мезим-форте, панзитрат, «Креон». Последние два в виде гранул и микротаблеток с рН-чувствительной оболочкой. Доза индивидуальна. Обычно начинают с 2–6 тыс ед. липазы на кг массы/сутки. Повышают постепенно, исходя из характеристик стула, показателей веса ребенка. Превышение дозы приводит к раздражению слизистой кишечника, воспалению. В крайне редких случаях возможны поствоспалительные стриктуры толстой кишки. Хороший эффект при поражении печени (холестаз, предцирроз, цирроз) оказывает назначение урсодезоксихолевой кислоты (урсосан) в сочетании с таурином, способствующим выведению желчных кислот, которые облегчают переваривание жиров.
Принципы ведения пациента, контрольные исследования. Питание должно превышать возрастные калорийные нормы на 10–15%, обязательно введение поливитаминов, микроэлементов. Белковая диета без ограничения жиров, но при адекватной заместительной терапии современными микросферическими ферментами с рН-чувствительной оболочкой.
Контроль массы тела. Снижение веса или плоская весовая кривая указывают на плохое ферментное обеспечение или на обострение хронического бронхолегочного процесса.
Бактериологическое исследование мокроты с антибиотикограммой или мазка из зева 1 раз в 6 месяцев и после обострения бронхолегочного процесса или при изменении цвета мокроты (зеленый цвет, примесь крови).
HbA1 — гликолизированный гемоглобин. У детей старше 8 лет определять 1-2 раза в год. При сниженной толерантности к глюкозе — чаще.
Рентгенографию органов грудной клетки делать при обострении бронхолегочного процесса, особенно при подозрении на пневмонию. Как контроль — 1 раз в год.
Эхокардиограмма (особенно правых отделов, легочной артерии) не реже 1 раза в год.
ЭКГ. 1–2 раза в год. По показаниям — чаще.
Функциональные пробы легких. Функция внешнего дыхания (обычно — с 6 лет, возраста кооперативного участия) и газы крови — 1 раз в месяц и после обострения бронхолегочного процесса.
Бодиплетизмография. С 8 лет — 1-2 раза в год. По показаниям — чаще. Функцию внешнего дыхания не исследуют в терминальной стадии, так как в префинальном периоде тесты обременительны для больного и не сказываются на лечении.
При подозрении на цирроз печени — ультразвуковые исследования, печеночные функции, протромбин, реже — биопсия.
Полипы носа. Стероиды ингаляционно или в виде мазевых аппликаций. Оперативное лечение нецелесообразно (вероятность рецидивов высока).
Пневмоторакс. Развивается у детей старшего возраста и взрослых. Вероятность рецидивирования высока. Необходимы покой, при объеме менее 10% легочного — минимум манипуляций. При напряженном пневмотораксе — дренаж, плевральная пункция. При рецидивах — удаление буллезной доли, плевродез.
Ателектазы. Необходимы бронхоскопии с бронхоальвеолярным лаважем и введением муколитиков, антибиотиков, дыхательная гимнастика.
Пневмонии. Общие принципы терапии. Крайне важны дренирующие мероприятия.
Кровохарканье. Как симптом переоценивается и вызывает неоправданную панику. Выглядит как примесь крови к мокроте, чаще всего обусловлено поражением слизистой бронхов. При легочном кровотечении (300 и более мл одномоментно или более 100 мл за 3 дня) — ангиографическая эмболизация или окклюзия кровоточащего сосуда. При неудаче — перевязка сосуда или резекция сегмента (доли).
Легочное сердце. При адекватной терапии развивается как манифестная форма только у взрослых. Им же свойственны и нарушения ритма сердца. Дигиталис при «легочном сердце» малоэффективен, желательно применение коринфара, нифедипина и гидралазина (последний опасен возможными аутоиммунными реакциями).
Аспергиллез. Ассоциируется с кортикостероидной терапией. Если аспергиллы обнаружены в мокроте случайно и не проявляются клинически, то лечения не требуется. Терапия назначается при распространенных бронхоэктазах, расширении бронхов, нарастании легочной симптоматики, особенно с признаками торпидной обструкции, повышении общего IgЕ и специфического IgE.
Аллергия и астма. У 25–48% больных наблюдается сочетание МВ и астмы.
Соледефицитный эксикоз. Может быть не только у новорожденных, но и у детей разного возраста и у взрослых, особенно в жаркое время года. Профилактика — обильное питье и достаточное поступление солей (3–8 г/сутки).
Сахарный диабет панкреатогенный. Развивается очень медленно, постепенно. Наблюдается у 2% детей и у 15% взрослых, больных МВ.
Кровотечение желудочное и из варикозных вен пищевода (при циррозе печени). Проводятся эндоскопическое склерозирование варикозно расширенных вен, частичная резекция селезенки, шунтирующие операции.
Камни желчного пузыря. Эндоскопическое удаление менее рискованно, чем лапаротомическое, при котором выше вероятность легочных осложнений.
Эквивалент мекониального илеуса у подростков и взрослых — частичная дистальная интестинальная обструкция с густым вязким стулом. При илеусе, не требующем хирургического вмешательства, — промывание гастрографином, гипаком, N-ацетилцистеином. При отсутствии эффекта — хирургическое вмешательство.
Пневматоз стенки кишки может быть обнаружен случайно и сам по себе не требует вмешательства.
Выпадение прямой кишки при адекватной ферментной заместительной терапии встречается очень редко.
Легочная остеоартропатия. Наряду с деформациями концевых фаланг могут появиться периоститические боли в длинных трубчатых костях. Для облегчения состояния назначают нестероидные противовоспалительные средства.
Деформации грудной клетки развиваются как итог легочной патологии.
Таким образом, объединенные усилия педиатров, терапевтов, бронхологов, гастроэнтерологов, специалистов по лечебному питанию, психологов, социальных работников при условии ранней диагностики и адекватной терапии, заинтересованном участии в лечении пациента и его родственников уже на сегодня способствуют изменению качества жизни и увеличивают ее продолжительность у больных МВ.