Мультигенная форма тромбофилии что это
Антифосфолипидный синдром, генетические тромбофилии в патогенезе основных форм акушерской патологии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Статья посвящена антифосфолипидномусиндрому, генетическим тромбофилиям в патогенезе основных форм акушерской патологии
На протяжении существования научного акушерства патология гемостаза и, как следствие, ее синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром) всегда рассматривались как вторичные по отношению к основным патологическим синдромам в акушерстве: гестозам, септическому шоку. Парадоксально, но при том, что большинство открытий в гемостазиологиии связаны с акушерством (ДВС-синдром, септический шок как аналог феномена Санарелли-Шварцмана, антифосфолипидный синдром), долгое время в акушерстве они игнорировались и внедрялись с большим опозданием по сравнению с другими клиническими дисциплинами.
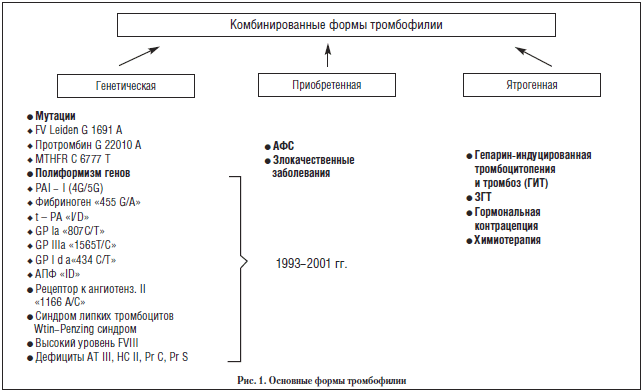
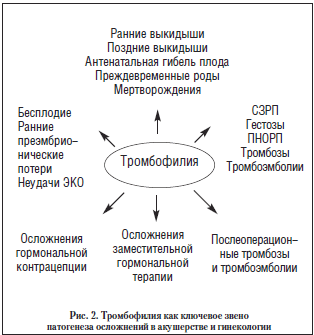
Открытие в конце ХХ века (1987 г.) антифосфолипидного синдрома (АФС) и целого ряда ранее неизвестных, но наиболее распространенных форм генетических дефектов системы гемостаза, предрасполагающих к разнообразным тромботическим осложнениям: мутация фактора V Лейден, мутация протромбина G20210A, мутация метилентетрагидрофолатредуктазы (MTHFR C677 T), полиморфизм гена активатора плазминогена (PAI-1 4G/5G), полиморфизм тромбоцитарных рецепторов (1993-2000 гг.) (рис. 1) как основных причин приобретенной и генетической тромбофилий, позволило с принципиально новых позиций оценить патогенез различных осложнений как в общеклинической, так и в акушерско-гинекологической практике (рис. 2). Исследования, посвященные роли тромбофилии, в частности, АФС, мутации фактора V Leiden, протромбина G202 10A и MTHFR C677T, которые проводились нами с начала 90-х годов, показали крайне высокую частоту их не только у пациенток с различными тромбоэмболическими осложнениями, но и типично акушерскими осложнениями, такими как привичные выкидыши, тяжелые гестозы, преждевременная отслойка нормально расположенной плаценты (ПОНРП), синдром задержки внутриутробного развития плода (СЗВРП), антенатальная гибель плода (АГП) и др.
В целом тромбофилия является результатом: а) снижения естественной противотромботической защиты; б) активации протромботических механизмов или сочетания этих факторов. Какими бы ни были инициальные причины тромбофилии, результат во многом зависит от синергизма эффектов на систему гемостаза. Наиболее синергичными эффектами, как видно из рисунка 4, обладают АФС, мутация FV Leiden и MTHFR C677T (гипергомоцистеинемия). Следует заметить, что эти дефекты встречаются в то же время значительно чаще, чем дефициты АТ III, протеинов С (рис. 4).
При том, что роль АФС, FV Leiden, протромбина G20210A, MTHFR С677Т в патогенезе акушерских осложнений в настоящее время широко исследуется, фактически единичные публикации появляются относительно роли полиморфизмов гена PAI-1 4G/4G и АПФ I/D.
Мы исследовали не только эти два полиморфизма, но также и полиморфизм тромбоцитарных рецепторов, фибриногена, рецептора к ангиотензину II. Благодаря более широкому охвату исследования на наличие тромбофилии, мы, с одной стороны, получили и более высокий процент тромбофилии во всех обследованных группах, а с другой стороны, получили возможность объяснить частое несоответствие между генотипом и фенотипом. Так, в подтверждение вышесказанного, тромбофилия в целом (вне зависимости от генеза) была выявлена у 71,3% пациенток с синдромом потери плода, до 80% пациенток с гестозом и у 100% пациенток с тромбозами в анамнезе и ПОНРП, что превышает частоту тромбофилии в других аналогичных исследованиях, где оценивались только FV Leiden, мутация протромбина G20210A и MTHFR С677Т.
Согласно нашему исследованию, роль тромбофилии (в том числе различных ее форм) неодинакова в патогенезе и структуре репродуктивных потерь в рамках синдрома потери плода. Так, циркуляция АФА чаще обнаруживалась у пациенток с ранними выкидышами (43,1%), соответственно у 22,4% пациенток с поздними выкидышами и у 35,7% – с ранними преэмбрионическими потерями. В то же время мутации FV Leiden чаще имела место у пациенток с поздними выкидышами (15%). Мутация протромбина G20210A встречалась достоверно реже во всех группах репродуктивных потерь (по сравнению с АФА, FV Leiden и MTHFR С677Т) и составила 4,2% и 3,0% в группах ранних и поздних выкидышей соответственно. Наиболее распространенной у пациенток с синдромом потери плода оказалась мутация MTHFR C677T, которая соответственно составила 41,2% у пациенток с синдромом потери плода. Одним из наиболее важных результатов исследования нам представляется обнаруженная высокая частота мультигенных форм тромбофилии (два и более дефекта) у обследованных пациенток с синдромом потери плода. Суммарно мультигенная тромбофилия у всех пациенток с синдромом потери плода составила 55,7%: в группе ранних выкидышей – 55,6%, в группе поздних выкидышей – 62,3%, в группе ранних преэмбриональных потерь – 39,3%. При этом характерной особенностью мультигенных форм тромбофилии явилась высокая частота полиморфизма различных генов тромбофилической направленности. При анализе клинических проявлений тромбофилии у пациенток с синдромом потери плода также была выявлена следующая особенность: тромбозы в анамнезе имели пациентки либо с гомозиготной мутацией FV Leiden, либо с сочетанием АФА и FV Leiden, мутацией протромбина G20210A или полиморфизмом PAI-1 4G/4G. Кроме того, тромбозы отмечались и у пациенток с более чем 3 гомозиготными формами полиморфизма генов (PAI-1, гена фибриногена и/или тромбоцитарных рецепторов). С нашей точки зрения, наиболее яркой моделью для изучения нетромботических эффектов тромбофилии являются ранние преэмбрионические потери. Крайне интересные результаты были получены нами именно в группе пациенток с преэмбрионическими потерями. Характерно, что большинство женщин этой группы лечились изначально от бесплодия. При этом у большинства из них уже были неоднократные неудачные попытки экстракорпорального оплодотворения (ЭКО).
Анализ тромбофилии показал, что у 60,7% пациенток имела место тромбофилия. При этом наиболее часто обнаруживался полиморфизм PAI-1 (50,0%), в том числе в сочетании с дисфибриногенемией и/или полиморфизмом АПФ «I/D», а также мутация MTHFR С677Т (35,7%), АФА (35,7%) и мультигенные формы тромбофилии (39,3%). Характерно, что у женщин с гомозиготным полиморфизмом PAI-1 4G/4G, синдромом поликистозных яичников и/или метаболическим синдромом имело место значительное повышение уровня PAI-1. Это важное наблюдение позволяет предположить, что, возможно, в патогенезе бесплодия (а точнее, часто нераспознанных преэмбрионических потерь) при СПКЯ и метаболическом синдроме, помимо эндокринных причин, крайне важную роль играет наличие одновременно высокого уровня PAI-1. При беременности энзимы фибринолитической системы занимают центральное место в контроле и регуляции физиологического процесса депозиции фибрина, а в ряде случаев – и в предотвращении депозиции фибрина в области сосудистого ложа.
Вообще следует отметить, что физиологическое течение беременности сопровождается значительными изменениями в системе гемостаза и, в частности, в области маточно-плацентарного кровотока. Такая физиологическая адаптация необходима для обеспечения, по меньшей мере, двух важных функций: а) интеграции быстро увеличивающегося материнского и плодового кровотоков в области их «границы раздела» – плаценты; б) эффективностью контроля кровотечений со стороны плаценты при ее отделении во время родов. Изменения в свертывающей системе при физиологически протекающей беременности представлены слабой локальной активацией ввертывания в маточном сосудистом русле, сопровождающейся повышенным синтезом фибриногена и других факторов свертывания в сочетании со слабым снижением уровня естественных ингибиторов свертывания крови. Важно отметить, что снижение фибринолитической активности в маточном кровотоке влияет и на состояние свертывающей системы в периферическом кровотоке у беременной. Как интра-, так и экстраваскулярная депозиция фибрина является частью физиологического процесса при имплантации плодного яйца и инвазии трофобласта в области плацентарноо ложа. Однако недавние исследования показали, что клетки трофобласта ответственны не только за контроль физиологической депозиции фибрина в области плацентарного ложа, но и за повышенную депозицию фибрина, которая наблюдается при осложненном течении беременности. Процесс регуляции фибринолиза зависит в первую очередь от активности активаторов плазминогена (t-PA, u-PA) и от уровня синтеза и секреции ингибитора активации плазминогена и их взаимодействия. Дисбаланс маточно-плацентарного фибринолитического контроля при ВЗРП и гестозе в результате повышенной продукции PAI-1 ответственен не только за повышение депозиции фибрина в маточных сосудах и снижение маточно-плацентарного кровотока: ему принадлежит важная роль в снижении степени инвазии трофобласта на ранних сроках беременности, что также создает предпосылки для развития в дальнейшем гестоза и ВЗРП.
Ранние преэмбрионические потери в основном связаны с дефектами имплантации плодного яйца. Процесс имплантации начинается на 6-й день после овуляции и представляет собой не односторонний процесс активной инвазии, а своеобразный энзиматический «обмен» между бластоцистой и эндометрием, для которого необходима гормональная стимуляция и определенная «зрелость» эндометрия. В процессе подготовки к имплантации под влиянием прогестерона в эндометрии происходит повышение содержания ингибитора активации плазминогена типа 1 (PAI-1), тканевого фактора (TF) и снижение уровня активаторов плазминогена тканевого и урокиназного типов, металлопротеаз матрикса и вазоконстриктора – эндотелина 1. Эти физиологические механизмы регуляции гемостаза, фибринолиза, экстрацеллюлярного матрикса и сосудистого тонуса направлены на предотвращение образования геморрагии при дальнейшей инвазии трофобласта. Со своей стороны, бластоциста синтезирует активаторы плазминогена тканевого и урокиназного типа и протеазы, которые необходимы для разрушения экстрацеллюлярного матрикса в процессе имплантации. Их излишний синтез, в свою очередь, регулируется хорионическим гонадотропином (ХГ). В процессе «дозированного» разрушения матрикса под действием ферментов, выделяемых бластоцистой, клетки эндометрия, которые содержат определенное количество экстраваскулярного фибрина, не фагоцитируются, а как бы «отодвигаются» посредством «контактного ингибирования». Эта фаза процесса имплантации носит название «аваскулярной» или иначе – «гистиотрофной». Следует отметить, что это наиболее уязвимая фаза имплантации: часто такие факторы, как вирусы, токсины, антитела и пр., могут непосредственно влиять на полноценность имплантации. С точки зрения влияния тромбофилии наиболее ярким примером являются полиморфизм PAI-1 и другие генетически обусловленные дефекты фибринолиза и АФС (рис. 5).
В условиях гипофибринолиза (как в результате полиморфизма PAI-1, так и других причин) происходит десинхронизация локальных процессов фибринолиза и фибринообразования при имплантации. В такой ситуации протеаз, синтезируемых бластоцистой, становится относительно недостаточно, чтобы разрушить экстрацеллюлярный матрикс в эндометрии и внедриться на достаточную глубину. Если при этом еще имеет место и циркуляция АФА, то это усугубляет ситуацию, поскольку:
а) АФА не только усиливают протромботические механизмы и потому десинхронизируют процессы фибринолиза и фибринообразования, но и
б) АФА могут изменять поверхностные предимплантационные характеристики плодного яйца: как заряд, так и конфигурацию.
Если же рассматривать этот вопрос в контексте перечня неудач ЭКО, то, с нашей точки зрения, помимо неучета тромбофилии, дополнительно негативную роль играет вспомогательная терапия с массивной гормонотерапией. В ряде случаев у пациенток с диагнозом бесплодия могут иметь место ранние преэмбрионические потери, которые клинически маскируются нерегулярным менструальным циклом.
Возвращаясь к эффектам тромбофилии, следует отметить, что страдают не только ранняя (аваскулярная) фаза имплантация, но и более поздние этапы имплантации (гемотрофная фаза) и плацентации. Гемотрофная (васкулярная) фаза имплантации начинаются с 12 дней после овуляции: между пролиферирующими клетками трофобласта начинают образовываться лакуны, которые в дальнейшем будут увеличиваться, сливаться и преобразовываться в межворсинчатое пространство плаценты. Именно в эту фазу начинается активный контакт с плазмой матери: трофобласт внедряется (разрушая их) в тонкостенные материнские сосуды, из которых кровь свободно изливается в лакуны трофобласта. К 21 дню после овуляции ворсины трофобласта уже достаточно васкуляризированы и можно констатировать факт установления маточно-плацентарного кровотока. Факторы, обеспечивающие инвазию трофобласта и нормальное развитие плаценты на ранних стадиях очень многообразны: факторы роста, цитокины, интегрины, молекулы адгезии, антигены комплекса гистосовместимости (преимущественно класса 1) и др. Тромбофилия (в том числе вызванная АФА) напрямую или опосредованно влияет на процесс имплантации и ранние эмбрионические стадии.
Отдельно хотелось бы обсудить роль антифосфолипидных антител в патогенезе синдрома потери плода, поскольку эффекты АФА чрезвычайно многообразны в отличие от изолированной формы генетической томбофилии, что обусловлено, по-видимому, большей гетерогенностью различных антител, объединенных общим термином «антифосфолипидные антитела». Именно поэтому наиболее неблагоприятен прогноз при сочетании АФС с генетической тромбофилией: в таких случаях протромботическая тенденция становится непропорционально выше и реализация возможна не только в форме тромботического поражения микроциркуляции и синдрома потери плода, но и в форме макротромбозов. Тромбирование сосудов микроциркуляторного русла в условиях тромбофилии ответственно за широкий спектр акушерских осложнений – от ЗВРП до АГП, мертворождений и ПОНРП. В то же время неблагоприятный фон имеет место уже с момента имплантации и дифференцировки трофобласта.
Повреждающее действие АФА может осуществляться несколькими путями:
– изменяются адгезивные характеристики предимплантационого эмбриона;
– нарушается слияние синцития;
– снижается глубина инвазии трофобласта;
– подавляется продукция хорионического гонадотропина;
– усиливаются тромботические тенденции за счет предоставления матриц для реакций свертывания.
Последний момент объясняет положительный эффект от антикоагулянтной терапии с самых ранних сроков. Эти механизмы также позволяют объяснить неудачные попытки искусственного оплодотворения и пересадки эмбриона у женщин с АФА. Если роль тромбофилии в патогенезе потерь плода в настоящее время интенсивно изучается, то роль тромбофилии в патогенезе гестозов стала изучаться сравнительно недавно. По-видимому, это обстоятельство связано с тем, что гестоз считается полиэтиологичным синдромом, а нарушения в гемостаза рассматривались как вторичные явления: хорошо известно, что гестоз сопровождается развитием ДВС-синдрома.
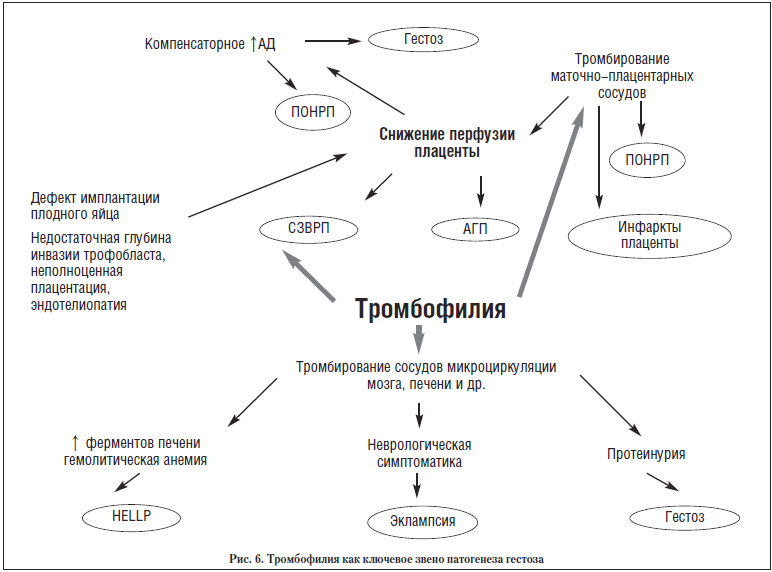
С нашей точки зрения новая эра в понимании этиопатогенеза гестоза началась с установления роли тромбофилии в патологии процессов имплантации плодного яйца, плацентации и более поздних нарушений маточно-плацентарной перфузии. В настоящее время уже не вызывает сомнений ведущая роль повреждения эндотелия и дисфункции эндотелиальных клеток в патогенезе гестозов. Основное внимание исследователей на сегодняшний день сфокусировано на триаде нарушений при гестозе: а) нарушение инвазии трофобласта; б) маточно-плацентарная ишемия; в) генерализованная активация эндотелиальных клеток или механическое повреждение. Хотя этиология гестозов остается открытым вопросом, в настоящее время важными инициирующими факторами считаются недостаточная плацентарная инвазия, а также нарушения дифференцировки трофобласта и перестройки сосудов плацентарного ложа. Дисфункция эндотелиальных клеток при гестозе может быть результатом действия различных факторов: нарушения кровотока, гипоксии, продуктов перекисного окисления липидов – свободных радикалов и атомарного кислорода, других субстанций. Например, внутрисосудистое увеличение силы ударной волны крови в результате вазоспазма или недостаточной перестройки спиральных артерий нарушает морфологию и функцию эндотелия. Гипоксия, как результат сниженной плацентарной перфузии, является хорошо известным стимулятором синтеза и секреции эндотелина и эндотелиального фактора роста в кровоток. Повреждения эндотелия могут вызывать появление высокоактивных производных атомарного кислорода, свободные радикалы, а также антифосфолипидные антитела и цитокины, такие как TNF-a, IL-6. Важно отметить, что в условиях хронического патологического процесса, каковым является и гестоз, такой эндотелиальный ответ может провоцировать развитие порочного круга, состоящего из вазоспазма, микротромбозов, дезинтеграции сосудистой системы и выраженных физиологических нарушений, которые персистируют до тех пор, пока не удален инициирующий фактор. Первые патологические изменения, связанные с гестозом, могут появляться уже в процессе инвазии трофобласта, когда в условиях нормы происходит денудация (отслойка) эндотелиального слоя маточных спиральных артерий и замещение его эндоваскулярным цитотрофобластом. Недостаточная инвазия трофобласта в дальнейшем определяет «эндотелиальный» феномен гестоза, что подразумевает эндотелиальный генез развивающихся при этом нарушений. Мы считаем, что особенностью гестоза как патологического состояния является развитие порочного круга изменений, которые, раз появившись, способствуют возникновению ряда новых патологических изменений, которые, в свою очередь, способствуют поддержанию существования и аггравации старых предшествующих изменений и появлению новых нарушений.
С этой точки зрения, если принять тромбофилию как постоянно персистирующий фактор у женщин с генетической тромбофилией или АФС, первые ее эффекты представляются нам, как дефекты имплантации плодного яйца, недостаточная глубина инвазии трофобласта, неполноценная плацентация и, как следствие – эндотелиопатия (рис. 6).
Все эти процессы, в свою очередь, являются причиной дальнейшего снижения перфузии плаценты. Снижение перфузии плаценты, в свою очередь, сопровождается развитием гипоксических изменений и еще большим повреждением эндотелия, что влечет за собой увеличение степени выраженности тромбофилии и вазоконстрикцию. Таким образом, патогенез гипертензии при гестозе может слагаться, по меньшей мере, из двух составляющих:
а) вазоконстрикции, как следствия распространенного нарушения вазомоторной функции эндотелия;
б) компенсаторного повышения системного АД в организме матери в ответ на снижение перфузии плаценты.
Дополнительным фактором, поддерживающим и усугубляющим сниженную перфузию плаценты, является тромбирование маточно-плацентарных сосудов вплоть до полного блока микроциркуляции, когда возможны и ПОНРП, и АГП, а на более ранних этапах – СЗВРП. Вообще же блокада микроциркуляции при гестозе может носить поистине катастрофический характер и сопровождаться такими клиническими явлениями, как HELLP-синдром, эклампсия, острая почечная недостаточность вплоть до развития полиорганной недостаточности.
Все вышеизложенное подтверждает и наше исследование. Так, согласно нашим данным, тромбофилия как сложный интегральный фактор в патогенезе развития гестозов (а с нашей точки зрения и инициальный) была обнаружена у 80% пациенток с гестозами. Среди пациенток с легкими формами гестоза тромбофилия была выявлена у 54%, в то время как в контрольной группе беременных с физиологическим течением беременности – у 16% (р Литература
Тромбофилия
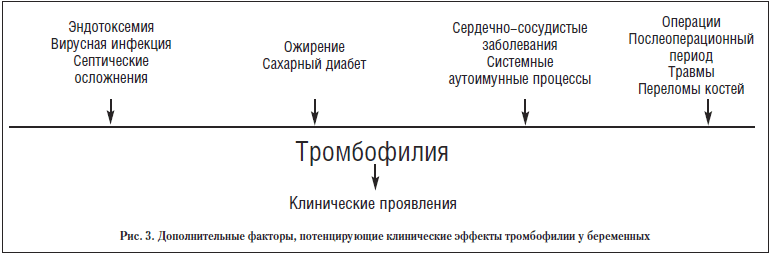
Термин «гематогенная тромбофилия» объединяет наследственные, генетически предопределённые, и приобретенные (симптоматические, вторичные) нарушения равновесия свёртывания крови, которые рано проявляются появлением и рецидивированием тромбозов, тромбоэмболией, инфарктом и ишемией органов. Это не болезнь, а патологическое состояние, которое обусловлено комбинацией факторов риска, которые приводят к развитию тромбоза.
Причины
Гемостазиологи выделяют 3 фактора, способствующие развитию тромбозов:
Предтромботические состояния называют тромбофилиями. Для них характерна склонность к тромбозам различной локализации даже без повреждения стенки сосуда. Тромбофилии бывают первичными, или врождёнными, и вторичными, развившимися на фоне основного заболевания.
Таблица №1. Генетические аномалии, вызывающие осложнения.
| № п.п. | Генетическая аномалия | Характеристика |
| 1. | Мутационные изменения гена пятого фактора свёртывания | Аутосомно-доминантная мутация гена, который отвечает за продукцию пятого фактора. Она обусловлена заменой остатка аденина в положении 1691 на остаток тимина, и остатка глютамина в позиции 506 на аргинин |
| 2. | Мутация генов протеинов C и S | Наследуется аутосомно-доминантным путём. В результате мутации не заканчивается процесс синтеза или происходит деформация белковые молекулы |
| 3. | Наследственная гипергомоцистеинемия | Происходит мутация генов, которые отвечают за выработку ферментов цистатион-В-синтазы и метилентетрагидрофолатредуктазы |
| 4. | Наследственный дефицит антитромбина III | Наследуется по аутосомно-доминантному пути. Может либо снижаться концентрация этого фактора, либо нарушаться его функция |
| 5. | Мутация гена протромбина G 20210A | Происходит замена гуанина в положении 20210 на остаток аденина, расположенного в нетранслируемом участке гена протромбина. При этом существенно повышается выработка и содержание этого прокоагулянта |
К факторам риска развития тромбофилии относятся:
Риск развития тромбофилии повышен у пациентов, которые получают химиотерапию при злокачественном процессе, лечение прогестероном или эстрогенами, принимают селективные модуляторы эстрагона.
Симптомы
Тромбофилия не проявляется какими-то характерными клиническими симптомами. Основные состояния приобретенной тромбофилии следующие:
У врачей возникает подозрение о наличии у пациента проблем со свёртываемостью крови при появлении следующих признаков претромбоза:
В этих случаях проводят лабораторные исследования системы гемостаза, которые позволяют оперативно выявить и измерить нарастающую тромбогенность крови, требующую коррекции. К лабораторным маркерам тромботической готовности относят активацию тромбоцитов, повышение уровня маркеров активации свёртывания крови и состоявшегося фибринолиза (активированного фактора VII, тканевого фактора, комплекса тромбин-антитромбин). Также в специализированных клиниках проводят тест калиброванной тромбографии. Он позволяет с высокой точностью измерять не только динамику образования, но и инактивацию ключевого фермента свёртывания крови тромбина.
Лечение
У большинства людей, имеющих постоянные или временные факторы риска тромбоза, на протяжении жизни не возникают симптомы нарушения свёртывания крови. Но врачи часто приравнивают наличие факторов тромбогенного риска к тромбофилии. Это приводит к гипердиагностике. Лечения требует не само заболевания, а его осложнения.
Между наличием факторов риска развития тромбофилии и тромбозом существует состояние предтромбоза. Оно заключается в готовности организма проявиться сосудистой катастрофой при сохраняющихся факторах риска. Если у пациента положительные тесты, обнаруживающие факторы тромбогенного риска, гемостазиологи назначают антитромботические препараты. Стратегии профилактики адаптируют к каждому пациенту и каждому ситуационному фактору риска.
Исходники:
Материал размещен в ознакомительных целях, не является медицинским советом и не может служить заменой консультации у врача.
Эксперт
Палишена Елена Игоревна
Врач-терапевт
Специалист по функциональной диагностике,
сертификат №7523,
диплом о медицинском образовании №36726043
Тромбофилия
В отличие от врождённой тромбофилии, приобретённое заболевание развивается на фоне других заболеваний, в том числе и онкологических, а также при приёме некоторых лекарств.
Клинические проявления тромбофилии
Заболевание протекает бессимптомно, поэтому нередко больные даже не подозревают о том, что страдают этим заболеванием. Из-за отсутствия симптомов тромбофилии, заболевание может резко проявиться в виде тромбоза глубоких вен с присущими этому заболеванию отёком и болью в ногах, синюшностью кожных покровов и лёгочной эмболией.
Наши врачи
Диагностика тромбофилии
Диагностика данного заболевания требует проведения лабораторных исследований. Как правило, обследование на наличие тромбофилии проводят в следующих случаях:
Тромбофилия назначается индивидуально при обязательном участии гематолога и напрямую зависит от факторов, которые привели к появлению этого заболевания.
Оно направлено на борьбу с тромбозами и терапию основного заболевания. Тромбозы лечатся при помощи антикоагулянтов и тромболитиков.
В клинике ЦЭЛТ имеется современное оборудование, позволяющее диагностировать и лечить разные виды тромбофилии. У нас работают опытные специалисты, которые вернут Вам здоровье!
Наши услуги в флебологии
Администрация АО «ЦЭЛТ» регулярно обновляет размещенный на сайте клиники прейскурант. Однако во избежание возможных недоразумений, просим вас уточнять стоимость услуг по телефону: +7 (495) 788 33 88
| Название услуги | Цена в рублях |
|---|---|
| Прием врача хирургического профиля (первичный, для комплексных программ) | 3 000 |
| Прием врача-сердечно-сосудистого хирурга (флеболога), д.м.н. Малахова Ю.С. с ультразвуковым исследованием (первичный) | 4 500 |
| Дуплексное сканирование вен обеих нижних конечностей | 6 000 |
| Дуплексное сканирование вен одной нижней конечности | 3 500 |
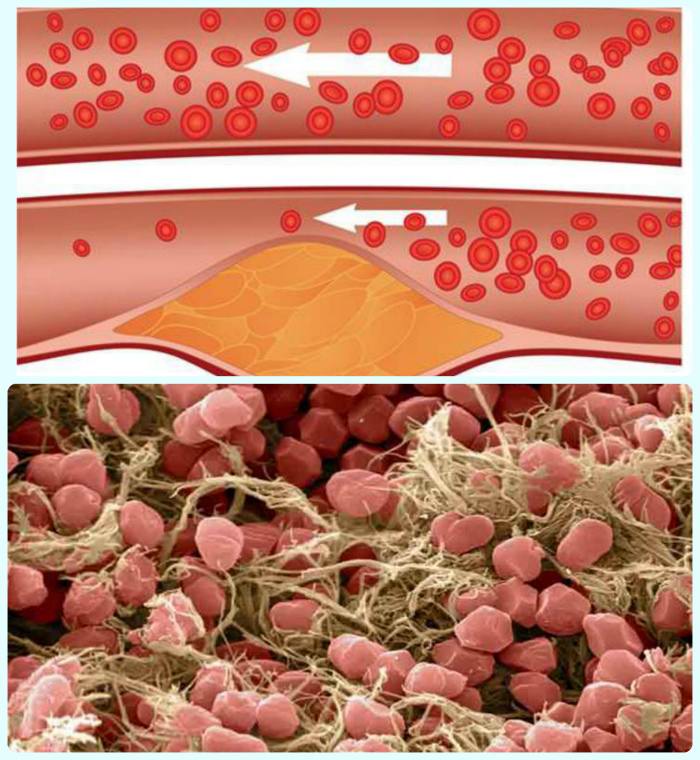
Тромбофилия — врождённое или приобретённое патологическое состояние, которое характеризуется нарушением свёртываемости крови и увеличением риска образования тромбов. Она отличается длительностью течения и внезапными осложнениями в виде формирования тромба в вене, его фиксацией к стенке с развитием воспалительных процессов (флеботромбоз) или закупорки кровеносных сосудов тромбом (тромбоэмболия). Такие состояния несут опасность для здоровья и жизни пациента и требуют оказания профессиональной медицинской помощи.
В то же время стоит отметить, что тромбофилия далеко не всегда может привести к осложнениям в виде тромбоза или тромбоэмболии — тем не менее, риск их возникновения при этой патологии существенно повышается.
Причины
Последние десятилетия отмечается рост количества пациентов, которые страдают от врождённых и приобретённых форм тромбофилии. Учёные объясняют это следующими факторами:
Разделение на генетическую и приобретённую тромбофилию осуществляется на основании причины возникновения заболевания. Так, генетическая тромбофилия является результатом особенностей строения некоторых генов, которые приводят к нарушениям в работе системы свёртываемости крови. Чаще всего встречаются следующие наследственные тромбофилии:
Они возникают вследствие:
В отличие от врождённой тромбофилии, приобретённые формы развиваются на фоне других заболеваний, в том числе и онкологических, а также при приёме некоторых лекарств. Принято выделять следующие причины:
Клинические проявления тромбофилии
Заболевание протекает бессимптомно, поэтому нередко больные даже не подозревают о том, что страдают этим заболеванием. Из-за отсутствия симптомов тромбофилии, заболевание может резко проявиться в виде тромбоза глубоких вен с присущими этому заболеванию отёком и болью в ногах, синюшностью кожных покровов и лёгочной эмболией.
Диагностика тромбофилии
Диагностика данного заболевания требует проведения лабораторных исследований. Как правило, обследование на наличие тромбофилии проводят в следующих случаях:
Наши врачи
Лечение
Лечение тромбофилии назначается индивидуально при обязательном участии гематолога и напрямую зависит от факторов, которые привели к появлению этого заболевания. Оно направлено на борьбу с тромбозами и терапию основного заболевания.
Консервативные методы лечения предусматривают комплексный подход, при котором особое внимание уделяется устранению причины возникновения патологии. Помимо этого применяется общая схема лечения и профилактики тромбоза.
Это обусловлено тем, что специфической терапии для лечения тромбофилии не существует. Лечение заключается в следующем:
Лечение тромбофилии, возникшей вследствие дефицита факторов свёртывания и антитромбина III, предусматривает переливание больших объёмов плазмы, которые сочетают со введением в кровь «Гепарина». Врождённая тромбофилия, возникающая из-за нехватки антитромбина III требует применения заместительной терапии: введение в кровь препаратов с антитромбином III через три часа после введения «Гепарина». Лечение лёгких форм тромбофилии осуществляется путём подкожного введения лиофилизированной плазмы и «Гепарина» по 4 раза в сутки. Неплохих результатов позволяет добиться внутривенное введение антитромбина ІІІ.
При тяжёлых формах заболевания применяют антикоагулянты прямого действия, которые комбинируют с фибринолитическими средствами. Такое лечение даёт особенно хорошие результаты при введении препарата на уровне поражённого сосуда.
Наши услуги в флебологии
Администрация АО «ЦЭЛТ» регулярно обновляет размещенный на сайте клиники прейскурант. Однако во избежание возможных недоразумений, просим вас уточнять стоимость услуг по телефону: +7 (495) 788 33 88