На чем основаны методы хроматографии и электрофореза используемые для изучения клетки
На чем основаны методы хроматографии и электрофореза используемые для изучения клетки
Подробное решение параграф §5 по биологии для учащихся 10 класса, авторов Теремов А.В., Петросова Р.А. Углубленный уровень 2017
Рассмотрите рис. 19, 21 — 23. На чем основаны методы изучения клеток? Сравните между собой изображения клеток на рис. 18, 20, полученные с помощью различных микроскопов.
Микроскопия. С помощью микроскопа изучают морфологию клетки.
Физико — химические методы. С помощью этих методов в цитологии изучают химический состав и жизнедеятельность клеток.
Метод меченых атомов основан на введении радиоактивного изотопа какого — либо химического элемента в состав вещества для того, чтобы проследить путь его превращений в клетке.
Метод центрифугирования, который позволяет очистить макромолекулы, выделенные из клетки, разделить органоиды клетки.
Методы разделения клеток и их культивирования. Для изучения живых клеток различных тканей их разделяют и выращивают на специальных питательных средах, при определённых условиях.
Метод рекомбинантных ДНК. Для изучения тонких механизмов процес — сов, протекающих в клетке, в том числе функций генов, ДНК «вырезают» из клетки.
1. Какие микроскопы вам известны? Опишите принцип их действия.
Световой – Пучок световых лучей, попадающий в микроскоп, вначале преобразуется в параллельный поток, после чего преломляется в окуляре. Затем информация об объекте исследования поступает в зрительный анализатор человека.
Электронный трансмиссивный – В трансмиссионном электронном микроскопе электроны проходят через объект, который для этого исследования должно быть достаточно тонким.
Электронный сканирующий – Исследуемый образец в условиях промышленного вакуума сканируется сфокусированным электронным пучком средних энергий.
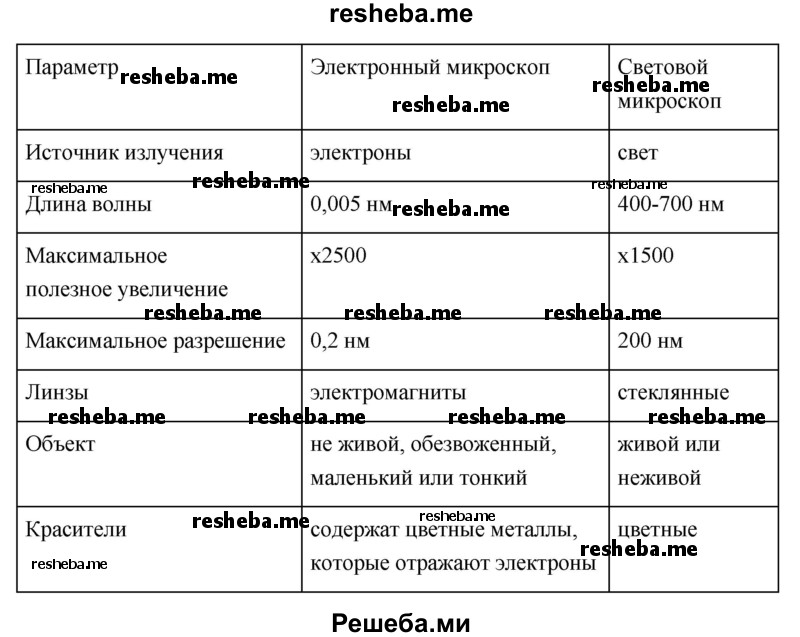
2. Сравните строение электронного и светового микроскопов (см. рис. 19). Что выполняет роль светового пучка в электронном микроскопе? Какой части светового микроскопа соответствуют проекционные линзы электронного микроскопа? В чем преимущества электронного микроскопа по сравнению со световым?
– В качестве источника электронов для создания электронного пучка, заменяющего световой пучок, служит трехэлектродная пушка, состоящая из катода, управляющего электрода и анода.
– В электронном микроскопе вместо оптических проекционных линз (окуляра), оптического конденсора, объектива светового микроскопа применяются специальные электростатические или электромагнитные проекционные линзы.
– Преимущества электронной микроскопии:
• высокая разрешающая способность электронного микроскопа позволяет наблюдать объекты, размеры которых лежат за пределами разрешающей способности светового микроскопа. Поэтому ЭМ применяется для изучения ультраструктур микроорганизмов и макромолекулярных структур;
• сочетание ЭМ с другими методами позволяет проводить электронно — радиоавтографические, электронно — гистохимические, электронно — иммунологические исследования. ЭМ нашла широкое применение в морфологии, микробиологии, вирусологии, иммунологии, генетике, биохимии, онкологии.
3. Что такое разрешающая способность оптического прибора? От чего она зависит?
Разрешающая способность (разрешающая сила) оптических приборов – величина, характеризующая способность этих приборов давать раздельное изображение двух близких друг к другу точек объекта. Разрешающая способность любого оптического прибора оценивается по его аппаратным функциям, отражающим все факторы, которые оказывают влияние на качество предоставляемого этим прибором изображения. К таким влияющим факторам, безусловно, следует в первую очередь отнести аберрацию и дифракцию – огибание световыми волнами препятствий и, как следствие, отклонение их от прямолинейного направления.
4. Чем обусловлено количество клеточных структур, выявленных с помощью микроскопа: степенью увеличения, создаваемого микроскопом, или разрешающей способностью оптического прибора? Ответ поясните.
Количество клеточных структур, выявленных с помощью микроскопа обусловлено разрешающей способностью оптического прибора, потому что с помощью нее можно рассмотреть ульраструктуру клетки.
5. На чем основаны методы хроматографии и электрофореза, используемые для изучения клетки? В чем их сходство? Каково их значение?
Хроматография основана на разной скорости движения через адсорбент растворённых в специальном растворе веществ. При пропускании такого раствора через адсорбент каждое вещество из смеси передвигается на определённое расстояние в зависимости от своей молекулярной массы. Адсорбентами могу быть волокна фильтровальной бумаги, порошок целлюлозы и другие пористые вещества. Близким к хроматографии является метод электрофореза в геле, где разделению смеси веществ в растворе способствует электрический ток. Методы хроматографии и электрофореза позволяют разделить смеси веществ, выделенные из клетки, определить их качественный и количественный состав.
6. Какими методами можно выделить органоиды клетки и изучить их строение? На каких свойствах основано фракционирование клеточных структур центрифугированием? Для ответа используйте рис. 23.
Методом центрифугирования, который позволяет очистить макромолекулы, выделенные из клетки, разделить органоиды клетки. Для этого специальными способами разрушают и измельчают клетку. Её содержимое распадается на отдельные фрагменты, при этом сохраняются целиком некоторые органоиды. Полученную смесь с помощью центрифуги разделяют на фракции, увеличивая каждый раз обороты центрифуги. Более тяжёлые клеточные фракции оседают на дно пробирки, более лёгкие собираются на её поверхности. Это даёт возможность изучать отдельно свойства и структуру каждого органоида или макромолекулы клетки.
7. Какое значение для цитологии имеет метод культуры клеток и тканей?
Применение методов культуры клеток и тканей позволяет изучать живые клетки под микроскопом, наблюдать за их ростом и размножением вне организма, выделять факторы роста, устанавливать влияние на них различных веществ, получать клеточные гибриды путём слияния целых клеток или их отдельных компонентов.
На чем основаны методы хроматографии и электрофореза используемые для изучения клетки
Выберите два верных ответа из пяти и запишите в таблицу цифры, под которыми они указаны. К биохимическим методам исследования относят:
К биохимическим методам исследования относят:
2) электрофорез и 4) рентгеноспектрофотометрию
Биохимический метод — основной метод в биохимии из основных методов диагностики различных заболеваний, которые вызывают нарушение обмена веществ. Объектами диагностики биохимического анализа являются: кровь; моча; пот и другие биологические жидкости; ткани; клетки. Биохимический метод исследования позволяет определять активность ферментов, содержание продуктов метаболизма в различных биологических жидкостях, а также выявлять нарушения в обмене веществ, которые обусловлены наследственным фактором.
В биохимии широко применяют диализ, центрифугирование, оптические методы, различные виды хроматографии и др.
Электрофорез — это электрокинетическое явление перемещения частиц дисперсной фазы (коллоидных или белковых растворов) в жидкой или газообразной среде под действием внешнего электрического поля. Электрофорез применяют в лечебных целях в физиотерапии.
Наиболее часто метод используют для аналитических целей – для разделения смеси заряженных веществ на фракции с последующим качественным и количественным их определением. Таким способом удается разделить, например, белки сыворотки крови на 5 фракций: альбумин и 4 фракции глобулинов. Эту задачу часто решают в клинической биохимии, так как соотношение фракций закономерно изменяется при многих патологических процессах.
Метод подразделяется на фронтальный или свободный электрофорез (электрофорез в жидкой среде) и зональный или электрофорез в поддерживающих средах.
Спектрофотометрический метод анализа.
Молекулы, имеющие одинаковую связь и образующие одну группу, в ИФ области выдают полосы поглощения соответствующей характеристической частоты. Данные характеристические частоты помогают определить по получаемому спектру имеющиеся в исследуемой взвеси наличие искомых групп атомов или молекул.
Делят спектрофотометрию: на молекулярную, когда искомое вещество молекулярная структура, и атомную.
Инбридинг — скрещивание близкородственных форм в пределах одной популяции организмов.
Гибридизация — процесс образования или получения гибридов, в основе которого лежит объединение генетического материала разных клеток в одной клетке.
Микроскопия – это научное исследование объектов при помощи микроскопа. Микроскопия может подразделяться на несколько подвидов: оптическую, многофотонную, рентгеновскую, лазерную и электронную. Цель этого способа исследования заключается в увеличенном наблюдении за объектом и регистрацией замеченных изменений.
На чем основаны методы хроматографии и электрофореза используемые для изучения клетки
«Биология отрицает законы математики: при делении происходит умножение» Валерий Красовский
Методы изучения клетки
Основными методами изучения клетки являются: микроскопия, центрифугирование (ультрацентрифугирование), культивирование клеток, метод рекомбинантных ДНК, метод меченных атомов, хроматография, электрофорез.
Также в цитологии используют:
Теоретический вопрос ДНЯ
Советы, которые помогут эффективно подготовиться к ЕГЭ по БИОЛОГИИ
1. Познакомься с актуальными демоверсией, спецификацией, кодификатором на официальном сайте, чтобы четко понимать, что тебя ждет и какие требования предъявляются к уровню подготовки.
2. Определись, сколько баллов ты хотел бы получить.
3. Составь расписание своих занятий и старайся максимально его соблюдать. Регулярность занятий очень важна.
4. Используй несколько источников для подготовки: школьные учебники, пособия для поступающих в ВУЗы, видео уроки и т.п.
5. Главное – понимание! Старайся разобраться в теме, а потом можно зазубрить некоторые понятия.
6. Учись внимательно читать и понимать задание.
7. Начинай с легкого и постепенно усложняй материал. Но не бойтесь сложных заданий, если хочешь высокий балл.
8. Постоянно повторяй пройденный материал, решай тесты, задачи и теоретические вопросы.
Повторять рекомендуется сразу в течение 15-20 минут, через 8-9 часов и через 24 часа. Полезно повторять материал за 15-20 минут до сна и утром, на свежую голову.
9. Систематизируй материал, создай целостную и структурированную систему знаний.
10. И не забывай высыпаться, сбалансированно питаться и вести здоровый образ жизни. Это хорошо влияет на память:)
Хроматография и электрофорез
Использование радиоактивных изотопов.
Использование клеток.
Даже клетки представляют собой очень сложно организованные системы. В них имеется ядро, а в окружающей его цитоплазме находятся более мелкие тельца, т.н. органеллы, различных размеров и консистенции. С помощью соответствующей методики ткань можно «гомогенизировать», а затем подвергнуть дифференциальному центрифугированию (разделению) и получить препараты, содержащие только митохондрии, только микросомы или прозрачную жидкость – цитоплазму. Эти препараты можно по отдельности инкубировать с тем соединением, метаболизм которого изучается, и таким путем установить, какие именно субклеточные структуры участвуют в его последовательных превращениях. Известны случаи, когда начальная реакция протекает в цитоплазме, ее продукт подвергается превращению в микросомах, а продукт этого превращения вступает в новую реакцию уже в митохондриях. Инкубация изучаемого вещества с живыми клетками или с гомогенатом ткани обычно не выявляет отдельные этапы его метаболизма, и только последовательные эксперименты, в которых для инкубации используются те или иные субклеточные структуры, позволяют понять всю цепочку событий.
Для изучения метаболизма какого-либо вещества необходимы: 1) соответствующие аналитические методы для определения этого вещества и его метаболитов; и 2) методы, позволяющие отличать добавленное вещество от того же вещества, уже присутствующего в данном биологическом препарате. Эти требования служили главным препятствием при изучении метаболизма до тех пор, пока не были открыты радиоактивные изотопы элементов и в первую очередь радиоактивный углерод 14C. С появлением соединений, «меченных» 14C, а также приборов для измерения слабой радиоактивности эти трудности были преодолены. Если к биологическому препарату, например к суспензии митохондрий, добавляют меченную 14C жирную кислоту, то никаких специальных анализов для определения продуктов ее превращений не требуется; чтобы оценить скорость ее использования, достаточно просто измерять радиоактивность последовательно получаемых митохондриальных фракций. Эта же методика позволяет легко отличать молекулы радиоактивной жирной кислоты, введенной экспериментатором, от молекул жирной кислоты, уже присутствовавших в митохондриях к началу эксперимента.
В дополнение к вышеупомянутым требованиям необходимы и методы, позволяющие разделять смеси, состоящие из малых количеств органических веществ. Важнейший из них – хроматография, в основе которой лежит феномен адсорбции. Разделение компонентов смеси проводят при этом либо на бумаге, либо путем адсорбции на сорбенте, которым заполняют колонки (длинные стеклянные трубки), с последующей постепенной элюцией (вымыванием) каждого из компонентов.
Разделение методом электрофореза зависит от знака и числа зарядов ионизированных молекул. Электрофорез проводят на бумаге или на каком-нибудь инертном (неактивном) носителе, таком, как крахмал, целлюлоза или каучук. Высокочувствительный и эффективный метод разделения – газовая хроматография. Им пользуются в тех случаях, когда подлежащие разделению вещества находятся в газообразном состоянии или могут быть в него переведены.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Электрофорез метод изучения клеток
Люминесцентная микроскопия.
Индукция с помощью ультрафиолетового света флуоресценции химических компонентов клетки (естественных или введенных извне).
Применяется для прижизненного выявления в клетке биохимических компонентов, способных к флуоресценции — витаминов, пигментов, гормонов, антибиотиков. Кроме того, с помощью синтетических флуорохромов, специфически взаимодействующих с определенными химическими компонентами клетки (ДНК, РНК, липидами и др.), исследуют их внутриклеточную локализацию.
Дифференциальное центрифугирование.
Центрифугирование смеси, полученной в результате разрушения клеток (ткани, органа), в специальных центрифугах при различных скоростях вращения ротора, что позволяет раздельно осаждать частицы с различной массой (ядра, оргаиеллы, макромолекулы). p>Применяется для получения чистых фракций различных субклеточных структур для последующего биохимического и биофизического исследований.
Электрофорез.
Движение заряженных частиц (макромолекул и др.), взвешенных в электролите, при наложении внешнего электрического поля; осуществляется в среде пористого наполнителя (хроматографическая бумага, гели); в зависимости от величины и знака заряда частиц они перемещаются к катоду или аноду и занимают совершенно определенное место (зону) (рис. 3.2).
Используется для разделения сложных смесей биополимеров — белков, нуклеиновых кислот и др.
Рентгеноструктурный анализ.
Основан на изучении дифракции, возникающей при взаимодействии рентгеновского излучения с кристаллическим образцом.
Рис. 3.2. Электрофореграмма смеси белков (каждому пятну соответствует определенная белковая фракция)
Применяется для исследования атомно-молекулярного строения биологических полимеров — пептидов, полисахаридов, нуклеиновых кислот.
5. Хроматография. Разделение смеси веществ за счет различий в их распределении в системе, состоящей из двух компонентов — подвижного (газовая или жидкая фаза) и неподвижного (твердая фаза или жидкость, связанная на инертном носителе).
Основные разновидности: жидкостная, газовая, тонкослойная хроматография.
Используется для разделения и анализа смесей веществ, а также изучения их физико-химических свойств (массы и размеров молекул и др.).
Метод электрофореза в молекулярной биологии
Принципы гель-электрофореза
Метод электрофореза в геле использует разницу в размере и заряде различных молекул в образце. Образец ДНК или белка, подлежащий разделению, погружают в пористый гель, помещенный в ионную буферную среду. При приложении электрического поля каждая молекула, имеющая разный размер и заряд, будет проходить через гель с разной скоростью.
Пористый гель, используемый в этой технике, действует как молекулярное сито, которое отделяет большие молекулы от более мелких. Меньшие молекулы движутся быстрее по гелю, а более крупные медленнее. Подвижность частиц также определется их индивидуальным электрическим зарядом. Два противоположно заряженных электрода, которые являются частью системы, тянут молекулы к себе на основе их заряда.
Как это работает?

Образцы, которые необходимо проанализировать, затем загружают в маленькие лунки в геле с помощью пипетки. По завершении загрузки применяется электрический ток 50-150 В. Теперь заряженные молекулы, присутствующие в образце, начинают мигрировать через гель к электродам. Отрицательно заряженные молекулы движутся к положительному электроду, а положительно заряженные молекулы мигрируют к отрицательному электроду.
Скорость, с которой каждая молекула перемещается через гель, называется ее электрофоретической подвижностью и определяется главным образом ее чистым зарядом и размером. Сильно заряженные молекулы движутся быстрее, чем слабо заряженные. Меньшие молекулы работают быстрее, оставляя более крупные. Таким образом, сильный заряд и малый размер увеличивают электрофоретическую подвижность молекулы, а слабый заряд и большие размеры уменьшают подвижность молекулы. Когда все молекулы в образце имеют одинаковый размер, разделение будет основываться исключительно на их размере.

После завершения разделения гель окрашивается красителем, чтобы выявить полосы разделения. Бромид этидия представляет собой флуоресцентный краситель, обычно используемый в гелевом электрофорезе. Гель вымачивают в разбавленном растворе бромида этидия и затем помещают на УФ-трансиллюминатор для визуализации разделительных полос.
Полосы сразу проверяются или фотографируются для дальнейшего использования, поскольку они будут диффундировать в гель с течением времени. Краситель также может быть загружен в гель заранее, чтобы отслеживать миграцию молекул, как это происходит.
Применение гель-электрофореза
Гель-электрофорез широко используется в лабораториях молекулярной биологии и биохимии в таких областях, как судебная медицина, консервативная биология и медицина.
Ниже перечислены некоторые ключевые применения технологии:
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте как обрабатываются ваши данные комментариев.
Двумерный электрофорез
Реактивы для горизонтального электрофореза: агарозы, маркеры длин фрагментов ДНК, красители интеркалирующие для визуализации НК, красители для нанесения образцов на гель, буферы для электрофореза нуклеиновых кислот.
Готовые полиакриламидные гели удобны в применении, разработаны под различное количество образцов (от 1 до 26 лунок) и адаптированы к различным по размеру электрофорезным камерам. Готовые стрипы для двумерного электрофореза доступны в широком спектре диапазонов pH, длиной от 7 до 24 см.
Для автоматического препаративного электрофореза — при отделении необходимого фрагмента автоматически — используются системы препаративного электрофореза для разделения и выделения ДНК/РНК/белков серии Pippin, производства Sage Science.
Другие типы электрофореза: вертикальный, горизонтальный, капиллярный, капиллярный на чипе.
Связанные понятия
Дот-блот — техника, используемая в молекулярной биологии для детекции различных макромолекул, таких как нуклеиновые кислоты или белки. Данная техника является некоторым упрощением вестерн-блота: образцы, содержащие исследуемые макромолекулы наносятся сразу на нитроцеллюлозную или PVDF-мембрану, минуя стадию предварительного электрофореза в ПААГ (в частности при работе с белками).
Тканевая матрица (ТМА, tissue microarray, тканевой мастер-блок, множественно-тканный парафиновый блок ) — в медицине, парафиновый блок-реципиент в который встроены множественные тканевые цилиндры, извлеченные из стандартных парафиновых блоков-доноров и организованные в виде упорядоченной последовательности (матрицы). ТМА позволяют сохранять и использовать ценные тканевые ресурсы более эффективно и экономично для гистохимического, иммуногистохимического (ИГХ) и молекулярного исследований.
MTT-тест — колориметрический тест для оценки метаболической активности клеток. НАДФ-H-зависимые клеточные оксидоредуктазные ферменты могут, при определенных условиях, отражать количество жизнеспособных клеток. Эти ферменты способны восстанавливать тетразолиевый краситель 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид в нерастворимый формазан, который имеет пурпурное окрашивание. Другие близкородственные тетразолиевые красители: XTT, MTS и WST, которые используются в связи с промежуточным.