На что распадается h2o
Такая разная вода: два жидких агрегатных состояния H2O
Основа исследования
Фундаментом для подобного рода исследований стало обнаружение расхождения изотермической сжимаемости и теплоемкости (CP) при переохлаждении воды. Ученые начали поиски объяснений этих странных процессов.
Одна из самых распространенных теорий утверждает, что существует переход жидкость-жидкость (LLT от liquid-liquid transition) в переохлажденной воде между жидкостью высокой плотности (HDL от high-density liquid) и жидкостью низкой плотности (LDL от low-density liquid), который заканчивается в критической точке жидкость-жидкость (LLCP от liquid-liquid critical point) при положительном давлении. Аномальное поведение воды в соответствии с этой теорией объясняется колебаниями, исходящими от LLCP.
Относительно недавно были проведены дополнительные опыты, в ходе которых было обнаружено, что структура переохлажденной воды непрерывно изменяется при охлаждении до 227 К под давлением 1 бар. Это указывает на однофазное поведение без LLT при атмосферном давлении. Следовательно, это подразумевает, что если LLT действительно существует, то LLCP должен находиться при давлении (P) > 1 бар.
Эксперименты по рассеянию нейтронов в воде позволили предположить, что различные фазы HDL и LDL могут быть идентифицированы по их четко определенным положениям пиков в структурном факторе (математическое описание того, как материал рассеивает падающее излучение).
В частности, положение первого пика в О–О рассеянии сильно чувствительно к существованию тетраэдрических структур (LDL) или межузельных молекул между первой и второй оболочками (HDL). Следовательно, наиболее подходящим способом обнаружения LLT в переохлажденной воде может быть отслеживание структуры жидкости с помощью рассеяния рентгеновских лучей или нейтронов. Основная сложность таких опытов заключается в том, что их нужно проводить при разном давлении и очень быстро, пока не произошла кристаллизация.
В данном труде был использован метод компрессии-декомпрессии, когда начальное повышение давления было вызвано нагревом, индуцированным лазерным импульсом. Когда временной масштаб индуцированного лазером высвобождения энергии намного короче, чем время прохождения звука через образец, нагрев является изохорным*, а давление внутри образца значительно возрастает.
Изопроцесс* — термодинамический процесс, когда количество вещества и какой-то параметр его состояния (давление, объем, температура или энтропия) остаются неизменными.
После окончания сверхбыстрого лазерного импульса образец быстро расширяется по мере того, как внутреннее давление уменьшается, приближаясь к значениям давления окружающей среды. Однако, если динамика жидкости достаточно быстрая, чтобы расслабить образец до наступления расширения, квазиравновесное поведение будет наблюдаться во время процесса декомпрессии.
Образцы изучались с помощью рассеяния рентгеновских лучей с разными временными задержками во время декомпрессии. В ходе наблюдений было выявлено резкое изменение структурного фактора, которое указывает на прерывистый LLT. Кроме того была обнаружена кристаллизация льда, происходящая значительно позднее. Это подтверждает, что LLT является метастабильным состоянием и отличается от перехода жидкость-лед.
Результаты исследования
Аморфный лед* получают посредством быстрого охлаждения воды, так что ее молекулы не успевают сформировать кристаллическую решетку (т.е. молекулы расположены случайным образом).

Изображение №1
Толщина выбранных для наблюдения образцов варьировалась либо от 35 до 55 мм, либо от 15 до 25 мм. На образец воздействовал инфракрасный импульс с длиной волны 2 мм в течение 100 фс. Импульс увеличивал температуру и возбуждал комбинацию O–H и H–O–H.
После активации ИК импульса началась самопроизвольная декомпрессия, во время которой температура оставалась примерно постоянной, пока через
100 мс охлаждение за счет теплопроводности не стало существенным.
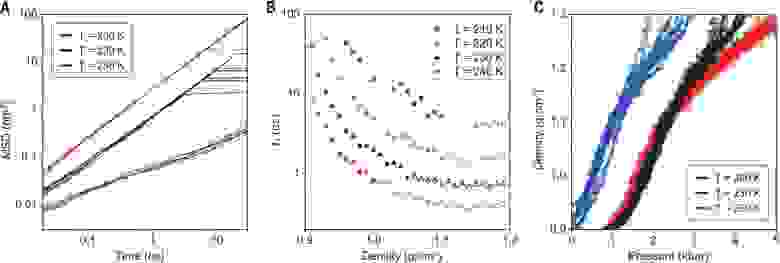
На графике 2В показаны временные задержки для образцов толщиной от 15 до 25 мм, где степень преобразования HDL в LDL была выше, чем у образцов с большей толщиной. Спустя 1 мс соотношение двух компонентов составляет почти 1:1. Это, вероятнее всего, связано с тем, что в более тонких образцах процесс нагрева протекает более равномерно. В более толстых образцах ИК излучение поглощается больше на передней поверхности, чем на задней, что приводит к большему градиенту температур. Две наблюдаемые взаимопревращающие фазы имеют q-положения вблизи HDL и LDL, как и было предсказано на основе экстраполяции данных по зависящему от температуры и давления рассеянию нейтронов водой при более высоких температурах.
Сценарии, показанные на 1D—1F, могут быть только в том случае, если образец после ИК импульса был жидкостью, а не аморфным твердым телом, и оставался жидким во время процесса декомпрессии.
Сразу после ИК импульса образец перемещался в точку на фазовой диаграмме, лежащую выше температуры гомогенного образования льда (TH), что соответствует быстрой жидкоподобной диффузии. В этой области вода была метастабильной жидкостью в течение нескольких минут, прежде чем превратилась в кристаллические фазы льда.
Чтобы понять, как сразу после нагрева HDA ИК импульсом возникает жидкоподобная диффузия, ученые метод классической молекулярной динамики для модели воды ST2 (исследование по данной теме доступно по ссылке: Improved simulation of liquid water by molecular dynamics).
Наблюдаемое температурное смещение в 25 К означает, что экспериментальная температура 205 К соответствует
230 К для ST2 воды.
Изображение №3
На 3А показано среднеквадратичное смещение (MSD) молекул ST2 как функция времени после быстрого нагревания (при 3000 К/нс) образца HDA. Начиная с 80 К, HDA нагревали до одной из трех различных конечных температур в диапазоне от 200 до 250 К. Если бы была задержка для перехода образца в жидкое состояние, то среднеквадратичное смещение было бы изначально постоянным, а затем линейно увеличивался бы после задержки.
В ходе моделирования системы было обнаружено, что среднеквадратичное смещение увеличивается со временем линейно, как и ожидалось для диффундирующей жидкости. Из этих результатов следует, что в течение 20 пс после быстрого нагрева HDA в системе образуется жидкое состояние. Этот процесс был намного быстрее, чем частичное таяние льда фазы Ih посредством ИК импульса, которое длилось
Тем не менее травление кристаллов, т.е. переход между фазами со значимыми отличиями в структурах до и после, является процессом, требующим активации (т.е. преодоления барьера свободной энергии).
Используемые в опытах образцы льда выдерживали от 0.5 до 5 часов при температуре 115 К, потому они еще до нагрева находились в ультравязком жидком состоянии. Образцы не столкнулись с барьером свободной энергии при нагревании от 115 до 205 К. Это согласуется с тем, что HDA и HDL структурно тесно связаны, и в результате начало быстрой диффузии было моментальным.
Эксперименты и моделирование показали, что жидкостное равновесие системы при 205 К в LDL образовывалось за время в 50-100 раз большее, чем для HDL. Следовательно, если есть возможность достичь жидкостного равновесия в течение нескольких наносекунд, то этого же можно достичь и в течении сотен наносекунд. Если это так, то отдельные фазы с высокой и низкой плотностью, наблюдаемые в субмикросекундном временном масштабе, можно воспринимать как квазиравновесные жидкие фазы.
При учете сценариев, показанных на 1С—1Е, должно происходить быстрое преобразование в лед или непрерывное преобразование жидкого состояния. Однако этого не происходило. Образование кристаллического льда могло бы происходить в масштабах времени, более чем на один порядок превышающих преобразование в LDL. Из этого следует, что экспериментальные данные могут быть количественно согласованы только со сценарием, показанным на 1F.

Изображение №4
Дабы лучше понять, как происходит образование LLT, были проанализированы отличия в рассеянии для образцов разной толщины (от 35 до 55 мм). Это позволило оценить фракционную заселенность каждой фазы в образце как функцию временной задержки (4A).
На 16.8 нс наблюдается лишь небольшая доля LDL, которая достигала максимума (
40% от общей интенсивности рассеяния) спустя 3 мс. Этот процесс сопровождается соответствующим уменьшением доли HDL. На временной отметке в 3 мс появляется кристаллический лед, который в последствии преобладает по всей системе. Образование льда происходило во временном масштабе, более чем на один порядок превышающем переход от HDL к LDL. Это указывает на то, что LLT, хоть и является метастабильным фазовый переход, он все же отличается от перехода жидкость-лед.
Из-за динамического характера процесса декомпрессии ожидалось, что преобразование HDL в LDL будет происходить в области на графике между линией HDL-LDL сопряжения и пределом метастабильности фазы HDL. В этой области переход должен проявляться в короткие промежутки времени в виде локализованных LDL флуктуаций, за которыми следует зарождение и рост LDL доменов. На 4В (график малоуглового рентгеновского рассеяния, SAXS) отчетливо видны небольшие флуктуации LDL.
Полное преобразование образца в LDL было прервано процессом образования льда. Однако для тонких образцов соотношение HDL:LDL достигало значения 1:1 за 1 мс до появления льда (2В).
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В данном труде ученые установили наличие второго жидкого состояния для воды, возникающего при 205 К. Результаты экспериментов показали, что переход жидкость-жидкость (LLT) происходит в условиях (давление и температура), при которых обычно происходит только кристаллизация.
Кроме того, наблюдаемый для LLT временной масштаб (от наносекунд до микросекунд), согласуется с предыдущей экспериментальной оценкой, основанной на экстраполяциях от 10 мс при 174 К до наносекунд и микросекунд при 220 К с использованием температурно-зависимых кинетических измерений.
Ученые отмечают, что ранее подобных наблюдений не было ввиду отсутствия соответствующего оборудования. В современных лабораториях есть возможность проводить рентгеновские исследования процессов, которые протекают молниеносно. В добавок к этому существует множество методик моделирования, позволяющих предугадать ход исследуемых процессов до фактических наблюдений. Фактор скорости крайне важен, когда речь идет об исследовании воды в момент ее преобразования в лед. За счет «быстрых» рентгеновских лучей ученым удалось наблюдать процесс преобразования одной жидкости в другую, что предшествует образованию льда. Следовательно, при определенных условиях вода из жидкого состояния переходит в другое жидкое состояние.
Результаты этого колоссального труда открывают новые возможности перед исследователями воды, позволяя разрешить многолетние споры вокруг живительной жидкости и ее необычных свойств.
В будущем ученые намерены провести дополнительные исследования своего открытия, поскольку остается еще немало вопросов касательно свойств второго жидкого состояния воды и его важности в процессах, протекающих на планете. По некоторым предположениям наличие двух жидких фаз воды может каким-то образом быть связано с биологическими процессами в живых клетках.
Благодарю за внимание, оставайтесь любопытствующими и хорошей всем рабочей недели, ребята. 🙂
Немного рекламы
Оксид водорода
Оксид водорода
| Вода | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид водорода |
| Традиционные названия | вода |
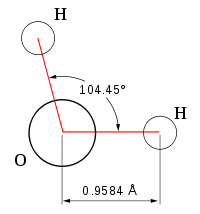
| Химическая формула | Н2O |
| Молярная масса | 18,01528 г/моль |
| Физические свойства | |
| Плотность вещества | 0,9982 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Динамическая вязкость (ст. усл.) | 0,00101 Па·с (при 20 °C) |
| Кинематическая вязкость (ст. усл.) | 0,01012 см²/с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 0 °C |
| Температура кипения | 99,974 °C |
| Тройная точка | 0,01 °C, 611,73 Па |
| Критическая точка | 374 °C, 22,064 MПа |
| Молярная теплоёмкость (ст. усл.) | 75,37 Дж/(моль·К) |
| Теплопроводность (ст. усл.) | 0,56 Вт/(м·K) |
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. 71 % поверхности Земли покрыто водой (океаны, моря, озера, реки).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Содержание
Физические и химические свойства
Физические свойства
Вода обладает рядом необычных особенностей:
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а так же того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект слабее, чем обычное тепловое расширение; при испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. [2] Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чем основан принцип действия микроволновой печи.
Агрегатные состояния
При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C. При снижении давления температура плавления воды медленно растёт, а температура кипения — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находится в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Изотопные модификации воды
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды: Лёгкая вода (просто вода), Тяжёлая вода (дейтериевая) и Сверхтяжёлая вода(тритиевая).
Химические свойства
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH-). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ ок. 16.
Сама по себе вода относительно инертна в обычных условиях, но её сильно полярные молекулы сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Вода в природе
Атмосферные осадки
Осадки согласно направлению
| «Вертикальные» осадки | «Горизонтальные» осадки | Свободно-парящие структуры |
|---|---|---|
| Дождь | Роса | Облака |
| Дождь со снегом | Иней | Туман |
| Изморось | Атмосферное оледенение | Морская пена |
| Переохлаждённая морось | Гололёд | |
| Снег | ||
| Снежная крупа | ||
| Снежные зерна | ||
| Ледяная крупа | ||
| Ледяной дождь | ||
| Град | ||
| Ледяные кристаллы |
Осадки согласно состоянию
| Жидкие осадки | Твёрдые осадки |
|---|---|
| Дождь | Снег |
| Дождь со снегом | Снежная крупа |
| Изморось | Снежные зерна |
| Переохлаждённая морось | Ледяная крупа |
| Роса | Ледяной дождь |
| Град | |
| Ледяные кристаллы | |
| Иней | |
| Атмосферное оледенение | |
| Гололёд |
Виды воды
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и в свою очередь приобретать самые разные формы, которые зачастую соседствуют друг с другом. Водный пар и облака в небе, морская вода и айсберги, горные ледники и горные же реки, водоносные слои в земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни» её нередко подразделяют на типы.
Характеристики вод
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
Исследования воды
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Биологическая роль
Вода играет уникальную роль, как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Применение
Земледелие
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90% в некоторых странах.
Питьё и приготовление пищи
Живое человеческое тело содержит от 55% до 78% воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. Для нормального функционирования организма человеку нужно усвоить от 1 до 7 литров воды за день в зависимости от температуры и влажности окружающей среды, физической активности и пр.
Растворитель
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель
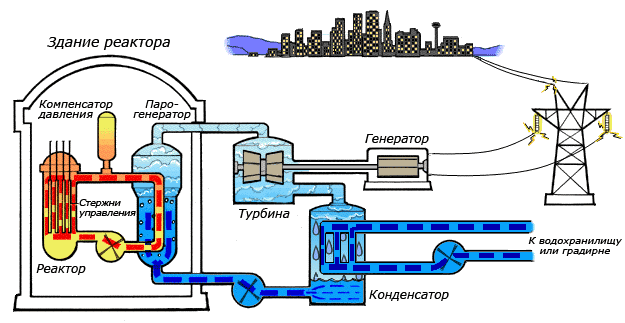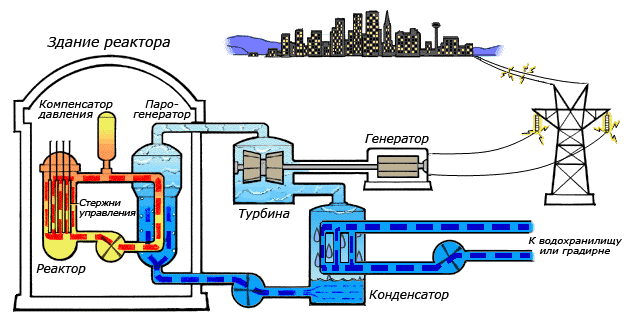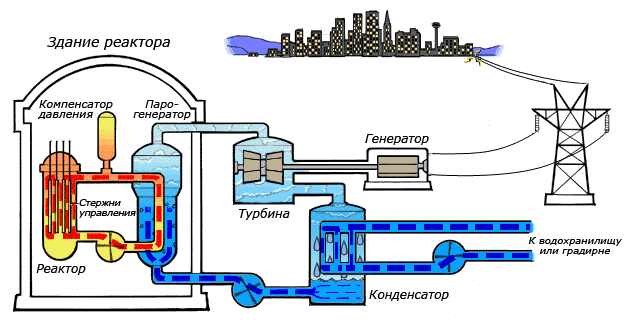
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Пожаротушение
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции от огня в составе пены.
Спорт
Многие вида спорта проходят на водных поверхностях, на льду, на снегу и даже в воде. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и пр.
Инструмент
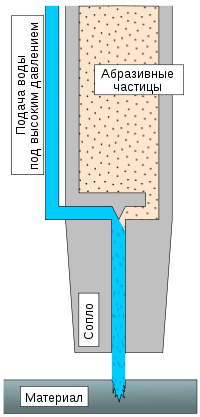
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.