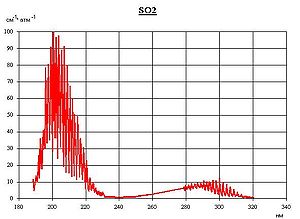
На что распадается so2
Сернистая кислота: строение и химические свойства
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.
Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
HSO3 – ↔ SO3 2– + H +
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
3. Сернистая кислота взаимодействует с сильными основаниями и их оксидами.
4. Наиболее ярко выражены восстановительные свойства сернистой кислоты. При взаимодействии с окислителями степень окисления серы повышается.
Азотная кислота очень легко окисляет сернистую:
Озон также окисляет сернистую кислоту:
Качественная реакция на сернистую кислоту – обесцвечивание раствора перманганата калия:
5. В присутствии сильных восстановителей сернистая кислота может проявлять окислительные свойства.
Взаимодействие с основными оксидами и щелочами
SO2 + СаО = CaSO3 сульфит кальция
SO2 + NaOH = NaHSO3 гидросульфит натрия
Диоксид серы окисляется в газовой фазе до SO3:
На свету легко окисляется хлором:
В водных растворах при окислении SO2 образуется серная кислота H2SO4:
Продуктом восстановления SO2 чаще всего является свободная сера.
В свободном состоянии не выделена. Очень непрочное соединение. Образуется при растворении SO2 в воде. Обладает свойствами слабой кислоты.
Сульфиты и гидросульфиты
Сульфиты щелочных Me и аммония растворимы в воде. Сульфиты остальных Me нерастворимы в воде (или не существуют).
Гидросульфиты Me хорошо растворимы в Н2O, некоторые из них существуют только в растворе, например, Ca(HSO3)2.
Гидролиз сульфитов
Водные растворы сульфитов вследствие гидролиза имеют щелочную среду (окрашивают лакмус в синий цвет).
Химические свойства сульфитов
I. Не окислительно-восстановительные реакции
1. Взаимодействие с сильными кислотами:
Оба типа солей разлагаются сильными кислотами, при этом слабая сернистая кислота вытесняется в виде SO2 и Н2O.
2. Термическое разложение сульфитов:
3. Нормальные сульфиты в водных растворах, содержащих избыток SO2, превращаются в гидросульфиты
Благодаря этой реакции нерастворимые в воде сульфиты превращаются в растворимые гидросульфиты
4. Ионно-обменные реакции с другими солями, приводящие к образованию нерастворимых сульфитов:
II. Окислительно-восстановительные реакции
I. Сульфиты как восстановители.
Сульфиты, подобно SO2, могут быть и восстановителями, и окислителями, поскольку атомы серы в анионах SO3 находятся в промежуточной С.О. +4
В водных растворах и сульфиты, и гидросульфиты легко окисляются до сульфатов. Примеры реакций:
Даже твердые сульфиты при хранении на воздухе медленно окисляются до сульфатов:
II. Сульфиты как окислители.
Эти реакции не столь многочисленны. При нагревании сухих сульфитов с такими активными восстановителями, как С, Mg, Al, Zn, они переходят в сульфиды:
III. Диспропорционирование сухих сульфитов.
При нагревании до высоких температур сульфиты медленно превращаются в смесь сульфатов и сульфидов:
Диоксид серы
Диоксид серы
| Оксид серы(IV) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы(IV) |
| Химическая формула | SO2 |
| Отн. молек. масса | 64.054 а. е. м. |
| Молярная масса | 64.054 г/моль |
| Физические свойства | |
| Плотность вещества | 2,927 г/л г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −75,5 °C |
| Температура кипения | −10,01 °C |
| Химические свойства | |
| Растворимость в воде | 11,5 г/100 мл |
| Классификация | |
| номер CAS | [7446-09-5] |
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
Содержание
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
Химические свойства
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
Со щелочами образует сульфиты:
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
Последняя реакция является качественной реакцией на сульфит-ион SO3 2- и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
Или для получения фосфорноватистой кислоты:
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие
SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Полезное
Смотреть что такое «Диоксид серы» в других словарях:
ДИОКСИД СЕРЫ — (Д.с.) SO2, бесцветный газ с резким запахом, один из главных загрязнителей атмосферы. Д.с. образуется при сжигании ископаемого топлива на предприятиях топливно энергетического комплекса и в двигателях внутреннего сгорания, а также на предприятиях … Экологический словарь
диоксид серы — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN sulphur dioxide Emissions of the gas given off during the burning of fossil fuels in power stations and other boilers. Sulphur dioxide is created because sulphur is an impurity … Справочник технического переводчика
Диоксид серы — см. Сернистый ангидрид … Российская энциклопедия по охране труда
с повышенной спосбностью абсорбировать диоксид серы из дымовых газов ТЭС — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN Energy and Environmental Research Corporation … Справочник технического переводчика
Диоксид селена — Диоксид селена … Википедия
Диоксид титана — Порошок оксида титана Оксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана… … Википедия
серы диоксид — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
серы двуокись — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
серы(IV) оксид — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
Урок №14. Серный ангидрид и серная кислота
Повторите темы уроков 9 класса:
Оксид серы (VI)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость, «дымит» на воздухе, поглощая пары воды.
Способы получения
Оксид серы (VI) получают в реакциях окисления:
SO 2 + NO 2 = SO 3 + NO
Разложением сульфата железа (III):
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
2. Серный ангидрид – типичным кислотный оксид, взаимодействует с щелочами и основными оксидами.
SO 3 + 2NaOH ( избыток) = Na 2 SO 4 + H 2 O
SO 3 + NaOH ( избыток) = NaHSO 4
SO 3 + MgO = t = MgSO 4
3. Серный ангидрид – очень сильный окислитель:
SO 3 + 2KI = I 2 + K 2 SO 3
3SO 3 + H 2 S = 4SO 2 + H 2 O
5SO 3 + 2P = P 2 O 5 + 5SO 2
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO 3 в H 2 SO 4
РЕАКЦИИ СЕРНОЙ КИСЛОТЫ
Химические свойства разбавленной серной кислоты
1) Диссоциация протекает ступенчато:
(первая ступень, образуется гидросульфат – ион)
(вторая ступень, образуется сульфат – ион)
2) Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn 0 + H 2 +1 SO 4 (разб) → Zn +2 SO 4 + H 2 0 ↑
Zn 0 + 2H + → Zn 2+ + H 2 0 ↑
3) Взаимодействие с основными и амфотерными оксидами:
CuO + H 2 SO 4 → CuSO 4 + H 2 O
CuO + 2H + → Cu 2+ + H 2 O
4) Взаимодействие с основаниями:
H 2 SO 4 + 2NaOH → Na 2 SO 4 + 2H 2 O
Если кислота в избытке, то образуется кислая соль:
H 2 SO 4 + NaOH → NaНSO 4 + H 2 O
H 2 SO 4 + Cu(OH) 2 → CuSO 4 + 2H 2 O
2H + + Cu(OH) 2 → Cu 2+ + 2H 2 O
5) Обменные реакции с солями:
Серная кислота – сильная нелетучая кислота, вытесняет из солей другие менее сильные кислоты:
MgCO 3 + H 2 SO 4 → MgSO 4 + H 2 O + CO 2 ↑
MgCO 3 + 2H + → Mg 2+ + H 2 O + CO 2 ↑
Н 2 SO 4 + 2NaHCO 3 = Na 2 SO 4 + CO 2 ↑ + H 2 O
H 2 SO 4 + Na 2 SiO 3 = Na 2 SO 4 + H 2 SiO 3 ↓
Качественная реакция на сульфат-ион
BaCl 2 + H 2 SO 4 → BaSO 4 ↓ + 2HCl
Ba 2+ + SO 4 2- → BaSO 4 ↓
Образование белого осадка BaSO 4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
6) Реагирует с аммиаком
Химические свойства концентрированной серной кислоты
1. С водой образуются гидраты:
H 2 SO 4 + nH 2 O = H 2 SO 4 ·nH 2 O + Q
Органические вещества обугливаются!
2H 2 SO 4 + C = CO 2 + 2SO 2 + 2H 2 O
2. Серная кислота окисляет неметаллы
неМе + H 2 SO 4 (конц.) = H 2 O + SO 2 + Кислотный гидроксид
, где степень окисления неметалла – высшая
C + 2H 2 SO 4 = 2H 2 O + CO 2 + 2SO 2
S + 2H 2 SO 4 = 3SO 2 + 2H 2 O
2P + 5H 2 SO 4 = 2H 3 PO 4 + 5SO 2 + 2H 2 O
3. Взаимодействие серной кислоты с металлами
H 2 SO 4 (конц.) + Me = t = соль + H 2 O + Х
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании образуется газа SO 2 :
6H 2 SO 4 (конц.) + 2Fe = t = Fe 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
6H 2 SO 4(конц.) + 2Al = t = Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H 2 SO 4 (конц.) + Cu = CuSO 4 + SO 2 ↑ + 2H 2 O
2H 2 SO 4 (конц.) + Hg = HgSO 4 + SO 2 ↑ + 2H 2 O
2H 2 SO 4 (конц.) + 2Ag = Ag 2 SO 4 + SO 2 ↑ + 2H 2 O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg + 4H 2 SO 4 = 3MgSO 4 + S + 4H 2 O
При взаимодействии со щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H 2 SO 4 (конц.) + 4Zn = 4ZnSO 4 + H 2 S↑ + 4H 2 O
4. Взаимодействие с восстановителями
Концентрированная серная кислота окисляет галогеноводороды и сероводород при комнатной температуре:
3H 2 SO 4 (конц.) + 2KBr = Br 2 ↓ + SO 2 ↑ + 2KHSO 4 + 2H 2 O
5H 2 SO 4 (конц.) + 8KI = 4I 2 ↓ + H 2 S↑ + K 2 SO 4 + 4H 2 O
H 2 SO 4 (конц.) + 3H 2 S = 4S↓ + 4H 2 O
СОЛИ СЕРНОЙ КИСЛОТЫ
1) Разложение сульфатов
Термически устойчивые сульфаты – сульфаты щелочных металлов (в том числе лития), они плавятся не разлагаясь
Остальные сульфаты при нагревании разлагаются на оксид серы(IV), оксид металла и кислород:
2CuSO 4 = t = 2CuO + SO 2 + O 2 (SO 3 )
2Al 2 (SO 4 ) 3 = t = 2Al 2 O 3 + 6SO 2 + 3O 2
2ZnSO 4 = t = 2ZnO + SO 2 + O 2
2Cr 2 (SO 4 ) 3 = t = 2Cr 2 O 3 + 6SO 2 + 3O 2
4FeSO 4 = t = 2Fe 2 O 3 + 4SO 2 + O 2
Так как оксиды тяжёлых и благородных металлов разлагаются сами, разложение их сульфатов следует записывать до металла:
Ag 2 SO 4 = t = 2Ag + SO 2 + O 2
HgSO 4 = t = Hg + SO 2 + O 2
2) Сульфаты проявляют окислительные свойства и могут взаимодействовать с восстановителями, восстанавливаясь до сульфидов.
CaSO 4 + 4C = CaS + 4CO
3) Многие средние сульфаты образуют устойчивые кристаллогидраты
Na 2 SO 4 ∙ 10H 2 O − глауберова соль
CaSO 4 ∙ 2H 2 O − гипс
CuSO 4 ∙ 5H 2 O − медный купорос
FeSO 4 ∙ 7H 2 O − железный купорос
ZnSO 4 ∙ 7H 2 O − цинковый купорос
Na 2 CO 3 ∙ 10H 2 O − кристаллическая сода
Сернистый газ, сернистая кислота
Сернистый газ SO2 и сернистая кислота H2SO3 образуются атомом серы в степени окисления +4. Сернистый газ SO2 растворяясь в воде, образует кислоту, которая является слабой и неустойчивой. При образовании сернистая кислота H2SO3 распадается на газ и воду.
Поэтому эта реакция является обратимой.
Сернистый газ SO2 является токсичным веществом, вызывающий кашель и першение в горле. При более высоких концентрациях газ вызывает удушье и оттек легких. К примеру, сернистый газ является основным компонентов вулканических газов, которые являются наиболее опасными.
Бесцветный газ с характерным резким запахом (запах загорающейся спички).
Молекула с ковалентно-полярными связями, хорошо растворяется в воде.
Так как молекула неустойчива, она может существовать только в разбавленном растворе. Слабая кислота. На данное время в свободном состоянии не выделена.
ПРОМЫШЛЕННЫЙ СПОСОБ
Сжигание пирита (дисульфида железа):
Способ является экономически выгодным, так как FeO затем отправляется на обработку для получения чистого железа.
ЛАБОРАТОРНЫЙ СПОСОБ
Взаимодействие сульфита с более сильной кислотой:
(образуется сернистая кислота, которая является неустойчивой)
КИСЛОТНЫЙ ОКСИД
1. Взаимодействие с водой:
2. Взаимодействие с щелочами:
При избытке кислоты образуются кислые соли гидросульфиты:
ВОССТАНОВИТЕЛЬ
2SO2 + O2 = 2SO3 (Кислород O2 окисляет до наивысшей степени окисления серы +6)
Качественная реакция на сульфит-анионы SO3 2- :
При добавлении на сульфат более сильную кислоту образуется бесцветный газ с резким запахом.
В результате химического производства ( к примеру, серной кислоты) одним из отходов может стать сернистый газ SO2. Попадая в атмосферу, газ постепенно окисляется кислородом воздуха до оксида серы (VI), который растворяется в парах воды.
Образованная серная кислота вместе с дождем выпадает на поверхность земли. Конечно, ее концентрация не велика. Но ее хватает, чтобы оказать влияние на флору и фауну: гибель лесов, урожаев и растительности, а также разрушение зданий и памятников культуры, трубопроводов, понижается плодородие почвы.
Серьёзное загрязнение воздуха произошло в Лондоне в декабре 1952 года. Антициклон, принёсший холодную, безветренную погоду и загрязняющие вещества — в основном уголь — собрались над городом, образовав толстый слой смога. Это продолжалось около 5 дней.
В последующие недели количество смертей среди младенцев, престарелых и страдающих респираторными заболеваниями достигло четырёх тысяч человек; более 100 тысяч человек заболели.
Послевоенный британский уголь был, как правило, не очень качественным, содержащим серу, что увеличивало содержание сернистого газа в дыму. S + O2 = SO2