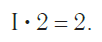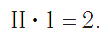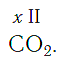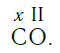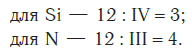На что влияет валентность в химии
Валентность
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.
Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):
Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
Большинство элементов характеризуются высшей, низшей или промежуточной валентностью в соединениях.
Для большинства элементов высшая валентность, как правило, равна номеру группы, низшая валентность определяется по формуле: 8 — № группы. Промежуточная валентность – это число между низшей и высшей валентностями.
Обратите внимание! Степень окисления и валентность — это не одно и то же. Хотя иногда степени окисления совпадают с валентностями. Стпень окисления — это условный заряд атома, он может быть и положительным и отрицательным. А вот образовать отрицательное число связей атом никак не может.
| Элемент | Валентность |
| Фтор F | I |
| Кислород О | II |
| Металлы IA группы (Li, Na, K, Rb, Cs, Fr) | I |
| Металлы IIA группы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| Алюминий Al | III |
Как определить валентность атома в соединении?
Рассмотрим валентные возможности атомов второго периода. В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
Следовательно, литий может образовывать одну связь и валентность лития I.
+4Be * 1s 2 

Таким образом, на внешнем э нергетическом уровне бериллия в возбужденном энергетическом состоянии есть 2 неспаренных электрона и две вакантные электронные орбитали. Следовательно, бериллий может образовать 2 связи по обменному механизму, т.е. валентность бериллия равна номеру группы и равна II.
Электронная конфигурация атома бора в основном состоянии +5B 1s 2 2s 2 2p 1 :
+5B 1s 2 

+5B 1s 2 

Следовательно, бор может образовывать 3 связи по обменному механизму (за счет неспаренных электронов). Валентность бора в соединениях — III.
Однако, при этом у бора остается еще одна вакантная электронная орбиталь. Следовательно, бор может выступать, как акцептор электронной пары.
За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность азота в соединениях — IV. На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
Валентные возможности атомов
Атомы химических элементов и их валентные возможности
В начале прошлого века научная общественность была потрясена открытием британского физика Э. Резерфорда, который в своем докладе «Рассеяние α- и β-лучей и строение атома» говорил об открытии атомного ядра.
Данное открытие в тандеме со знанием о электронах сместило главенствующую тогда теорию о валентности, заменив ее на теорию о химических связях.
Однако понятие о валентности не пропало из научного мира. Вклад в научное развитие этого термина внесли Э. Франкленд, Ф. А. Кекуле и А. М. Бутлеров.
Согласно проделанным открытиям, атомы химических элементов состоят из:
Свойства атомов химических элементов определяет количество электронов на их последнем (внешнем) электронном слое. Именно они участвуют в образовании химических связей разных типов. Такие электроны называются валентными.
Валентность — количество связей образованных атомом при участии его валентных электронов.
Для определения валентных возможностей атома необходимо рассмотреть распределение электронов на его энергетических уровнях.
Только атомы образовавшие химические связи могут характеризоваться понятием валентности.
Валентность обозначают римскими цифрами от I до VIII.
Число валентных электронов или число общих электронных пар определяет валентность.
Понятие валентности сопряжено со степенью окисления и часто совпадает с его значением.
Чем определяются, какие факторы влияют
Валентность атома определяется количеством валентных электронов:
Атомы могут иметь основное и возбужденное состояние, из-за чего большинство химических элементов имеют переменную валентность.
В основном состоянии валентность зависит от неспаренных электронов последнего (иногда и предпоследнего) энергетических уровней. Обычное состояние фиксируется в Периодической таблице Менделеева.
Например, валентность углерода в основном состоянии равна II из-за двух неспаренных электронов на 2p-орбитали.
Дополнительная энергия, которую может получать атом, приводит его в возбужденное состояние. В таком случае уже соединенные электроны могут распариваться и участвовать в образовании новых связей. Валентность повышается.
Валентность углерода в возбужденном состоянии может повышаться до четырех, так как в таком состоянии у него распариваются 2s-электроны.
В формуле возбужденное состояние атома обозначается звездочкой.
Определение валентности элемента по электронно-графическим формулам
Для определения количества электронов на энергетических уровнях необходимо полагаться на номер и место химического элемента в Периодической системе Д. И. Менделеева.
Определив количество электронов, необходимо распределить их по свободным орбиталям в порядке заполнения по шкале энергии:
В одной ячейке или на одной орбитали могут располагаться либо 1 электрон, либо 2 электрона с противоположными спинами — разными направлениями вращения.
Орбитали разных уровней могу размещать в своих свободных ячейках разное количество электронов:
По количеству электронов, оставшихся неспаренными в ячейках, можно узнать валентность атомов химических элементов. Электронные формулы обычно записываются не полностью, а в кратком варианте, указывая только крайние электронные уровни каждого слоя.
Можно сформулировать следующие закономерности электронного строения атома:
Селен, углерод, фосфор, сера, азот, хлор и другие примеры
Рассмотрим заполнение электронных уровней на примерах.
Углерод С обладает номером 6 в Периодической системе химических элементов Д. И. Менделеева, соответственно, он обладает 6 электронами.
Они полностью заполняют уровни 1s / 2s и частично уровень 2р. В обычном состоянии углерод обладает валентностью II. Свободная орбиталь 2р подуровня позволяет орбитали 2s распариваться. Тогда валентность углерода может изменяться на IV.
Азот N обладает номером 7 в ПСХЭ Менделеева и 7 электронами.
Они полностью занимают уровни 1s / 2s и частично 2р. В обычном состоянии азот обладает валентностью III. Перейти в возбужденное состояние путем распаривания 2s-электронов атом не способен, так как относится ко второму периоду, а на втором энергетическом уровне больше нет свободных подуровней и орбиталей, способных принять распарившиеся электроны. Максимальная валентность азота равна IV (за счет образования связи, не только по обменному, но и по донорно-акцепторному механизму), валентность V — не достигается.
Особенностью азота является несоответствие его валентности номеру группы ПС. Азот не обладает валентностью равной V, однако обладает соответствующей степенью окисления +5. НЕсоответствие значений валентностей и степеней окисления атомов азота в некоторых его соединениях является еще одной особенностью этого элемента.
Кислород О обладает номером 8 в ПСХЭ Менделеева и 8 электронами. Возбужденного состояния у кислорода так же нет.
Электроны полностью занимают уровни 1s / 2s и частично 2р. Валентность кислорода равна II — постоянная валентность.
Фтор F обладает номером 9 в ПСХЭ Менделеева и 9 электронами. Они полностью занимают уровни 1s / 2s и частично 2р. Фтор обладает только валентностью I, которая не меняется.
Алюминий Al обладает номером 13 в ПСХЭ Менделеева и 13 электронами. Они полностью занимают уровни 1s / 2s, 2p / 3s и частично уровень 3р. Несмотря на электронную конфигурацию основного (стационарного) состояния атома, валентность I практически не встречается. У алюминия постоянная валентность III (из этого следует что энергия перехода в возбужденное состояние для этого элемента не высока и атомы алюминия всегда пребывают именно в возбужденном состояние).
Фосфор P обладает номером 15 в ПСХЭ Менделеева и 15 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s и частично уровень 3р. В обычном состоянии фосфор обладает валентностью III. Распаривание 3s электронов создает возбужденное состояние, в котором пять валентных электронов занимают 5 ячеек, и валентность в таком случае поднимается до V.
Сера S занимает 16 место в ПСХЭ Менделеева и обладает 16 электронами.
Они полностью занимают 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии сера обладает валентностью II. Распаренные электроны могут занимать ячейки подуровня 3d, валентность поднимается до IV и VI.
Хлор Cl обладает номером 17 в ПСХЭ Менделеева и 17 электронами.
Они полностью занимают уровни 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии валентность хлора равна I. В возбужденном состоянии хлор может повышать свою валентность до III, V или VII. Формально данный ХЭ может обладать валентностью IV и VI.
Селен Se обладает номер 34 в ПСХЭ Менделеева, соответственно, он обладает 34 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s, 3p / 4s, 3d, отдав 30 электронов. Еще 4 заполняют орбиталь 4р — (1 ячейка занята полностью, еще 2 содержат по одному электрону). Валентность селена в обычном состоянии равна II.
Однако селен относится к элементам с переменной валентностью, поэтому также может обладать значением валентности IV и VI.
Элементы, имеющие несколько значений валентности
Значение валентности зависит от состояния атома — обычного или возбужденного.
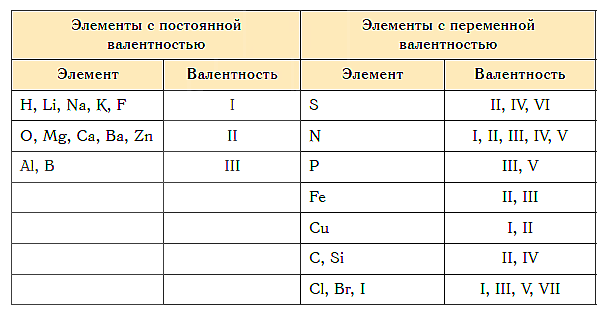
Не все атомы химических элементов могут переходить в возбужденное состояние. По этому признаку они делятся на химические элементы с переменной и постоянной валентностью.
Постоянная валентность наблюдается у щелочных, щелочноземельных металлов, водорода, кислорода, фтора и алюминия.
Все остальные химические элементы обладают переменной валентностью, обусловленными существованием как возбужденных, так и обычных (стационарных) состояний.
Что такое степень окисления
Степень окисления — условная величина электрического заряда атома, входящего в состав химического соединения. Расчет значений этой величины основывается на предположении, что при образовании химической связи происходит полная передача электрона от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. В результате таких представлений каждому атому можно приписать целочисленный электрический заряд. В неорганической химии степень окисления очень часто совпадает с валентностью.
Степень окисления зачастую не совпадает с реальным значением электрического заряда атома, (совпадение наблюдается только в случае ионных соединений). Она используется лишь для систематизации и классификации химических элементов. Степень окисления широко используется при составлении формул, международных названий элементов, объяснения их окислительно-восстановительных свойств.
СО обозначается арабскими цифрами (валентность римскими).
В чем отличие валентности и степени окисления
Валентность и степень окисления не являются равнозначными понятиями, хоть их числовое значение может совпадать.
Валентность используется для определения числа химических связей атома, причем как полярных, так и неполярных.
Степень окисления используется для выражения значения электрического заряда, сосредоточенного на атоме.
Урок 6. Валентность
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
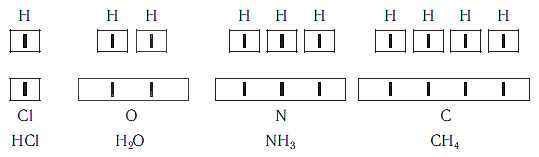
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
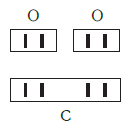
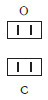
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Валентность элементов.
Валентность элементов – первый камень преткновения изучающих химию. Большой ошибкой является подход, когда учащийся не пытается понять валентность, ожидая, что знания об этом потом приложатся сами собой. Но этот подход неверный, так как без понимания этого мы упираемся в тупик неспособности составить даже простейшую формулу.
Что такое «валентность» элементов?
Обозначают валентность элемента всегда только римскими цифрами. Посмотреть ее значение для разных атомов можно в специальной таблице.
Какие бывают характеристики у валентности элементов?
Все вещества, которые обладают валентностью, характеризуются тем, что она у них или постоянна (во всех связях), либо переменная. Постоянная валентность – характеристика очень небольшой группы веществ (водорода, фтора, натрия, калия, кислорода и др. Намного больше в мире атомов, которые обладают переменной валентностью. В разных реакциях, взаимодействуя с разными атомами, они становятся разновалентными. Например, азот в соединении NH3 имеет валентность – III, так как связан с тремя атомами, а в природе он бывает с валентность от одного до четырех. Еще раз повторю, что разная валентность – более распространенное явление.
Влияние валентности элементов в химических реакциях.
Даже того как ученые узнали, что атом — это не мельчайшая частица в мире, они уже оперировали этим понятием. Они понимали, что есть внутренний фактор, который влияет на протекание химической реакции различных веществ. Из-за того, что ученые по-разному видели строение молекулы, понятие «валентность элемента» пережило несколько метаморфоз.
Валентность вещества определяется количеством внешних электронов атома. Каким количеством электронов атом обладает, столько максимально соединений он способен совершить. Таким образом «валентность» подразумевает собою число электронных пар атомов.
Хотя электронная теория появилась намного позже, после «разделения» атома на более мелкие частицы, до этого ученые все равно вполне успешно определяли валентность в большинстве случаев. Удавалось им это благодаря химическому анализу веществ.
Это была тяжелая работа: прежде всего, требовалось определить массу элемента в чистом виде. Далее, с помощью химического анализа, ученые определяли каков состав соединения, и только потом могли высчитать, сколько атомов содержит в себе молекула вещества.
Этот метод все еще используется, но не является универсальным. Так удобно определять элемент в простом соединении веществ. Например, с одновалентным водородом, или двухвалентным кислородом.
Но уже при работе с кислотами метод не особо удачный. Нет, мы можем частично использовать его, например, при определении валентности соединений кислотных остатков.
Выглядит это так: используя знание, что валентность кислорода всегда равна двум, мы можем с легкостью высчитать валентность всего кислотного остатка. Например, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Валентность элементов в формулах.
Как мы уже говорили выше, понятие «валентность элементов» связанно с электронной структурой атома. Но это не единственный вид связи, которые существуют в природе. Химики знакомы еще с ионными, кристаллическими и другими формами структуры вещества. Для таких структур валентность уже не столь актуальна, но вот работая с формулами молекулярных реакций, мы обязательно должны ее учитывать.
Для того, чтоб сделать формулу мы должны расставить все индексы, которые уравновешивают количество атомов, вступающие в реакцию. Только зная валентность веществ, мы можем правильно расставить индексы. И наоборот, зная молекулярную формулу и имея индексы, можно узнать валентность элементов, что входят в состав вещества.
Для произведения подобных расчетов важно помнить, что валентности обоих элементов, вступивших в реакцию, будут равны, а значит, для поиска необходимо найти наименьшее общее кратное.
Необычные способы определения валентности элементов.
Есть и более нестандартные, но интересные способы определения валентности вещества. Если хорошо знать свойства элемента, то определить валентность можно даже визуально. Например, медь. Ее оксиды будут красными и черными, а гидроксиды – желтыми и синими.
Наглядность.
Для того, чтоб валентность элемента была более понятна рекомендуют писать структурные формулы. Создавая их, мы пишем условные обозначения атомов, а потом рисуем черточки, опираясь на валентность. Там каждая черточка обозначает связи каждого из элементов и получается очень наглядно.