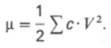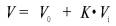на каком различии основано фракционирование белков методом гель фильтрации
Большая Энциклопедия Нефти и Газа
Обычно для фракционирования белков сыворотки используют рекомендованное выше напряжение 110 В, при котором разделение длится от 14 до 16 ч, и охлаждения не требуется. Для особых целей напряжение может быть увеличено, но, согласно закону Джоуля, при этом соответственно увеличится теплообразование. [16]
В процессе выделения и фракционирования белков необходимо принимать известные меры предосторожности. Молекулы белков весьма неустойчивы. Инкубация белков даже при умеренной температуре, например при 37, приводит, как правило, к их частичной денатурации. Большинство операций при очистке белка должно поэтому проводиться при температуре, близкой к точке замерзания используемого растворителя. Некоторые белки, однако, довольно устойчивы к нагреванию. Кратковременная тепловая обработка при выделении таких белков оказывается весьма полезной, так как дает возможность осадить большую часть загрязняющего материала. [19]
Хроматографический метод очистки и фракционирования белков на карбоксильной смоле Амберлит IRC-50 успешно применен к следующим белкам: цитохрому С, рибонуклеазе, лизоциму, химотрипсиногену, химотрипсину, гиалуронидазе, гемоглобинам, адренокортикотропному гормону, инсулину и др. Среди этих работ следует отметить обнаружение двух хроматографически активных белков, обладающих активностью рибонуклеазы, доказательство распада индивидуального лиофилизованного лизоцима при комнатной температуре и лиофилизованной рибонуклеазы при 0 С. Наибольшее значение тонкая хроматографическая очистка белка имеет при изучении первичной его структуры и физико-химических констант, характеризующих вторичную и третичную структуры. [20]
На каком различии основано фракционирование белков методом гель-фильтрации: а) по растворимости; б) по форме молекулы; в) по суммарному заряду; г) по молекулярной массе; д) по первичной структуре. [21]
Полученный осадок глобулина после фракционирования белка переносят в цилиндр 1, заполненный 10 мл дистиллированной воды. Диализ обычно ведут в течение суток в холодном помещении ( от 0 до 2 С), сменяя несколько раз воду. Отсутствие осадка при добавлении раствора ВаС12 свидетельствует об окончании диализа. В сухом виде препарат хорошо сохраняется. [22]
В последние годы широкое распространение для фракционирования белков получили различные сочетания изоэлектрофокусирования и диск-электрофореза в полиакриламидном геле-методы двухмерного электрофореза, которые позоляют параллельно анализировать сотни и даже тысячи белковых фракций. [28]
Фракционирование и очистка белков
После достижения полной экстракции белков, т.е. перевода белков в растворенное состояние, приступают к разделению – фракционированию смеси белков на индивидуальные белки. Для этого применяют разнообразные методы: высаливание, тепловую денатурацию, осаждение органическими растворителями, хроматографию, электрофорез, распределение в двухфазных системах, кристаллизацию и др.
Растворение белков в воде связано с гидратацией каждой молекулы, что приводит к образованию вокруг белковой глобулы водных (гидратных) оболочек, состоящих из ориентированных в определенной форме в пространстве молекул воды. По химическим и физическим свойствам вода, входящая в состав гидратной оболочки, отличается от чистого растворителя. В частности, температура замерзания ее составляет –40°С. В этой воде хуже растворяются сахара, соли и другие вещества. Растворы белков отличаются крайней неустойчивостью, и под действием разнообразных факторов, нарушающих гидратацию, белки легко выпадают в осадок. Поэтому при добавлении к раствору белка любых водоотнимающих средств (спирт, ацетон, концентрированные растворы нейтральных солей щелочных металлов), а также под влиянием физических факторов (нагревание, облучение и др.) наблюдаются дегидратация молекул белка и их выпадение в осадок.
Высаливание. При добавлении растворов солей щелочных и щелочноземельных металлов происходит осаждение белков из раствора. Обычно белок не теряет способности растворяться вновь в воде после удаления солей методами диализа или гельхроматографии. Высаливанием белков обычно пользуются в клинической практике при анализе белков сыворотки крови и других биологических жидкостей, а также в препаративной энзимологии для предварительного осаждения и удаления балластных белков или выделения исследуемого фермента. Различные белки высаливаются из растворов при разных концентрациях нейтральных растворов сульфата аммония. Поэтому метод нашел широкое применение в клинике для разделения глобулинов (выпадают в осадок при 50% насыщении) и альбуминов (выпадают при 100% насыщении).
На величину высаливания белков оказывают влияние не только природа и концентрация соли, но и рН среды и температура. Считают, что главную роль при этом играет валентность ионов. Действие разных ионов принято сравнивать не по молярной концентрации соли, а по так называемой ионной силе (μ), которая равна половине суммы произведений концентрации каждого иона (с) на квадрат его валентности (V):
Более тонкое разделение белков плазмы крови человека на фракции достигается при использовании различных концентраций этанола при низкой температуре (от –3 до –5°С) по методу Кона (рис. 1.2). В этих условиях белки сохраняют свои нативные свойства. Указанным методом часто пользуются для получения отдельных фракций крови, используемых в качестве кровезаменителей.
Рис. 1.2. Диаграмма фракционирования белков плазмы крови человека этанолом (по методу Кона).
В последнее время наибольшее распространение получили хроматографические и электрофоретические методы разделения белков.
Хроматография. Принцип хроматографии, разработанный в 1903 г. русским ученым М. С. Цветом, основан на способности пигментов (или любых других окрашенных и неокрашенных веществ) специфически адсорбироваться на адсорбенте, заключенном в колонке.
В результате происходит разделение анализируемых веществ и их концентрирование в строго определенном слое адсорбента. Затем через колонку пропускают подходящие элюенты, которые ослабляют силы адсорбции и выносят с током раствора индивидуальные вещества. Последние последовательно собирают в коллекторе фракций (принцип сорбции-десорбции).
Чрезвычайно эффективным средством фракционирования белков из смеси оказалась колоночная хроматография с гидроксилапатитом, различными ионообменными смолами и производными целллюлозы в качестве носителей. При выделении и очистке белков используют четыре основных типа хроматографии: адсорбционную, распределительную, ионообменную и аффинную (хроматография по сродству) – в соответствии с разными физическими и химическими механизмами, лежащими в основе каждого из них. Хроматография широко применяется не только для выделения белков, но и для разделения множества других органических и неорганических веществ, входящих в состав живых организмов.
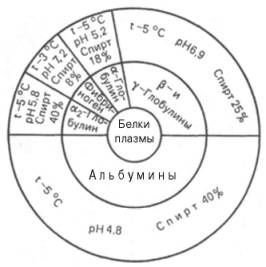
Адсорбционная хроматография. Разделение компонентов смеси (образца) основано на их различной сорбируемости на твердом адсорбенте. В качестве адсорбентов используют активированный древесный уголь, гель фосфата кальция, оксиды алюминия или кремния. Адсорбент в виде суспензии с растворителем (чаще всего буферным раствором) вносят в стеклянную вертикальную трубку (колонку) и равномерно в ней упаковывают. Образец в небольшом объеме растворителя наносят на колонку –
Рис. 1.3. Абсорбционнаяхроматография (схема). Разделение двух разных веществ (А и В), перемещающихся по колонке с разной скоростью.
компоненты разделяемой смеси адсорбируются на адсорбенте. Затем приступают к стадии освобождения – десорбции компонентов из колонки, применяя подходящие элюенты (рис. 1.3). Сбор фракций осуществляют при помощи автоматического коллектора фракций.
Распределительная хроматография. В отличие от адсорбционной твердая фаза служит только опорой (основой) для стационарной жидкой фазы. Один из типов распределительной хроматографии, как и адсорбционная, осуществляется на колонках, в которых в качестве стационарной фазы применяют влажный крахмал или силикагель. Образец растворяют в подходящем растворителе, затем наносят на колонку; разделяемые вещества, подвергающиеся многократному распределению между неподвижной стационарной фазой (водный слой) и движущейся фазой органического растворителя, с разной скоростью перемещаются ко дну колонки. Собранные при помощи коллектора фракции пробы, содержащие одно вещество, соединяют для выделения этого вещества в чистом виде.
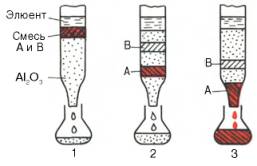
Разновидностью распределительной хроматографии является хроматография на бумаге, широко используемая в биохимических лабораториях, в том числе клинических, для разделения пептидов, аминокислот и других веществ (рис. 1.4). В качестве стационарной фазы при этом служит вода, адсорбированная целлюлозными цепями фильтровальной бумаги. Образец помещают на одном конце бумажной полосы, этим же концом бумагу погружают в подходящую смесь органических растворителей (например, бутанол–уксусная кислота–вода в определенных соотношениях). При движении растворителя по бумаге благодаря силе капиллярности происходит разделение компонентов смеси. Проявленную хроматограмму высушивают, а местоположение каждого из разделяемых веществ определяют химическими или физико-химическими методами.
А – восходящая хроматография; Б – нисходящая хроматография (вид сбоку); В – хроматограмма с разделенными и окрашенными веществами: 1 – фронт растворителя, 2 – разделенные вещества, 3 – место нанесения образца.
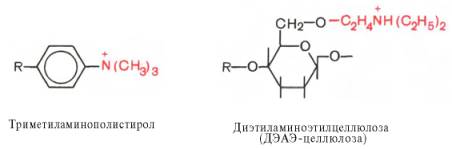
Ионообменная хроматография. Ионообменные смолы являются полимерными органическими соединениями, содержащими функциональные группы, способные вовлекаться в ионный обмен. Различают положительно заряженные анионообменники, представленные органическими основаниями и аминами, и отрицательно заряженные катионообменники, содержащие фенольные, сульфо- или карбоксильные группы. Из сильно- и слабоосновных анионообменников чаще используют производные полистирола и целлюлозы, несущие функциональные группы:
Аналогичные функциональные группы содержат триэтиламиноэтил (ТЭАЭ)- и аминоэтил (АЭ)-целлюлозы.
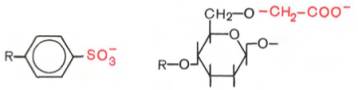
Катионообменники представлены сульфонированными полистиролами (производные винилбензола или дивинилбензола) и карбоксиметилцеллюлозой, имеющими следующие функциональные группы:
В зависимости от заряда разделяемых белков используют подходящую ионообменную смолу, с функциональными группами которой обменивается и задерживается на колонке часть белков, в то время как другие белки беспрепятственно элюируются с колонки. «Осажденные» на колонке белки снимают с колонки, применяя более концентрированные солевые растворы или изменяя рН элюента.
Новейшие методы ионообменной хроматографии, в частности высокоэффективная жидкостная хроматография (ВЭЖХ), широко используются в фармакологии (при создании и определении лекарственных веществ), в клинической биохимии (при определении биологически активных веществ в физиологических жидкостях), в биотехнологических процессах и производствах и других областях: они позволяют определять вещества в нано-, пико- и фемтаграммных количествах.
Аффинная хроматография (хроматография по сродству). Основана аффинная хроматография на принципе избирательного взаимодействия белков (или других макромолекул) с закрепленными (иммобилизованными) на носителе специфическими веществами – лигандами, которыми могут быть субстраты или коферменты (когда выделяют какой-либо фермент), антигены (или антитела), гормоны или рецепторы и т. д. Благодаря высокой специфичности белков к иммобилизованному лиганду, связанному с носителем (которым заполняют хроматографическую колонку), присоединяется только один какой-либо белок из смеси. Снятие с колонки этого белка осуществляют элюированием буферными смесями с измененным рН или измененной ионной силой, а также введением в состав элюента детергентов, ослабляющих связи между белками и лигандами. Несомненным достоинством метода является возможность одноэтапно выделить заданный белок или другой биополимер высокой степени чистоты. При помощи аффинной хроматографии, например, удалось сравнительно легко выделить очищенные препараты аминоацил-тРНК-синтетаз на полиакрилгидразидагаровом геле, к которому в качестве лигандов были присоединены определенные тРНК (транспортные РНК).
Гель-хроматография. В препаративных целях, особенно при очистке белков от примесей, широко используют метод молекулярных сит, или гель-хроматографию. При обработке эпихлоргидрином полисахарида дек-страна образуются различной степени выраженности поперечные связи, приводящие к формированию крупных гидрофильных зерен, нерастворимых в воде и называемых сефадексами. Благодаря большому сродству к воде зерна сильно набухают в водной среде с образованием геля, которым заполняют хроматографическую колонку. Разделение веществ этим методом основано на том, что большие молекулы не проникают во внутреннюю водную фазу геля, являющуюся стационарной, и остаются снаружи, двигаясь вместе с подвижной фазой вниз вдоль колонки; небольшие молекулы, напротив, свободно диффундируют внутрь зерен, образуя равновесную систему между подвижной и стационарной фазами, и соответственно с меньшей скоростью двигаются вдоль колонки (рис. 1.5). Обычно момент появления веществ в вытекающем из колонки с сефадексом элюенте выражают формулой:
Поскольку молекулы белков, обладающие большими молекулярной массой и размерами, не диффундируют внутрь зерен сефадекса, они первыми вымываются из колонки после выхода свободного объема колонки V0, в то время как все остальные вещества (включая низкомолекулярные примеси) вымываются после выхода объема, равного V0+ К • Vi.
Метод нашел широкое применение в препаративной энзимологии. С помощью сефадекса можно разделить белки с разной молекулярной массой.
Электрофорез. Метод свободного электрофореза, детально разработанный лауреатом Нобелевской премии А. Тизелиусом, основан на различии в скорости движения (подвижности) белков в электрическом поле, которая определяется величиной заряда белка при определенных значениях рН и ионной силы раствора. В последнее время более широкое распространение получили методы зонального электрофореза белков на различных носителях, в частности на твердых поддерживающих средах: гелях крахмала и полиакриламида, целлюлозе. Преимущества их по сравнению с методом свободного электрофореза состоят в том, что исключается размывание границы белок-растворитель в результате диффузии и конвекции, не требуется налаживания сложной аппаратуры для определения положения границы, а для анализа необходимо небольшое количество белка (подробно эти методы и соответствующая аппаратура рассматриваются в практических руководствах по биохимии).
Рис. 1.5. Гель-хроматография на колонке с сефадексом (схема).
Одним из наиболее распространенных методов фракционирования белков (как и методов оценки гомогенности) является диск-электрофорез (от англ. discontinuous – прерывистый, перемежающийся) в полиакриламидном геле, при котором используют пары буферных растворов с различными значениями рН и разной степени пористости гель. Следует отметить высокую разрешающую способность гель-электрофореза. Если при электрофорезе белков сыворотки крови человека на бумаге открываются всего 6 фракций, то при электрофорезе в крахмальном геле – 10, а в полиакрил-амидном геле – до 18 разных белковых фракций.
Для выявления белков при электрофорезе в гелях их обрабатывают одним из следующих красителей: бромфеноловым синим, амидо черным 10В, кислотным синим 83, кумасси бриллиантовым голубым R-250 и др. Интенсивность окраски и соответственно относительное содержание каждой белковой фракции обычно определяют денситометрически путем прямого сканирования на денситометре. В последние годы стали применять методы электрофореза белков с градиентом концентрации геля, что значительно повышает разрешающую способность, особенно при фракционировании белков с высокой молекулярной массой, превышающей 50000– 100000.
Весьма перспективными методами разделения белков (как и определения ряда физико-химических свойств) оказались разные варианты метода изоэлектрического фокусирования – изотахофореза, основанные на проведении электрофореза в поддерживающих средах (на колонке или в тонком слое) с градиентом рН. Точное местоположение на колонке каждого белка из смеси определяется значением его изоэлектрической точки, т.е. состоянием, при котором суммарный электрический заряд белковой частицы при данном значении рН равен нулю. При использовании метода изоэлектрического фокусирования применяют смеси синтетических полиаминополикарбоновых кислот (амфолины) для создания градиента рН в диапазоне от 3,0 до 10,0.
В последние годы широкое распространение для фракционирования белков получили различные сочетания изоэлектрофокусирования и диск-электрофореза в полиакриламидном геле – методы двухмерного электрофореза, которые позоляют параллельно анализировать сотни и даже тысячи белковых фракций.
Очистка белков от низкомолекулярных примесей
Применение в определенной последовательности ряда перечисленных методов позволяет получить белок в очищенном состоянии, не лишенный, однако, некоторых примесей солей. Для полного освобождения белков от низкомолекулярных примесей в настоящее время используют методы диализа, гельхроматографии, кристаллизации, ультрафильтрации. При диализе применяют полупроницаемые мембраны (целлофан, коллодийная пленка), диаметр пор которых варьирует в широких пределах. Белки, как правило, не диффундируют через такую мембрану, в то время как низкомолекулярные вещества легко проникают через нее в окружающую среду.
Наилучшие результаты при освобождении белков от низкомолекулярных примесей получают с помощью гельхроматографии и ультрафильтрации. Последняя основана на продавливании растворов белка через специальные мембраны, задерживающие белковые молекулы, что позволяет не только освободить белковые растворы от низкомолекулярных примесей, но и концентрировать их.
Методы фракционирования и очистки белков



После экстрагирования белков, т.е. перевода в растворенное состояние, приступают к разделению, фракционированию смеси белков на индивидуальные белки. Для этого применяют методы:
• осаждения органическими растворителями;
• распределения в двухфазных системах.
Как известно, растворение белков в воде связано с гидратацией отдельных молекул, что приводит к образованию вокруг белковой молекулы водных (гидратных) оболочек, состоящих из ориентированных в определенной форме в пространстве молекул воды. Эта вода (гидратной оболочки) отличается от чистого растворителя. Растворы белков отличаются крайней неустойчивостью и под действием разнообразных факторов, нарушающих гидратацию, белки легко выпадают в осадок. Поэтому добавление к раствору белка любых водоотнимающих средств (спирт, ацетон, концентрированные растворы нейтральных солей щелочных металлов), а также воздействие физических факторов (нагревание, облучение) приводит к дегидратации молекул и их выпадению в осадок.
Высаливание. При высаливании белка солями щелочных и щелочноземельных металлов белок обычно не теряет способности растворяться вновь в воде после удаления солей (диализом, гельфильтрацией). Например: глобулины выпадают в осадок при 50% насыщения, а альбумины при 100% насыщении раствора сульфатом аммония. При выпадении белковой молекулы в осадок, большое значение имеет не только концентрация солей, но температура и ионная сила раствора.
Методы хроматографии. Метод хроматографии, разработанный в 1903 г. русским ученым М.В. Цветом, основан на способности пигментов (или др. веществ) специфически связываться с адсорбентом, заключенном в колонке; используются также процессы сорбции и десорбции. Применяют различные методы хроматографии – адсорбционную, распределительную, ионнобменную.
Адсорбционная хроматография – адсорбентом является активированный уголь, окись алюминия или кремния. Широко применяются для разделения белков и другие вещества.
Распределительная хроматография. При этом твердая фаза является только носителем для жидкой фазы. Виды: хроматография на бумаге, на колонках, где в качестве стационарной фазы применяют крахмал или селикагель.
Ионообменная хроматография. Ионообменные смолы являются полимерными органическими соединениями, содержащими функциональные группы, способные вовлекаться в ионный обмен.
Аффинная хроматография (или хроматография по сродству) основана на принципе избирательного взаимодействия белков со специфическими веществами, закрепленными на носителе. В качестве носителя применяют активированную бромцианом сефарозу (CNBr-сефароза), к которой присоединяют различные вещества – субстрат, кофермент, антиген, гормон и т.д. Метод позволяет одноэтапно получить высокоочищенный препарат белка.
Гель-фильтрация или метод молекулярных сит – широко применяется для очистки белков от примесей.
С помощью сефадекса (декстран, полисахарид микробного происхождения, обработанный для разделения белков) можно разделить белки с разной молекулярной массой, так как зерна сефадекса разных номеров имеют различного размера поры, в которые способны проникать белки с определенной молекулярной массой.
Метод электрофореза основан на различии в скорости движения белков в электрическом поле, которая определяется величиной заряда белка при определенных рН и ионной силе раствора. Первоначально метод разработан А. Тизелиусом, в последнее время широко применяется метод зонального электрофореза белков на различных носителях – на бумаге (целлюлозе), крахмале, в полиакриламидном геле. Метод диск-электрофореза в полиакриламидном геле позволяет получить до 50 фракций белков, т.е. имеет очень высокую разрешающую способность.
Изоэлектрическое фокусирование белков – на амфолинах позволяет выделить индивидуальные белки в препаративных количествах.
Очистка белка от низкомолекулярных примесей достигается методом диализа, гельфильтрации, кристаллизации, ультрафильтрации. При диализе применяют полупроницаемые мембраны (целлофан, коллоидиновая пленка), диаметр пор которой варьирует в широких пределах. Белки, как правило, через такую мембрану не диффундируют, а низкомолекулярные вещества легко проходят через нее в окружающую среду. Наилучшие результаты дают методы гельфильтрации и ультрафильтрации, т.к. дают возможность, как освободиться от низкомолекулярных компонентов, так и сконцентрировать белки.
Методы определения гомогенности белков. Наилучшие результаты дают ультрацентрифугирование в градиенте плотности, диск-электрофорез в полиакриламидном геле, иммунохимические методы.
ПРИНЦИП ГЕЛЬ-ФИЛЬТРАЦИИ (подробно в картинках)
РАЗДЕЛЕНИЕ БИОЛОГИЧЕСКИХ МОЛЕКУЛ
МЕТОДОМ ГЕЛЬ-ФИЛЬТРАЦИИ
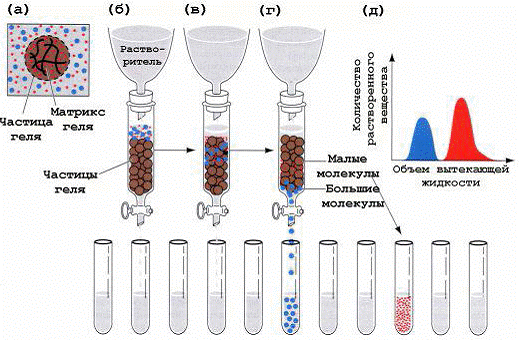
Разделение молекул по размерам и форме основано на свойствах молекулярного сита, которыми обладают многие пористые материалы.
Наиболее часто для этой цели применяют органические полимеры с трехмерной сетчатой структурой, придающей им свойства гелей. Разделение веществ при помощи гелей, основанное на различиях в размере молекул, называется гель-фильтрацией.
Гель-фильтрацию открыли в 1959 Д. Порат и П. Флодин, которые показали возможность фракционирования водорастворимых макромолекул, в т. ч. белков, по молекулярной массе, в качестве сита они использовали сшитый декстрановый гель. В 1964 Д. Мур предложил с помощью гель-проникающей хроматографии определять молекулярную массу полимеров, фракционируя их на стирол-дивинилбензольном геле.
В качестве молекулярного сита также применяются пористые стеклянные гранулы, а сам метод разделения получил название хроматографии фильтрованием через стекло с заданным размером пор. Понятие проникающая хроматография включает в себя все виды разделения молекул, основанные на принципе молекулярного сита.
Принцип, лежащий в основе метода проникающей хроматографии, прост. Хроматографическую колонку заполняют набухшим гелем или
пористыми стеклянными шариками и уравновешивают с помощью соответствующего растворителя. Крупные молекулы, не проникающие в поры сита, проходят между частицами геля, в то время как небольшие молекулы «застревают» в них и движутся с меньшей скоростью.
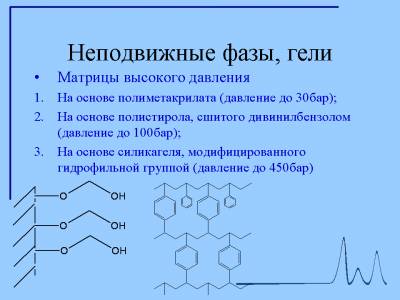
Для гель-фильтрации применяют гели на основе декстрана (сефадекс), полиакриламида (акрилекс, биогель Р), агарозы (сефароза, биогель А, сагавак), полиакрилоилморфина (энзокрилгель), полистиролов (Био-Бидз S).
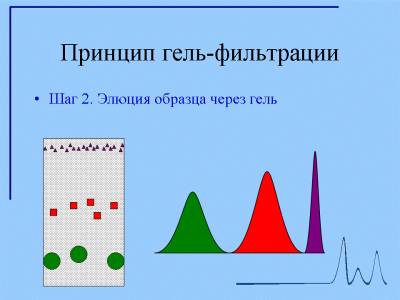
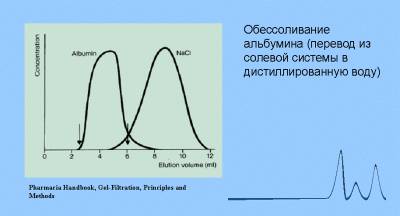
Гель образует неподвижную фазу, в которой с током буфера происходит разделение биологических молекул. Гель формируют в колонках, чаще стеклянных, различного размера и диаметра (в зависимости от цели эксперимента). Гель-хроматография на сефадексе используется для обессоливания растворов белков (разделение крупных белковых молекул и малых молекул солей), определения молекулярных масс белков, разделения сложных смесей макромолекул. Размер биологических молекул является главным фактором их эффективного разделения при движении в пористом геле. Гели, используемые для хроматографии, имеют разный размер пор, что позволяет делить вещества в широком диапазоне молекулярных масс ( 1000 — 1000000 дальтон). При прохождении через колонку геля смеси молекул разного размера крупные молекулы движутся быстрее, чем мелкие, так как последние за счет проникновения в пористые гранулы геля проходят более длинный путь. В конечном итоге компоненты смеси элюируются с колонки, наполненной гранулами геля,в порядке уменьшения их молекулярной массы. Для характеристики процесса гель-фильтрации используют понятия: свободный объем колонки (Vo) и объем элюции (Ve). Свободный объем определяют путем пропускания через колонку раствора «голубого декстрана» (высокомолекулярного вещества с массой 2 х 10 6 дальтон). Объем, с которым выходит пиковая концентрация голубого декстрана, называется свободным объемом колонки (Vo). Объем, с которым выходит пиковая концентрация разделяемого вещества, называется объемом элюции (Ve).
В этом простейшем варианте хроматографии молекулы фракционируемых веществ не должны обладать никаким специальным сродством к неподвижной или подвижной фазам. Неподвижная фаза здесь представлена жидкостью, находящейся внутри пористых гранул,— точно такой же, как и жидкость подвижной фазы, протекающей между ними. Благодаря силам сцепления с поверхностью пространственной сетки полимера или иного пористого материала, образующего гранулы, жидкость внутри них остается неподвижной и не увлекается течением подвижной фазы. В подавляющем большинстве случаев применения гель-фильтрации для биологических целей рабочей жидкостью служат водно-солевые растворы, а материалы гранул гидрофильны. Переход молекул вещества из подвижной фазы в неподвижную и обратно за счет диффузии ничем не затруднен. Иная ситуация складывается внутри гранул. Здесь диффузия более или менее затруднена из-за столкновений молекул диффундирующего вещества с нитями пространственной сетки полимера или стенками пор. Если размеры молекул соизмеримы со средним диаметром каналов в гранулах, то эти затруднения становятся весьма существенными и диффузия тормозится.
Может сложиться и такое положение, когда часть внутреннего объема гранул, т. е. часть объема неподвижной фазы (а иногда и весь этот объем), оказывается недоступной для молекул вещества, растворенного в подвижной фазе.
Различие степени доступности объема неподвижной фазы для молекул различных компонентов исходной смеси веществ является фактором, определяющим возможность их фракционирования. Очевидно, что оно будет происходить по размерам молекул (рис. 1). Если в составе смеси имеются очень крупные молекулы, вовсе не проникающие внутрь гранул, то они будут выходить из колонки или достигать края хроматографической пластины вместе с передним фронтом подвижной фазы («фронтом элюции»). В то же время мелкие молекулы, свободно диффундирующие внутрь гранул, часть времени будут находиться в неподвижной фазе. Статистически эта часть времени одинакова для всех молекул такого размера и зависит от соотношения объемов жидкости в неподвижной и подвижной фазах. Таким образом, все мелкие молекулы достигнут конца хроматографического пути более или менее одновременно и заведомо позднее, чем крупные. Молекулы промежуточных размеров, для которых из-за разброса значений эффективных диаметров пор внутри гранул неподвижной фазы доступна только часть ее объема, должны, очевидно, перемещаться вдоль колонки или пластины с промежуточной скоростью.
Рис. 1. Гель-фильтрационная хроматография. Малые молекулы в образце могут проникать внутрь гранул, вследствие этого они протекают через колонку медленнее. Крупные молекулы, которые не могут проникнуть в гранулы через поры, проходят сквозь колонку быстрее, чем более мелкие. Правильный размер пор и свойства растворителя являются решающими для хорошего разделения.
Это явление первоначально было названо «гель-фильтрацией», поскольку в качестве пространственной сетки использовали полимерные гели. Однако эти гели относительно легко деформируются и для хроматографии при высоком давлении непригодны, поэтому их стали заменять жесткими материалами, в частности пористым стеклом и силикагелем. Иногда для этого варианта хроматографии вводят термин «эксклюзивная хроматография» («exclusion» — исключение; имеется в виду исключение из гранул крупных молекул). Поскольку сейчас силикагель явно вытесняет пористое стекло, мы сохраним для рассматриваемого варианта хроматографии прежнее название — гель-фильтрация.
Очевидно, что размеры молекул связаны с их массами, но отнюдь не целиком ими определяются. Это особенно важно учитывать в случае макромолекул, размеры которых могут существенно зависеть от плотности упаковки полипептидной или полинуклеотидной цепи. В ограничении свободы диффузии через пространственную сетку пор внутри гранул немалую роль может играть и форма молекулы. Очевидно, что сферическая глобула будет диффундировать иначе, чем молекула такого же объема, но вытянутая в виде палочки.
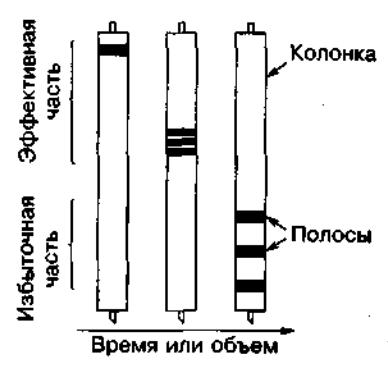
Как во всех хроматографических разделениях излишняя длина колонки приводит к размыванию пика (Рис. 2).
Рис. 2. Уширение полос в колонке из-за чрезмерной длины колонки. Так называемая эффективная часть колонки является достаточной для разделения. Слишком длинные колонки не улучшают очистку, но вызывают разбавление образца из-за уширения полос.
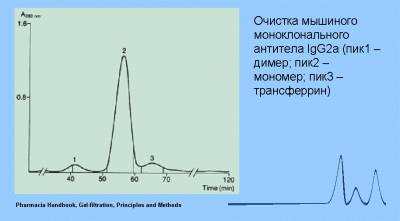
Гель-фильтрационная хроматография является методом для оценки молекулярной массы молекул. Гель-фильтрация также оказывается полезной для измерения равновесий мономер-мультимер при микромолярных (мкМ) концентрациях биомолекул (Рис. 3).
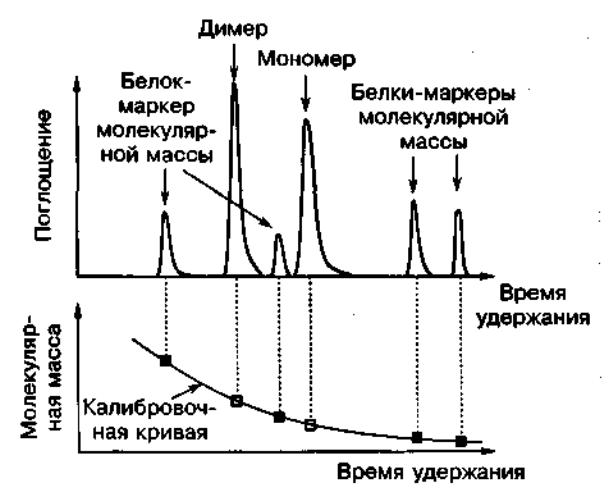
Рис.3. Молекулы с известной молекулярной массой дают возможность оценить молекулярную массу неизвестной молекулы. В данном случае для исследуемой молекулы наблюдаются два пика, что указывает на равновесие мономер-димер.
Пористые материалы для гель-фильтрации чаще всего выпускаются в виде сферических гранул целого набора диаметров с различными средними размерами пор.
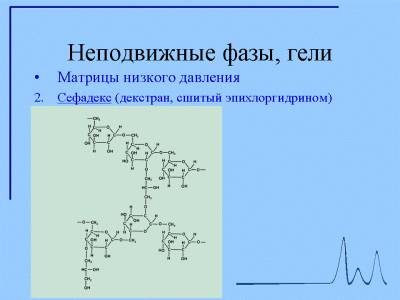
Гели на основе декстрана (сефадексы)
Декстран также представляет собой полисахарид — в основном линейный полимер на основе глюкозы, где звенья связаны β-1,6-глюкозидной связью
Рис.2. Химическая форма декстрана.
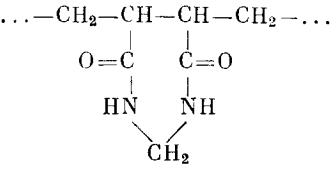
Это тоже полиатомный спирт с высокой степенью гидрофильности, предоставляющий столь же широкие, как и целлюлоза, возможности для модификации и также химически инертный. Устойчивость к действию кислот у декстрана еще меньше, чем у целлюлозы. Его не следует обрабатывать более крепким раствором, чем 0,1 н. НС1 (в течение 2 ч). К щелочи гели на основе декстрана более устойчивы: они сохраняют свои свойства в 0,25 н. NaOH до 2 мес даже при температуре 60оС. Рабочий диапазон рН составляет 2-12. Существенное отличие от целлюлозы состоит в том, что нити декстрина не образуют агрегатов, так как они не вполне линейны — имеются достаточно многочисленные ветвления (по связям 1.2-, 1,3- и 1,4-).

В гелях для хроматографии («сефадексах») нити декстрана химически сшиты эпихлоргидрином. Однако сшивка не очень жесткая: сефадексы относительно мягки и легко сжимаются, а в водных растворах сильно набухают. Утери качества выражены тем сильнее, чем меньше процентное содержание эпихлоргидрина. Изменяя долю сшивки, можно регулировать средний размер пор, образуемых пространственной сеткой сшитого геля. Ввиду статистического распределения сшивок по объему геля разброс размеров пор невелик, и сефадексы заметно более гомогенны, а свойства их лучше воспроизводимы, чем у целлюлозы.
Они «не боятся» высушивания и при замачивании не требуют никакой специальной обработки. Сефадексы можно автоклавировать как в сухом, так и во влажном виде в нейтральной среде при 120 о С в течение 30 мин. Суспензию сефадекса (набитую колонку) следует хранить с антисептиком, так как он, подобно целлюлозэ, легко атакуется микроорганизмами. Сефадексам присуща некоторая адсорбционная способность по отношению к ароматическим и гетероциклическим молекулам, которую даже удается использовать для фракционирования нуклеиновых оснований,ароматических аминокислот и пептидов. Кроме того, продажные сефадексы содержат в своей структуре небольшое количество карбоксильных групп, что придает им некоторое сродство к катионам. При хроматографии его легко подавить введением в элюент соли (NaCl) в концентрации около 0,02 М.
Мягкость сефадексов (особенно слабосшитых) накладывает ограничения на допустимые значения скоростей хроматографическон элюцпи, которые подробно рассмотрены ниже. По этой же причине определенные сложности возникают при использовании ионообмеиников па основе сефадексов: за счет сил электростатического отталкивания своих ионогенных групп они склонны деформироваться при изменении ионной силы элюента. Все это привело к разработке в последние годы ряда более жестких матриц, вытесняющих сефадексы из традиционных областей их применения — гель-фильтрации и ионообменной хроматографии.
Агароза
Положение усугубляется тем, что внутри плотно упакованных пучков нитей гидроксильные группы недоступны для модификации. В условиях хроматографии агароза химически неактивна, но уязвима для действия кислот, щелочей и окислителей. Рабочий диапазон рН при использовании матриц из обычной агарозы лежит в пределах 4-9. Агароза выдерживает непродолжительный контакт с 8 М мочевиной и 6 М гуанидиихлоридом, которые все же постепенно ее разрушают.Поскольку агароза для хроматографии представляет собой водный гель, о набухании ее говорить не приходится. Но следует помнить о том, что агарозу нельзя сушить ввиду необратимой деструкции геля. Агароза для хроматографии поставляется в виде суспендированных в воде сферических гранул диаметром 60— 200 мкм, которые в таком виде и следует хранить. При кратковременном обсыхании колонки, заполненной агарозой, пока гранулы не начали терять находящуюся в них жидкость, хроматографнческне характеристики сорбента еще могут быть восстановлены. Если же подсыхание гранул началось, то гель приходится выбрасывать (разумеется, его можно расплавить и использовать, например, для электрофореза, но гранулированная структура будет уже утрачена). Размер пор (пустот) в гранулах зависит от процентного содержания агарозьг в геле (2, 4 или 6%). Связанные с агарозой остатки сульфокислоты (до 0,5% по массе) могут сорбировать щелочные белки. Эта сорбция подавляется в присутствии 0,02 М NaCl или другой соли. Гранулированную агарозу для гель-фильтрации и синтеза аффинных сорбентов выпускают следующие фирмы: «Pharmacia» — под торговым названием «Sepharose», «Bio-Rad» — под названием «Bio-Gel A», «LKB» (Швеция) и «IBF» (Франция) — под названием «Ultrogel А».
Для повышения химической и термической стойкости матриц фирма «Pharmacia» разработала вариант гелей агарозы, в которых нити полимера дополнительно химически «сшиты» обработкой 2,3-дибромпропанолом в сильно щелочной среде. Матрицы на основе такой «сшитой» агарозы носят общее наименование «Sepharose CL». Их можно использовать в значительно более широком диапазоне рН (3—14) и даже автоклавировать при температуре 120оС. Они обладают еще большей жесткостью, выдерживают длительный контакт с 8 М мочевиной и 6 М гуанидинхлоридом, а также со многими органическими растворителями (этанолом, ацетоном, хлороформом, пиридином, ацетонитрилом, дихлорэтаном, ДМФ, ДМСО и др.). Последнее обстоятельство имеет важное значение для осуществления реакций модификации.
В настоящее время агароза широко применяется как в колоночной хроматографии в виде модифицированных сорбентов состоящих из сферических гранул строго определенного размера (Q-Sepharose, SP-Sepharose, Phenyl-Sepharose и т.д.), так и в виде гелей, в основном применяемых для электрофоретического разделения нуклеиновых кислот при молекулярно-биологических и биотехнологических исследованиях.
Полиакриламидный гель
Нити линейного полимера акриламида, сшитые N.N’-метиленбисакриламидом, образуют относительно жесткую и химически инертную пространственную сетку геля, хорошо удерживающую воду. Пористость и жесткость геля определяется процентным содержанием в нем полимера. Гранулированные матрицы полиакриламидного геля (ПААГ) используются только для гель-фильтрации. Рабочий диапазон рН — 3-8. Гель можно автоклавировать; он выдерживает контакт с разбавленными органическими кислотами, 8 М мочевиной, 6 М гуанпдинхлоридом, детергентами. В отличие от агарозы ПААГ «не боится» высушивания. Матрицы поставляются и виде сухих сферических гранул нескольких диапазонов диаметров в интервале от 40 до 300 мкм. При замачивании они сильно набухают и могут связывать, в зависимости от содержания ПААГ, от 3 до 30 мл воды на 1 г сухих гранул.
Полиакриламидпые патрицы выпускают фирмы «Bio-Rad» (под общим названием «Bio-Gel P») и «Roanal» (под названием «Акрилекс»). На основе полиакриловой кислоты выпускают также ионообменники — «Trisacryl» (фирма «LKI3») и «Bio-Rex 70» (фирма «Bio-Rad»).
В целях объединения достоинств описанных выше материалов было создано два новых типа комбинированных матриц — «Sephacryl» и «Ultrogel AcA».
Сефакрилы
Торговое название «Sephacryl» получила разработанная фирмой «Pharmacia» матрица для гель-фильтрации на основе декстрана и N,N’-метиленбисакриламида. В ней удачно сочетаются качества сефадексов и ПААГ — нити декстрана и полимерные нити метилеп-бисакриламида (он способен полимеризоваться в нити подобно акрил-амиду химически связаны друг с другом).
Получается очень жесткий гель, пористость которого легко контролировать. Он гидрофилен, химически инертен, выдерживает контакт с 8 М мочевиной, 6 М гуанидинхлоридом, детергентами и органическими растворителями; его можно автоклавировать при 120 o С. Рабочий диапазон рН — 2-11. Благодаря своей жесткости сефакрил может быть использован при значительно больших скоростях элюции, чем сефадекс с такой же пористостью. Адсорбция здесь несколько более заметна, чем у сефадексов, особенно при кислых значениях рН (ее подавляет 0,05 М NaCl). Сефакрил поставляется в виде суспензии набухших гранул с размерами 40—105 мкм.
Ультрагели типа АсА
«Ultrogel AcA» — еще один вариант жесткой матрицы, обеспечивающей широкие возможности выбора размера пор. Здесь контролируемая пористость ПААГ сочетается с жесткостью агарозы — сетка ПААГ полимеризуется внутри жесткого каркаса агарозы. Химической связи между ними нет, но агароза придает жесткость сферическим гранулам ультрогеля, в то время как их пористость определяет ПААГ. По химической и термической стойкости эта матрица сходна с агарозой; диапазон диаметров гранул — 60—140 мкм. Матрицы типа «Ultrogel AcA» с различным содержанием агарозы и ПААГ в виде водных суспензий поставляют фирмы «LKB» и «113F». Эти матрицы нашли применение не только для гель-фильтрации, но и для синтеза аффинных сорбентов на их основе.
Полистирольные смолы
Нити линейного полимера полистирола, химически «сшитые» молекулами дивинилбензола в жесткую пространственную сетку, выпускаются в виде 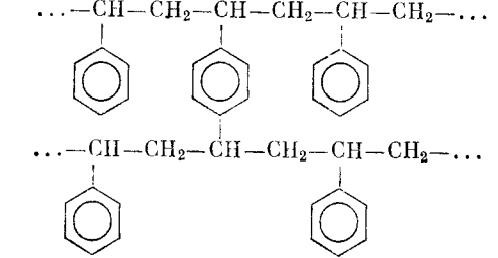
Содержание дивинилбензола варьирует от 2 до 12%, определяя средние размеры пор сетки. Эти размеры обычно малы, так что внутренний объем гранул полистирола доступен только для низкомолекулярных соединений (нуклеотидов, аминокислот, коротких пептидов и др.). Впрочем, имеются и «макроретикулярные» типы смол на основе полистирола; при их изготовлении микрогранулы смолы спекаются в гранулы обычных размеров (30—300 мкм). Внутренний объем таких гранул, представленный свободным пространством, остающимся между микрогранулами, доступен для биологических макромолекул.
Немодифицированные полистирольные смолы гидрофобны. Модификация осуществляется присоединением ионогенных групп по остаткам бензола в пара-положении. Это придает смоле в целом гидрофильность, хотя возможность и склонность к гидрофобным взаимодействиям с фракционируемым материалом сохраняется. Для хроматографии компонентов белков и нуклеиновых кислот в водных элюентах смолы на основе полистирола применяются только в качестве матриц ионообменников. Благодаря частоте расположения в пространстве остатков бензола эти матрицы отличаются высоким содержанием ионогенных групп. Химически они очень устойчивы (можно промывать 4 н. НС1 и 2 н, NaOH) и выдерживают нагревание до 120°C. При замачивании гранулы набухают, связывая (в зависимости от пористости) от 1 до 3 мл воды на 1 г сухой смолы. Макроретикулярные ионообменники на основе полистирола можно, вообще говоря, использовать для хроматографии белков, но при этом следует опасаться денатурации за счет гидрофобных взаимодействий белковых глобул с материалом матрицы.
Для липофильных белков мембран такое взаимодействие, по-видимому, опасности не представляет.
Наиболее популярные ионообменники на основе полистирола выпускаются под торговыми названиями «Dowex» (фирма «Dow Chemical Со») и «Amberlyte» (фирма «Rohm and Haas») и перепродаются большинством фирм, торгующих биохимическими реактивами. Хороню промытые и отсеянные обменники тина «Dowex» для аналитических целей поставляет фирма «Bio-Rad» под наименованием «Bio-Rad AG». Повышенные требования, предъявляемые к ионообменникам для современных аминокислотных анализаторов, привели к разработке специальных полистирольных смол («Aminex», «Durrum» и др.) с малым разбросом размеров около номинальных значений порядка 10—20 мкм. Для высокоэффективной хроматографии при высоких давлениях (ЖХВД) производят так называемые «пленочные ионообменники, у которых пленка полистпрольной смолы толщиной около 1 мкм фиксирована на поверхности стеклянных шариков диаметром 4 мкм («Whatman-Pellionex»).
Пористое стекло
Путем специальной обработки щелочно-боросиликатного стекла и последующей экстракции растворимого материала удается получить стеклянные шарики с хорошо контролируемым размером пор — типа CPG-10 («controlled pore glass»). В качестве матриц для гель-фильтрации они привлекательны своей жесткостью, химической инертностью и жаростойкостью (при стерилизации). Однако следует иметь в виду, что их поверхность несет небольшой отрицательный заряд и может сорбировать, а иногда и денатурировать белки. Пористое стекло, ассортимент которого включает 11 размеров пор (от 75 до 3000 А) и два, три или четыре диапазона диаметров шариков (от 20 до 400 МЕТИ), поставляется фирмами «BDH» («Glass granules CPG-10»), «Serva» («CPG-10») и «Sigma» («PG»). Последние две фирмы производят также пористое стекло, у которого поверхностный заряд блокирован химической присадкой глицеридов: «CPG-10 Polyol» («Serva») и «GG» («Glyceryl glass»; «Sigma»).
ПРИНЦИП ГЕЛЬ-ФИЛЬТРАЦИИ (подробно в картинках)
На колонку, упакованную сорбентом, наносят раствор образца.
Важно: лимитирующим является объем раствора образца; для аналитических разделений он не должен превышать 0,1% отCV (общего объема колонки), а для препаративной очистки он должен быть не выше 8-10% от CV; в противном случае разделения сложно будет достичь!
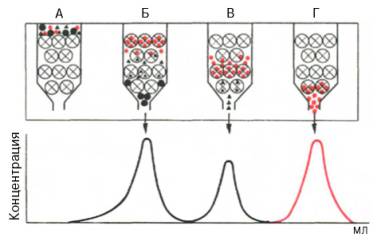
Раствор образца, допустим, содержит три типа веществ: высокомолекулярные, среднего размера и низкомолекулярные.
Высокомолекулярные не могут поместиться в поры сорбента, поэтому их объем удержания равен свободному объему колонки. Они элюируются первыми.
Средние частицы помещаются в поры сорбента, но не полностью. Поэтому их объем удержания немного выше свободного объема. Они элюируется вторыми.
Маленькие вещества долго путешествуют внутри пор сорбента, могут там заблудиться и найтись не скоро. Их объем удержания намного выше свободного (чаще всего их объем удержания приближается к общему объему колонки, т.е. 100% CV). Они вымываются последними.
МАТРИЦЫ ДЛЯ Гель-Фильтрации
Гель – гетерогенная система, в которой подвижная фаза (обычно водная) всегда находится внутри пор неподвижной фазы, называется гелевой матрицей



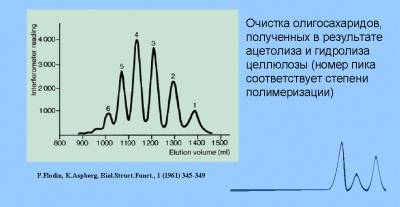
ОСНОВНЫЕ ОБЛАСТИ ПРИМЕНЕНИЯ.
Дата добавления: 2018-04-15 ; просмотров: 2923 ; Мы поможем в написании вашей работы!