на основании какого принципа возможна оценка скорости движения крови при ультразвуковом исследовании
Ультразвуковой метод определения скорости кровотока.



На рисунке 5. приведена схема измерения скорости кровотока на основе эффекта Доплера.
От генератора 1 электрических колебаний УЗ-частоты сигнал поступает на УЗ излучатель 2 и на устройство сравнения частот 3. Ультразвуковая волна 4 проникает в кровеносный сосуд 5 и отражается от движущихся эритроцитов 6. Отраженная ультразвуковая волна 7 попадает в приемник 8, где преобразуется в электрическое колебание и усиливается. 9 – Мягкие ткани, в глубине которых расположен сосуд.
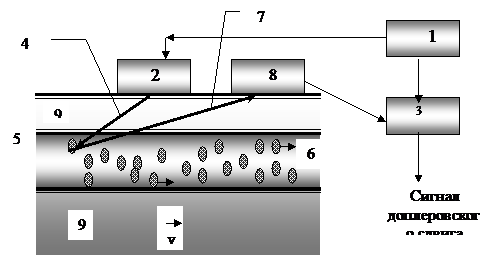 |
Рис. 5.. Схема установки измерения скорости кровотока на основе эффекта Доплера.
Усиленное электрическое колебание попадает в устройство 3. Здесь колебания, соответствующие падающей и отраженной волнам, сравниваются, и выделяется доплеровский сдвиг частоты в виде электрического колебания:
Из формулы можно определить скорость эритроцитов:

Основные принципы доплерографии
В последние годы возможности ультразвукового оборудования по визуализации потока (движущихся жидких сред) существенно расширились. Комплексы цветного представления теперь являются неотъемлемой частью большинства сканеров, а такие режимы, как Тканевый (TDI) или Энергетический Допплер (Power) обеспечивают новые возможности для визуализации исследуемых объектов на основе оборудования самых различных классов. При такой универсальности Допплеровских режимов на из основе неизбежно возникают методики для решения более требовательных задач и выполнения гораздо более точных измерений, например при исследовании кровообращения матери и развивающегося плода. Тем не менее, чтобы избежать неправильной интерпретации результатов, специалистам по ультразвуковой диагностике необходимо знать обо всех факторах, которые могут повлиять на допплеровский сигнал, будь то цветное изображение потока или допплероваская сонограмма.
Грамотное, компетентное применение методов ультразвуковой допплерографии подразумевает понимание трех ключевых аспектов:
Далее будет описано, как эти аспекты способствуют повышению качества визуализации в допплерографии. В тексте также приводятся базовые рекомендации по повышению качества визуализации в различных режимах представления движущихся сред.
Основные принципы допплерографии
Ультразвуковое изображение, как в цветном допплеровском картировании, так и в спектральном допплеровском режиме, получают на основе измерений скорости и направления движения различных частиц. Чтобы зафиксировать движение крови или других сред, ультразвуковые сканеры передают в ткани серию импульсов.
Возвращающиеся к датчику сигналы от неподвижного субстрата существенно не отличаются друг от друга в пределах одной серии импульсов.
Рисунок 1: Измерение скорости ультразвука. На схеме показана частица S, движущаяся со скоростью V под углом Ɵ к ультразвуковому лучу. Скорость может быть рассчитана по разнице во времени между передачей и приемом первого (t1) и второго (t2) лучей, вызванной перемещением частицы в области распространения луча.
Рисунок 2: Принцип допплерографии основан на измерении скорости движения частиц в области распространения луча по изменению Допплеровского фазового сдвига получаемого сигнала. Результирующая Допплеровская частота fd может быть использована для измерения скорости V, если известен угол Ɵ между УЗ лучем и потоком.
Как видно из рисунков 1 и 2, для возникновения фазового сдвига необходимо движение в направлении распространения луча; если поток движется перпендикулярно, относительное смещение частиц зафиксировать будет невозможно. Возвращаясь к математическому представлению процесса напомним, что Cos 90 и 270 равен 0, поэтому, при размещении датчика перпендикулярно к кровотоку мы не получим какого-либо отличного от 0 значения допплеровской частоты.
Амплитуда допплеровского сигнала зависит от нескольких аспектов:
Рисунок 3:Влияние угла допплера на вид сонограммы. (А) Чем больше направление УЗ луча соответствует потоку, тем выше допплеровская частота. На диаграмме луч (А) совмещен с кровотоком в большей степени, чем (B), при обработке его отражения мы получаем допплеровский сигнал с более высокой частотой. Угол между УЗ-лучем и направлением кровотока (С) близок к 90°, из-за чего допплеровский сигнал очень слаб. Кровоток на диаграмме (D) движется в противоположном относительно луча направлении, следовательно, амплитуда сигнала имеет отрицательное значение.
Все виды допплеровского ультразвукового оборудования используют фильтры чтобы исключить из итоговой диаграммы большие амплитуды низкочастотных допплеровских сигналов, получаемых при движении тканей, например, при движении стенок сосудов. Рабочая частота фильтра в большинстве случаев может быть изменена/задана пользователем (через панель Preset-настроек или при оптимизации изображения с помощью регуляторов суб-панелей), например, для исключения из сонограммы сигналов ниже 50, 100 или 200 Гц. Этот частотный фильтр ограничивает минимальные регистрируемые скорости движения субстрата (взвеси, кровотока).
Непрерывный (постоянный) Допплер CW (Continious Wave) и Импульсный Допплер PW (Pulsed Wave)
Как следует из названия, сканер при работе в Непрерывном Допплеровском режиме использует непрерывную (одновременную) передачу и прием ультразвука. Система формирует допплеровский сдвиг фаз на основе сигналов, получаемых от всех сосудов на пути ультразвукового луча (до тех пор, пока луч не будет достаточно ослаблен из-за глубины проникновения). В режиме непрерывного допплера невозможно определить конкретное местоположение точек со значениями скорости (т.е. невозможно построить градиент скоростей). Следовательно, данный режим не может быть использован для получения цветного двумерного изображения. В настоящий момент широкое распространение получили относительно недорогие системы допплерографии (УЗИ сканеры, укомплектованные соответствующими платами и пакетами прикладных программ), которые с помощью датчиков, предназначенных для подобных исследований выводят допплеровскую развертку, не используя двумерные изображения В-режима. Непрерывный допплер также используется в кардиологии (при исследовании взрослых пациентов) для измерения высоких скоростей кровотока в аорте.
Допплерография в целом и акушерские ультразвуковые исследования в частности также использует режим Импульсного Допплера, который позволяет проводить измерения глубины (или диапазона) участка потока. Кроме того, границы контрольного объема (или измерительных ворот) могут быть изменены. Импульсно-волновой допплероский режим используется как для построения доплеровских сонограмм, так и для формирования цветных изображений на основе двумерного представления B-режима.
Искажение
Рисунок 4: Искажения цветного доплеровского изображения и цветовые артефакты. На цветном изображении присутствуют области с искажениями кровотока (отмечены желтыми стрелками).
Рисунок 5: Снижение усиления по цвету и повышение частоты повторения импульсов.
Рисунок 6 (a, b): Пример наложения спектров и коррекция изображения. (a) Искаженная осциллограмма с резким прерыванием систолического пика и его отображением ниже базового уровня. (b) Чистая сонограмма без искажения. Для коррекции: увеличена частота дискретизации и скорректирована базовая линия.
Частота повторения импульсов ограничена диапазоном контрольного объема. Временной интервал между импульсами дискретизации должен быть достаточным для получения обратного пути импульса: от датчика к движущимся частицам и обратно. Если второй импульс отправлен до получения “ответа”, датчик физически не распознает различий между отраженными сигналами первого и второго импульсов, в следствие чего и возникает неоднозначность (искажение изображения).
При увеличении глубины исследования увеличивается и время импульса (временной интервал между отправкой сигнала и получением ответа), соответственно, снижается частота повторения импульсов. В результате максимальная Допплеровская частота ƒd понижается с глубиной.
Добрый день! Скажите, пожалуйста, можете ли помочь с настройкой картинки в режимах Допплера на этом аппарате. В последнее время заметили сильную разницу в картинке на нашем аппарате и новых (в использовании примерно год). Заранее спасибо!
Добрый день, Михаил Викторович.
Действительно, необходимо настраивать аппарат УЗИ каждые пол года, так как настройки могут сбиться. Наша компания оказывает данный вид услуг.
На основании какого принципа возможна оценка скорости движения крови при ультразвуковом исследовании
Неинвазивные технологии ультразвуковых методов определения сердечного выброса реализованы в ультразвуковых (УЗ) эхокардиографах. Они строятся на двух основных принципах.
Первый принцип основан на особенностях отражения ультразвуковой волны в неоднородных по плотности средах. На границе этих неоднородных сред происходит изменение мощности (амплитуды) отраженной волны. Коэффициент отражения (степень изменения мощности волны) зависит от разности сопротивления сред, обусловленных их плотностью (акустический импеданс). Даже ткани одного органа имеют разный акустический импеданс, и благодаря этому могут наблюдаться (проецироваться на экран монитора) раздельно, создавая конкретную картину внутрисердечной топографии. Потенциальная пространственная разрешающая способность метода определяется длиной волны зондирующего сигнала. Минимальный размер наблюдаемого объекта равен 1/4 длины волны.
Второй принцип основан на особенностях отражения ультразвуковой волны от движущихся объектов (движение крови, стенок сердца, клапанов). В результате прохождения ультразвука через движущуюся среду происходит изменение частоты отражения зондирующего сигнала. Частота увеличивается в случае встречного потока и соответственно уменьшается при согласном прохождении потока и сигнала (эффект Допплера).
Доплеровский метод измерения дает возможность различать объекты по их положению в пространстве и их скорости. Потенциально разрешающая способность по скорости определяется частотой зондирующего сигнала.
В современных УЗ эхокардиографах оба эти принципа объединены в единый технологический комплекс.
В соответствии с указанными принципами существуют два способа регистрации сердечного выброса.
Первый способ основан на определении объема левого желудочка. Измеряется площадь и длина полости левого желудочка во время систолы и диастолы сердца.
Объем полости желудочка рассчитывается по формуле:
V=0.85*A2*L-1, где
V — объем полости левого желудочка,
А — площадь левого желудочка,
L — длина полости левого желудочка.
Для более точного вычисления площади полости левого желудочка используется так называемый метод дисков. Измеряются и суммируются площади 20 уровней (срезов) полости левого желудочка. Этот метод применяется в случаях поражения миокарда, при которых в силу снижения сократительной способности в отдельных регионах желудочка площади могут быть неодинаковыми.
Систолический объем сердца и фракция выброса рассчитываются по формулам:
SV (мл) = Vd-Vs ФВ(%) = SV*Vd-1, где
SV — систолический объем сердца (stroke volume),
Vd — объем левого желудочка в конце диастолы,
Vs — объем левого желудочка в конце систолы.
Второй способ расчета сердечного выброса основан на измерении объемного кровотока через аортальный клапан (Допплер эхокардиография). Регистрируются линейные скорости перемещения крови и по интегралу линейной скорости кровотока определяется площадь под кривой допплерограммы.
Систолический объем левого желудочка рассчитывается по формулам:
SV= VTI*1/4D2 или SV= Vm*ET*1/4D2, где
SV — систолический объем левого желудочка,
VTI — интеграл линейных скоростей (площадь левого желудочка),
ЕТ — продолжительность изгнания крови из левого желудочка,
D — внутренний диаметр фиброзного кольца аортального клапана,
1/4 D2 — площадь фиброзного кольца аортального клапана.
В последнее время повышенное внимание привлекает так называемый трансэзофагеальный метод эхокардиографии. Принцип трансэзофагеального доплеровского мониторинга сердечного выброса, предложенный еще в начале 1970-х годов, подвергся существенному технологическому развитию и клинической оценке.
Метод предполагает наличие датчика, выполненного в виде зонда, который устанавливается в пищеводе на уровне сердца, что минимизирует помеховые сигналы от костей, мягкой ткани и легкого.
Несмотря на наличие потенциальных источников ошибок (точность положения датчика), отмечена высокая корреляция между данными, полученными трансэзофагеальным методом и традиционной термодилюцией.
Некоторые методы определения давления и скорости движения крови
Простейшим из таких методов является пальпаторный способ определения систолического артериального давления, предложенный Рива-Роччи. При его осуществлении на среднюю часть плеча накладывают компрессионную манжету. Давление воздуха в манжете измеряется с помощью манометра. Накачиванием воздуха в манжету давление в ней быстро поднимается до значения, превышающего систолическое. Затем воздух из манжеты медленно выпускают, одновременно наблюдая за появлением пульса в лучевой артерии. Зафиксировав пальпаторно появление пульса, отмечают в этот момент значение давления в манжете, которое и соответствует систолическому давлению.
Аускультативный метод реализуется в различных вариантах. В частности, в измерителях давления тоны Короткова могут восприниматься микрофоном, преобразующим звуковые воздействия в электрические сигналы, поступающие на регистрирующее устройство. На цифровом табло регистратора указываются значения систoлического и диастолического давления. В некоторых приборах изменения в движении стенок артерии при систолическом и диастолическом давлении (сопровождающиеся возникновением и исчезновением тонов Короткова) определяются с помощью ультразвуковой локации и эффекта Доплера.
Рассмотрим теперь основы некоторых физических методов определения скорости кровотока.
Метод, основанный на эффекте Доплера. Физическая основа этого метода была рассмотрена в разделе 9 части 1 этого пособия. Ещё раз подчеркнем, что его широкое клиническое применение обусловлено неинвазивностью, высокой точностью и возможностью использования для исследования различных гемодинамических процессов. В частности, поскольку ультразвуковая волна обладает малой длиной и, следовательно, может быть сфокусирована на малую площадь, становится возможным определять скорость крови локально в отдельных узких участках сосудистой системы и даже скорость движения различных слоёв крови в отдельном сосуде.
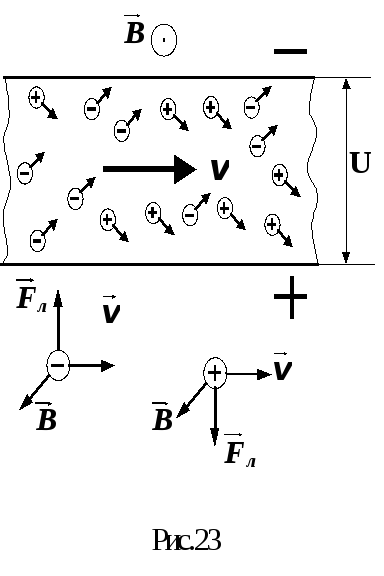
Поскольку в крови имеются положительные и отрицательные ионы, этот эффект проявляется и в движущейся по сосуду крови. Из измеряемой разности потенциалов можно определить линейную скорость кровотока.
Методы определения скорости движения крови, основанные на описанном принципе, удобно применять в тех случаях, когда возможен непосредственный контакт электродов соответствующего измерительного устройства со стенками сосуда (при использовании аппаратов искусственного кровообращения, гемосорбции, гемодиализа, в ходе хирургических операций).
Термоэлектрические методы основаны на измерениях степени нагрева тканей в зависимости от их кровенаполнения. Для измерения используются термоэлектрические датчики, в которых разница температур на концах термопары (два различных проводника спаянные своими концами) порождает электрический сигнал (термоэлектрический эффект). Температура одного из спаев поддерживается постоянной, а второй контактирует с поверхностью ткани. Изменения кровенаполнения вызывают изменения температуры контактирующего с тканью конца термопары и, следовательно, отражаются на величине возникающего электрического сигнала.
При использовании радионуклидных методов в кровь вводят определенное количество радиоактивного препарата. Концентрация этого препарата в крови зависти от степени его разбавления в объеме циркулирующей крови, доставляющей препарат к определенному участку организма. Чем больше объемная скорость крови, тем быстрее происходит разбавление. Содержание препарата устанавливается по измерению интенсивности гамма-излучения с помощью счетчика гамма-квантов. По изменению концентрации со временем после соответствующей обработки данных определяется скорость кровотока. Вместо радиоактивного вещества могут быть введены другие индикаторы (краситель, холодная жидкость и др.). Тогда степень разбавления индикатора, определяемая скоростью кровотока, находится путем быстрых заборов проб крови и их последующего анализа, либо фотоэлектрическими или термометрическими методами без заборов проб.
Методы векторной визуализации потока: инновационная ультразвуковая методика исследования кровотока
Авторы: Аlfredo Goddi, MD1, Marianna Fanizza, MD2, Chandra Bortolotto, MD2, Maria Vittoria Raciti, MD2,
Ilaria Fiorina, MD2, Xujin He3, Yigang Du, PhD3, Fabrizio Calliada, MD2
1 Медицинский центр SME-Diagnostica per Immagini, Варезе, Италия
2 Радиологический отдел, Fondazione IRCCS Policlinico San Matteo, Павия, Италия
3 Ультразвуковое отделение R & D, Shenzhen Mindray Bio-Medical Electronics Co., Ltd., Шэньчжэнь, Кит ай
ультразвук; доплерография, векторная визуализация потока (Vector Flow Imaging), визуализация плоской волны, сонная артерия.
РЕЗЮМЕ
Ультразвуковая доплерография обычно используется для выявления аномального кровотока. Тем не менее, обычная доплерография может использоваться для определения только осевой составляющей скорости кровотока и зависит от угла атаки. Был предложен новый многомерный метод, независимой от угла оценки скорости потока, который называется Vector Flow Imaging (VFI) – векторная визуализация потока. Эта методика количественно оценивает амплитуду и направление истинного вектора скорости в любом месте в сосуде и представляет более интуитивное описание движений потока. Высокая частота кадров при VFI, основанная на визуализации плоской волны, позволяет детально в динамике визуализировать сложные сосудистые профили гемодинамики, при этом демонстрируя даже переходные явления, которые в противном случае были бы неопределяемыми.
ВВЕДЕНИЕ
Ультразвуковая доплерография обычно используется для выявления аномального кровотока во многих сосудах, что основано на способности этой методики определять скорость и направление кровотока. Она основана на оценке сдвига частоты, которая возникает в случае, когда звуковые волны сталкиваются с движущимися объектами. Точность доплеровских исследований зависит от точного знания относительного направления сонографического пучка и кровотока в сосуде (т. е. от угла наклона датчика θ (угла инсонации)).
Стандартные доплеровские модальности включают цветную доплерографию, энергетическую доплерографию и спектральную доплерографию. Цветная доплерография оценивает среднюю скорость и направление крови в нескольких точках в интересующей области и кодирует ее как параметрическое цветное изображение. Это очень эффективно при обнаружении областей аномального кровотока, которые могут быть дополнительно исследованы с использованием спектральной доплеровской техники. Энергетическая доплерография похожа на цветную доплерографию, но при этом отображает интегральную мощность доплеровского сигнала, вместо его среднего доплеровского сдвига, что делает эту методики более чувствительной к низкоскоростному потоку, но не дает информации о его направлении. Спектральная доплерография отображает полный спектр скоростей по времени, однако она охватывает только небольшую зону диагностики. Однако цветные и спектральные доплеровские методики могут использоваться только для определения осевой составляющей скорости кровотока и зависят от угла наклона датчика. Они отображают неоднозначный сигнал при угле наклона датчика 90º, поэтому этот угол должен быть меньше 60º, для обеспечения точных измерений значений скоростей потока. Кроме того, цветная доплерография зависит от геометрии сосуда и построчного метода получения данных, что приводит к задержке данных о скоростях и ограничению по частоте кадров, что позволяет получать данные только с низким временным разрешением.
В системе кровообращения человека могут наблюдаться как ламинарные, так и более сложные типы кровотока. Ламинарный кровоток обычно возникает в периферических прямых кровеносных сосудах, но становится нестабильным в крупных сосудах, в зонах бифуркации и изогнутых сосудах. Это также происходит в случае положительного градиента давления и значительного замедления потока и на уровне атеросклеротических бляшек. Некоторые исследования показали, что образованию и росту атеросклеротических бляшек особенно подвержены сосуды, в которых могут быть обнаружены вихревые потоки. Такие сложные потоки не могут быть четко изучены при обычной доплерографии, поскольку она измеряет только линейную скорость, поэтому необходим новый усовершенствованный метод измерения потоков. Для оптимальной диагностики такая методика должна позволять получать как абсолютную величину скорости, так и направление потока.
В конце 1990-х годов был предложен новый метод многомерной оценки скорости потока, который был назван Vector Flow. С тех пор развиваются множество методов исследований, которые основаны на разных принципах. Используя и расширяя эти принципы, несколько производителей разработали различные методы векторной визуализации потока (VFI – Vector Flow Imaging), которые уже доступны для клинического применения преимущественно при исследовании сосудов.
VFI МЕТОДИКИ
Методика VFI – это инновационная техника, которая не зависит от угла наклона датчика и обеспечивает многомерную визуализацию скорости кровотока во всех направлениях (аксиальном и поперечном). При этом измеряются, по крайней мере, две из трех составляющих вектора скорости для расчета истинного вектора потока и самой величины скорости, что обеспечивает как пространственную, так и временную векторную информацию без необходимости какой-либо коррекции угла инсонации. VFI позволяет вычислять истинные векторы скорости в любом месте сосуда и отображать векторы скорости, распределение линии потока и распределение турбулентности.
Среди множества различных методов, предложенных для применения в диагностике сосудистой патологии, два были реализованы в коммерческих системах и подробно описаны в литературе. Первый основан на оценке фазового сдвига в поле поперечных колебаний (ТО – transverse oscillation field). Второй основан на визуализации плоской волны (PWI – plane wave imaging).
Метод TO использует одноматричный датчик для измерения двух специфических оценочных функций вектора скорости, аксиальной и поперечной составляющих, с использованием двух принимаемых концентраторов излучения. Может применяться расширенная техника с целью определения всех компонентов вектора скорости трехмерной волны, для этого используется третий концентратор излучения. Во время выполнения данной методики происходит излучение ряда последовательных импульсов, которые идентичны стандартной ультразвуковой доплерографии, а затем сравнивается разница от импульса к импульсу принятых сигналов с вычислением скорости. Чтобы уменьшить количество вычислений при оценке боковой скорости, из каждого пучка берутся только два измерения. Использование стандартного автокорреляционного подхода делает этот метод более надежным с точки зрения подавления шума в процессе измерения. Технология TO основана на стандартном процессе получения данных, и поэтому может быть легко реализована в режиме реального времени, подобно цветной доплерографии с относительно низкой частотой кадров (временное разрешение) около 15-25 Гц, которое иногда не позволяет адекватно обнаруживать в деталях все гемодинамические явления в соответствии с сердечным циклом.
Методы VFI, основанные на PWI, оценивают двухмерную векторную скорость потока с более высокой частотой кадров, что позволяет лучше описывать сложные потоки. При проведении PWI передается серия одиночных несфокусированных сонографических лучей, а не нескольких сфокусированных лучей. При использовании традиционной сфокусированной передачи обычно генерируется только один адекватный луч, тогда как более широкая область инсонации при каждой передачи импульсов, как в случае с PWI, позволяет создавать при приеме несколько параллельных лучей (рис. 1).
Рис. 1. Схема разнонаправленной передачи и приема сигналов последовательности сканирования, которая используется при векторном изображении потока на основе визуализации плоской волны.
Хотя на каждое генерируемое изображение влияет низкое контрастное и пространственное разрешение, значительное улучшение качества может быть достигнуто путем когерентной компоновки нескольких изображений плоских волн, сохраняя при этом частоту кадров, по меньшей мере, в 10 раз выше, чем при стандартном получении данных.
Число и углы передаваемых плоских волн и параллельное ретроспективное формирование луча, выполненное с нескольких углов, влияют на пространственно-временное разрешение PWI. Различные исследования, основанные на PWI методике, показали разную частоту кадров VFI, в зависимости от используемой техники получении данных. Например, исследование in vivo с использованием метода быстрой векторной скорости, использовало одну плоскую волну для отслеживания излучений и спеклов для оценки потока, предоставляя при этом истинную частоту кадров 100 Гц для получения изображения с высоким временным и пространственным разрешением. Другая методика, при которой выполняется двухмерное векторное картирование с использованием комбинированных копланарно ориентированных плоских волн, позволила обеспечить более чёткую картину динамики потока, чем обычная цветная доплерография, с частотой кадров примерно 500 Гц.
Решение, которое позволило обеспечить частоту кадров 416 Гц при VFI, называется векторной визуализацией движущейся частицы, получает истинные векторы скорости в любом месте при разнонаправленной передаче и приеме плоских волн. В частности, реальная скорость вектора, с величиной и направлением, вычисляется путем смешивания скоростей, исходящих из серии пучков по алгоритму комплексного углового компаундирования. При этом достигается непрерывная передача доплеровского сигнала, избегая переходного состояния, и, таким образом, может использоваться непрерывная фильтрация для удаления помех. Динамический поток получается путем постоянного обновления положения эритроцитов в сосуде в соответствии с рассчитанной скоростью. Для высокой частоты кадров VFI в коммерческой системе сфокусированные волны также используются для чередования с разнонаправленной передачей доплеровских сигналов для создания изображений в B-режиме с высоким разрешением.
Высокая частота кадров VFI, которая доступна в настоящее время только в одной коммерческой системе, представляет собой реализацию метода векторной визуализации движущейся частицы и генерирует частоту кадров 600 Гц, что позволяет детально описать сложный и нарушенный поток. Высокая частота кадров позволяет динамически визуализировать все гемодинамические явления, даже преходящие, которые в противном случае были бы неопределяемыми на протяжении всего сердечного цикл, при этом имеется возможность провести точное измерение их распространенность и продолжительность.
Рис. 2. Цветная доплерограмма бифуркации сонной артерии показывает реверсивный поток во внутренней сонной артерии (ICA), каротидного синуса и со стороны наружной сонной артерии (три пятна отмечены звездочкой *). Фактическое поведение потока не достаточно понятно из-за зависимости от угла инсонации.
CCA – общая сонная артерия; STA – верхняя щитовидная артерия.
По сравнению с цветным доплеровским изображением (рис. 2), наибольшими отличиями являются: методика проведения сканирования (плоская волна вместо построчного захвата), более высокая частота, независимость от угла ультразвукового луча, более точное отображение скорости крови (как величины, так и направления) и отображение гемодинамики, вместо менее точного отображения доплеровского потока (таблица 1).
Таблица 1. Сравнение цветной доплерографии и высокочастотной векторной визуализации потока (VFI).
| Параметры | Цветная доплерография | Высокочастотная VFI |
| Техника получения данных | Построчная | Многоракурсные плоские волны |
| Время сканирования | В реальном времени | 1,5 секунды |
| Частота кадров (в секунду) | 20-24 кадров в секунду | 400-600 кадров в секунду |
| Зависимость от угла наклона датчика | Зависима | Независима |
| Оценка скорости | Средняя скорость | Истинная величина скорости |
| Измерение вектора скорости | Аксиальный компонент | Аксиальные и боковые компоненты |
| Оценка направления потока | Однонаправленный | Разнонаправленный |
| Пространственное разрешение | + | + |
| Гемодинамика | + | + |
На основе этого подхода поток анализируется за 1,5 секунды (что позволяет изучать, по крайней мере, один сердечный цикл) на частотах повторения импульсов (ЧПИ) 10-15 кГц и при высокой частоте кадров (400-600 Гц, в зависимости от фактически используемой ЧПИ). Полученные данные обрабатываются сонографической системой, генерирующей последовательность из примерно 600-900 изображений, которые могут отображаться с частотой кадров 20-30 Гц и дополнительно анализироваться кадр за кадром при замедленном движении.
Независимо от технических решений для получения изображений VFI, общая обработка сигналов и изображение потока этих двух основных методов (TO и PWI) очень похожи (рис. 3).
| Многоракурсная Тх и Rx | Шаг 1: Техника поля поперечных колебаний (Т0), которая основана на построчном захвате, обычно предлагает только два угла атаки при приеме сигнала. Техника визуализации плоской волны (PWI) предлагает множество углов атаки при передаче и/или приеме, что улучшает временное разрешение. |
| Формирование луча | Шаг 2: Формирование луча легче реализуется при помощи T0, чем с PWI для изображения вектора потока (VFI). |
| Фильтр движения стенок сосудов | Шаг 3-4: Доплеровские сигналы извлекаются фильтром движения стенок сосудов, а скорость потока рассчитывается с помощью Lag-l автокорреляции. Это стандартная техника, которая может использоваться как для цветной доплерографии, так и для VFI. |
| Lag-l автокорреляция | |
| Комбинация углов | Шаг 5: При ТО технике вычисляются компоненты скорости, как в аксиальном, так и в боковом направлениях. PWI при многоракурсной передаче и/или приеме предоставляет каждый компонент скорости вдоль каждого направления распространения ультразвуковых волн при передаче и/или приеме. |
| Изображение вектора потока | Шаг 6: Векторные изображения потока отображаются тогда, когда известны все векторы скорости в интересующей области. |
Рис. 3. Общая диаграмма обработки сигналов для векторного изображения потока.
Для более интуитивного представления потока, отображается множество цветных стрелок, которые показывают как скорость, так и направление потока. Цвет и длина стрелки выражают величину скорости. В любой момент, и в любом месте сосуда может быть выведена скорость эритроцитов благодаря постоянному обновлению их положения (рис. 4).
Однако VFI техника также имеет ограничения. Любой метод, основанный на ЧПИ, в том числе VFI, страдает от сглаживания, что ограничивает возможность изучения потоков высокой скорости. Другим важным ограничением является то, что являясь двухмерным методом, он не позволяет точно оценить трехмерную форму линии потока.
ОСНОВНЫЕ КЛИНИЧЕСКИЕ ПРИМЕНЕНИЯ VFI
Изменения кровотока и процессы воспаления, помимо генетических и биологических системных факторов риска, считаются основными возможными причинами развития атеросклеротических поражений. Имеются данные о том, что гемодинамические характеристики определяют развитие атеросклероза: зоны поражения в основном расположены в артериальных ветвях и изгибах, где в основном и определяются локальные нарушения потока. Локальные механические и гемодинамические особенности, такие как: сдвиговое напряжение стенки, разделение потока, зоны рециркуляции и застоя, турбулентность, представляют собой дополнительные факторы, которые способствуют атерогенезу.
Таким образом, возможность правильно анализировать картину кровотока была бы важной предпосылкой для диагностики, особенно для раннего выявления патологии. Всесторонняя оценка кровотока должна отображать основные гемодинамические характеристики, а также ряд количественных параметров, таких как мгновенная скорость, направление скорости, сдвиговое напряжение стенки и объемный кровоток для каждой точки сосуда.
Техника VFI, благодаря своей независимости от угла направления луча и способности количественно оценивать векторы скорости, способна отображать реальные характеристики потока, превосходя обычные методы сонографии.
Клинические исследования, которые основаны на VFI, по-прежнему ограничены, поскольку подобные коммерческие системы только недавно были введены в эксплуатацию. Поскольку развитие атеросклеротических бляшек в зоне бифуркации сонной артерии чаще встречается при наличии вихревого потока, этот сосуд может представлять собой основную клиническую мишень. Предварительное исследование оценки скорости вектора крови in vivo на основе TO идентифицировало вихревой поток в сонной артерии у трех здоровых субъектов в фазе замедления после систолического пика, что подтвердило предыдущие экспериментальные исследования. Первое исследование in vivo было выполнено на 32 общих сонных артериях с помощью коммерческого сонографического аппарата, который был оснащенным прототипом программного обеспечения на основе TO. В этом исследовании были оценены множественные переменные, такие как пиковая систолическая скорость и конечная диастолическая скорость. При этом было показано, что параметры VFI сравнимы с обычной спектральной доплерографией при оценке угла кровотока. Первое исследование in vivo шести бифуркаций артерий в зоне каротидного синуса проводилось на экспериментальной системе, с помощью метода оценки быстрых векторов скорости, основанного на возбуждении плоской волны. Это исследование позволило визуализировать, в мельчайших подробностях, устойчивый вихревой поток во всех каротидных синусах. В другом исследовании, в котором исследовались 12 пациентов с заболеваниями сонной артерии, использовался исследовательский сканер, в котором была реализована методика двухугольной передачи плоских волн. Во время этого исследования были успешно получены как векторные изображения скорости, так и ретроспективно спектры скоростей. Недавнее клиническое исследование бифуркации сонной артерии, которое было основано на высокочастотной VFI, показало способность этой методики четко визуализировать поведение потока крови в различных зонах и состояниях анатомических структур, таких как: зона бифуркации сосудов, увеличение каротидного синуса, сужение сосудов и, главным образом, в случае вариабельных форм бифуркации сонной артерии. Это исследование также проанализировало взаимосвязь характера нарушения VFI потока с атеросклерозом. При этом было высказано предположение, что VFI имеет большой потенциал для лучшего понимания диагностической ценности сложных видов потока.
Некоторые исследователи предположили, что VFI может позволить проводить оценку сдвигового напряжения стенки сонной артерии. Однако, несмотря на то, что сдвиговое напряжение стенки, как известно, играет значительную роль при атеросклерозе, клиническое значение этой переменной еще не продемонстрировано. Тем не менее, мы считаем, что по сравнению с традиционными доплерографическими методами, дальнейшее усовершенствование коммерческих систем для измерения сдвигового напряжения, позволило бы более детально осмыслить эффекты сложных видов кровотока при формировании атеросклеротических бляшек.
Оценка артериовенозной фистулы (АВФ) для гемодиализа представляет собой новое клиническое применение VFI. Первое исследование, посвященное измерению объемного расхода в АВФ, показало, что VFI подходит для изучения этого показателя. В следующем исследовании было установлено, что измерения объемного расхода по методики TO во время диализа имеют точность 20%, по сравнению с 32%-ной точностью метода сонографического разведения, который является золотым стандартом. Затем авторы пришли к выводу, что VFI является допустимой техникой оценки объемного расхода и изменения объемного расхода в течении времени в АВФ. В ходе предварительного исследования с использованием высокочастотной VFI у 14 пациентов с аутогенными АВФ верхних конечностей было обнаружено нарушение потока с наличием векторов, направленных против стенок сосудов в 64,2% случаев. Они предположили, что сложная картина кровотока, обнаруженная при VFI, может быть причиной дисфункции эндотелиальных клеток и образования неоинтимальной гиперплазии. Они подчеркнули важность будущих исследований для подтверждения связи между нарушенным кровотоком и образованием стеноза во время формирования АВФ.
Хотя в нашей технической статье основное внимание уделяется исследованию сосудов, необходимо все же кратко описать возможности применения техники для оценки сердечной деятельности. Новое клиническое применение VFI – это точная оценка внутрижелудочкового вихревого потока, который лежит в основе тесной взаимосвязи между внутрижелудочковой картиной кровотока и функцией самих желудочков. Механизмы потока в левом желудочке уже последние несколько лет привлекают повышенное внимание кардиологов и стимулируют разработку новых методов, которые бы позволяли визуализировать движение потока крови внутри наполненных камер. Одним из ключевых аспектов кровотока внутри левого желудочка является развитие вихревого потока. Поэтому клиническая оценка картины вихревого потока является важным компонентом для понимания функции левого желудочка. VFI может также использоваться для изучения внутрисердечного кровотока через клапаны при их патологических изменениях, или при гипертрофической кардиомиопатии, для оценки взаимодействия между потоком внутри желудочка и движением створок. Разница между исследованиями сосудов и кардиодиагностикой заключается в специфике доступа при изучения сердца. Однако подробное описание этой методики выходит за рамки технической стороны этой статьи.
ЗАКЛЮЧЕНИЕ
VFI – эффективный метод для более точной оценки кровотока, в частности сложного потока. Данная техника позволяет провести количественное измерение скорости и направления на заданном участке сосуда, что может быть четко отображено графически. Высокая частота кадров VFI позволяет динамически визуализировать все явления потока, в том числе переходные явления, которые в противном случае были бы неопределяемыми. Эта новая информация может дополнять цветную и спектральную доплерографию в различных ситуациях. Объёмный расход и сдвиговое напряжение стенки – параметры, которые определяются при VFI и расширяют диагностические критерии при оценке сосудистой патологии. Для принятия VFI в качестве стандарта необходимо провести клинические многоцентровые исследования в большой популяции пациентов. В настоящий момент VFI остается двумерным методом и не позволяет точно понять реальную трехмерную форму линии тока, в то же время для количественного определения всего потока требуется трехмерная векторная оценка.