На основе чего сделан ковивак
Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная
| Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях медицинских организаций, имеющих право осуществлять вакцинопрофилактику населения в установленном законодательством порядке. |
Регистрационный номер
Торговое наименование
КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная)
Международное непатентованное или группировочное наименование
Вакцина для профилактики COVID-19
Лекарственная форма
Суспензия для внутримышечного введения
Состав на 1 дозу (0,5 мл)
| Наименование компонента | Количество |
| Действующее вещество: | |
| Антиген инактивированного коронавируса SARS-CoV-2* | не менее 3 мкг** |
| Вспомогательные вещества: | |
| Алюминия гидроксид | 0,3-0,5 мг |
| Буферный раствор (фосфатный) (динатрия фосфат дигидрат, натрия дигидрофосфата дигидрат, натрия хлорид, вода для инъекций) | до 0,5 мл |
* получен путем репродукции в перевиваемой культуре клеток линии Vero
** является величиной расчетной
Не содержит антибиотиков и консервантов.
Описание
Гомогенная суспензия белого цвета, при отстаивании разделяющаяся на бесцветную прозрачную жидкость и рыхлый осадок белого цвета.
Характеристика
Вакцина представляет собой очищенную концентрированную суспензию коронавируса SARS-CoV-2 штамм «AYDAR-1», полученного путем репродукции в перевиваемой культуре клеток линии Vero, инактивированного бета-пропиолактоном.
Фармакотерапевтическая группа
Код ATX:
Фармакологические свойства
Вакцина стимулирует выработку иммунитета в отношении коронавирусной инфекции, вызываемой коронавирусом SARS-CoV-2. Защитный титр антител в настоящее время неизвестен. Продолжительность иммунитета неизвестна. Клинические исследования по изучению протективной эффективности не проводились.
Показания к применению
Профилактика новой коронавирусной инфекции (COVID-19) у взрослых в возрасте 18-60 лет.
Противопоказания
С осторожностью
При хронических заболеваниях печени и почек, выраженных нарушениях нейроэндокринной системы, тяжёлых заболеваниях системы кроветворения, заболеваниях ЦНС (эпилепсии, инсультах и др.), сердечно-сосудистой системы (ИБС, миокардитах, эндокардитах, перикардитах), бронхолегочной системы (бронхиальной астме, ХОБЛ, фиброзирующих альвеолитах и др.), желудочно-кишечного тракта (при синдроме мальабсорбции и т.п), иммунной системы (при аутоиммунных и аллергических заболеваниях). Лечащий врач должен оценивать соотношение польза-риск вакцинации в каждом конкретном случае.
Применение при беременности и в период грудного вскармливания
Препарат противопоказан при беременности и в период грудного вскармливания, так как его эффективность и безопасность в этот период не изучались.
Способ применения и дозы
Прививки осуществляют при строгом соблюдении правил асептики и антисептики Вакцина предназначена только для внутримышечного введения. Вакцину вводят в дельтовидную мышцу (верхнюю треть наружной поверхности плеча) двукратно с интервалом 2 недели в дозе 0,5 мл.
Строго запрещено внутривенное введение препарата.
Ампула с вакциной не требует выдерживания при комнатной температуре. Перед инъекцией содержимое ампулы встряхивают, прививку проводят сразу после набора в шприц прививочной дозы.
Не пригоден к применению препарат в ампулах с нарушенной целостностью и маркировкой, при изменении физических свойств (интенсивное окрашивание, наличие механических включений), при истекшем сроке годности, неправильном хранении. Хранение вскрытой ампулы не допускается.
| Информация для медицинских работников, выполняющих вакцинацию лекарственным препаратом: данный лекарственный препарат зарегистрирован по особой процедуре регистрации, в связи с чем необходимо уведомлять Федеральную службу по надзору в сфере здравоохранения о каждом факте применения лекарственного препарата путем внесения информации в соответствующий раздел информационной системы ЕГИСЗ. |
Отсутствуют доступные данные по взаимозаменяемости вакцины КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная) с другими вакцинами для профилактики COVID-19 для завершения курса вакцинации. Лица, получившие одну дозу вакцины КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная), должны получить вторую дозу этой же вакцины для завершения курса вакцинации.
Побочное действие
В клинических исследованиях вакцины КовиВак и других инактивированных вакцин для профилактики коронавирусной инфекции наиболее частыми были местные реакции: боль (менее 15% от числа вакцинаций) и уплотнение в месте инъекции (до 1%), и общие реакции: головная боль (до 2 % вакцинируемых) и кратковременная гипертермия (до 1 %). Чаще выявлялись реакции легкой степени тяжести. Тяжелых местных и системных реакций на вакцинацию не было.
Побочные реакции могут появиться в 1-3 сутки после инъекции. Продолжительность реакций обычно не превышает 3-х суток. Не исключено также развитие аллергических реакций, синкопальных состояний (реакция на процедуру введения препарата) и увеличение лимфоузлов. Не исключено присоединение острых (например, ОРВИ и т.п.) или обострение хронических инфекционных заболеваний из-за временного напряжения иммунитета на фоне вакцинации. Литературные данные о выявленных нежелательных реакциях при применении инактивированных вакцин для профилактики новой коронавирусной инфекции свидетельствуют о хорошем профиле безопасности.
Указанные ниже побочные эффекты по данным клинического исследования приведены в соответствии с частотой их возникновения: очень часто (≥1/10), часто ( Общие реакции и реакции в месте введения:
Очень часто: боль в месте инъекции;
Часто: уплотнение в месте инъекции;
Нечасто: повышение температуры тела.
Нарушения со стороны нервной системы:
Часто: головная боль.
Передозировка
Потенциальный риск передозировки не изучен. Применение лекарственного препарата допускается квалифицированным медицинским персоналом в условиях лечебно-профилактических учреждений, риск передозировки крайне низок.
Взаимодействие с другими лекарственными средствами
Ввиду отсутствия данных исследований совместимости, вакцину КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная) нельзя смешивать с другими вакцинами или иными лекарственными средствами в одном шприце.
Особые указания
Инактивированные вакцины не противопоказаны пациентам с иммуносупрессивным или иммунодефицитным состоянием. Клинические данные применения лекарственного препарата у данной категории пациентов отсутствуют.
У пациентов, получающих иммуносупрессивную терапию, и пациентов с иммунодефицитом может не развиться достаточный иммунный ответ. Поэтому прием препаратов, угнетающих функцию иммунной системы, противопоказан как минимум 1 месяц до и после вакцинации из-за риска снижения иммуногенности.
Места, где проводится вакцинация, должны быть оснащены средствами противошоковой терапии на случай возникновения анафилаксии или другой тяжелой реакции гиперчувствительности после введения вакцины в соответствии с Приказом Министерства здравоохранения РФ от 20 декабря 2012 г. N 1079н «Об утверждении стандарта скорой медицинской помощи при анафилактическом шоке.
С целью выявления противопоказаний в день проведения вакцинации пациент должен быть осмотрен врачом: обязательным является опрос, общий осмотр и измерение температуры тела; в случае если температура тела превышает 37 °С, вакцинацию не проводят.
Вакцинированный должен находиться под медицинским наблюдением не менее 30 мин после вакцинации.
Проведенную прививку регистрируют в установленных учетных формах с указанием наименования препарата, даты прививки, дозы, номера серии, реакции на прививку.
Подобно остальным вакцинам, защитный иммунный ответ может возникать не у всех вакцинируемых лиц.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по изучению влияния вакцины на способность управлять транспортными средствами и потенциально опасными механизмами не проводились.
Форма выпуска
Суспензия для внутримышечного введения, 0,5 мл/доза.
По 1 дозе (0,5 мл) вакцины в ампуле объемом 1 мл, из стекла 1-ro гидролитического класса.
По 10 ампул вместе с инструкцией по применению и ножом ампульным, при необходимости, в пачке из картона коробочного.
Условия хранения
Хранить при температуре от 2 до 8 °С включительно. Замораживание не допускается.
Хранить в недоступном для детей месте.
Условия транспортирования
В соответствии с СП 3.3.2.3332-16 при температуре от 2 до 8 °С включительно. Замораживание не допускается.
Срок годности
6 месяцев
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Для лечебно-профилактических учреждений.
Производитель
ФГБНУ «ФНЦИРИП им. М.П. Чумакова РАН», Россия, г. Москва, поселение Московский, посёлок Института полиомиелита.
Владелец регистрационного удостоверения/Организация, принимающая претензии потребителя:
ФГБНУ «ФНЦИРИП им. М.П. Чумакова РАН», Россия
108819, город Москва, поселение Московский, посёлок Института полиомиелита, домовладение 8, корп. 1.
Вакцина КовиВак
Вакцина «КовиВак» защищает от инфекций:
Стоимость прививки КовиВак в Москве составляет 3000 руб. В цену включён осмотр врача перед вакцинацией.
Похожие вакцины (аналоги КовиВак):
| Вакцина | Цена |
|---|---|
| Спутник V «НИЦЭМ им. Н. Ф. Гамалеи» Минздрава России | 1500 ₽ |
| Спутник Лайт «НИЦЭМ им. Н. Ф. Гамалеи» Минздрава России | 2500 ₽ |
Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная
Торговое наименование
КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная)
Лекарственная форма
Суспензия для внутримышечного введения
Состав на 1 дозу (0,5 мл)
| Наименование компонента | Количество |
|---|---|
| Действующее вещество: | |
| Антиген инактивированного коронавируса SARS-CoV-2* | не менее 3 мкг** |
| Вспомогательные вещества: | |
| Алюминия гидроксид | 0,3-0,5 мг |
| Буферный раствор (фосфатный) (динатрия фосфат дигидрат, натрия дигидрофосфата дигидрат, натрия хлорид, вода для инъекций) | до 0,5 мл |
* получен путем репродукции в перевиваемой культуре клеток линии Vero
** является величиной расчетной
Не содержит антибиотиков и консервантов.
Описание
Гомогенная суспензия белого цвета, при отстаивании разделяющаяся на бесцветную прозрачную жидкость и рыхлый осадок белого цвета.
Характеристика
Вакцина представляет собой очищенную концентрированную суспензию коронавируса SARS-CoV-2 штамм «AYDAR-1», полученного путем репродукции в перевиваемой культуре клеток линии Vero, инактивированного бета-пропиолактоном.
Фармакотерапевтическая группа
Код ATX:
Фармакологические свойства
Вакцина стимулирует выработку иммунитета в отношении коронавирусной инфекции, вызываемой коронавирусом SARS-CoV-2. Защитный титр антител в настоящее время неизвестен. Продолжительность иммунитета неизвестна. Клинические исследования по изучению протективной эффективности не проводились.
Показания к применению
Профилактика новой коронавирусной инфекции (COVID-19) у взрослых в возрасте 18-60 лет.
Противопоказания
С осторожностью
При хронических заболеваниях печени и почек, выраженных нарушениях нейроэндокринной системы, тяжёлых заболеваниях системы кроветворения, заболеваниях ЦНС (эпилепсии, инсультах и др.), сердечно-сосудистой системы (ИБС, миокардитах, эндокардитах, перикардитах), бронхолегочной системы (бронхиальной астме, ХОБЛ, фиброзирующих альвеолитах и др.), желудочно-кишечного тракта (при синдроме мальабсорбции и т.п), иммунной системы (при аутоиммунных и аллергических заболеваниях). Лечащий врач должен оценивать соотношение польза-риск вакцинации в каждом конкретном случае.
Применение при беременности и в период грудного вскармливания
Препарат противопоказан при беременности и в период грудного вскармливания, так как его эффективность и безопасность в этот период не изучались.
Способ применения и дозы
Прививки осуществляют при строгом соблюдении правил асептики и антисептики Вакцина предназначена только для внутримышечного введения. Вакцину вводят в дельтовидную мышцу (верхнюю треть наружной поверхности плеча) двукратно с интервалом 2 недели в дозе 0,5 мл.
Строго запрещено внутривенное введение препарата.
Ампула с вакциной не требует выдерживания при комнатной температуре. Перед инъекцией содержимое ампулы встряхивают, прививку проводят сразу после набора в шприц прививочной дозы.
Не пригоден к применению препарат в ампулах с нарушенной целостностью и маркировкой, при изменении физических свойств (интенсивное окрашивание, наличие механических включений), при истекшем сроке годности, неправильном хранении. Хранение вскрытой ампулы не допускается.
Информация для медицинских работников, выполняющих вакцинацию лекарственным препаратом: данный лекарственный препарат зарегистрирован по особой процедуре регистрации, в связи с чем необходимо уведомлять Федеральную службу по надзору в сфере здравоохранения о каждом факте применения лекарственного препарата путем внесения информации в соответствующий раздел информационной системы ЕГИСЗ.
Отсутствуют доступные данные по взаимозаменяемости вакцины КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная) с другими вакцинами для профилактики COVID-19 для завершения курса вакцинации. Лица, получившие одну дозу вакцины КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная), должны получить вторую дозу этой же вакцины для завершения курса вакцинации.
Побочное действие
В клинических исследованиях вакцины КовиВак и других инактивированных вакцин для профилактики коронавирусной инфекции наиболее частыми были местные реакции: боль (менее 15% от числа вакцинаций) и уплотнение в месте инъекции (до 1%), и общие реакции: головная боль (до 2 % вакцинируемых) и кратковременная гипертермия (до 1 %). Чаще выявлялись реакции легкой степени тяжести. Тяжелых местных и системных реакций на вакцинацию не было.
Побочные реакции могут появиться в 1-3 сутки после инъекции. Продолжительность реакций обычно не превышает 3-х суток. Не исключено также развитие аллергических реакций, синкопальных состояний (реакция на процедуру введения препарата) и увеличение лимфоузлов. Не исключено присоединение острых (например, ОРВИ и т.п.) или обострение хронических инфекционных заболеваний из-за временного напряжения иммунитета на фоне вакцинации. Литературные данные о выявленных нежелательных реакциях при применении инактивированных вакцин для профилактики новой коронавирусной инфекции свидетельствуют о хорошем профиле безопасности.
Указанные ниже побочные эффекты по данным клинического исследования приведены в соответствии с частотой их возникновения: очень часто (≥1/10), часто ( Общие реакции и реакции в месте введения:
Очень часто: боль в месте инъекции;
Часто: уплотнение в месте инъекции;
Нечасто: повышение температуры тела.
Нарушения со стороны нервной системы:
Часто: головная боль.
Передозировка
Потенциальный риск передозировки не изучен. Применение лекарственного препарата допускается квалифицированным медицинским персоналом в условиях лечебно-профилактических учреждений, риск передозировки крайне низок.
Взаимодействие с другими лекарственными средствами
Ввиду отсутствия данных исследований совместимости, вакцину КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная) нельзя смешивать с другими вакцинами или иными лекарственными средствами в одном шприце.
Особые указания
Инактивированные вакцины не противопоказаны пациентам с иммуносупрессивным или иммунодефицитным состоянием. Клинические данные применения лекарственного препарата у данной категории пациентов отсутствуют.
У пациентов, получающих иммуносупрессивную терапию, и пациентов с иммунодефицитом может не развиться достаточный иммунный ответ. Поэтому прием препаратов, угнетающих функцию иммунной системы, противопоказан как минимум 1 месяц до и после вакцинации из-за риска снижения иммуногенности.
Места, где проводится вакцинация, должны быть оснащены средствами противошоковой терапии на случай возникновения анафилаксии или другой тяжелой реакции гиперчувствительности после введения вакцины в соответствии с Приказом Министерства здравоохранения РФ от 20 декабря 2012 г. N 1079н «Об утверждении стандарта скорой медицинской помощи при анафилактическом шоке.
С целью выявления противопоказаний в день проведения вакцинации пациент должен быть осмотрен врачом: обязательным является опрос, общий осмотр и измерение температуры тела; в случае если температура тела превышает 37 °С, вакцинацию не проводят.
Вакцинированный должен находиться под медицинским наблюдением не менее 30 мин после вакцинации.
Проведенную прививку регистрируют в установленных учетных формах с указанием наименования препарата, даты прививки, дозы, номера серии, реакции на прививку.
Подобно остальным вакцинам, защитный иммунный ответ может возникать не у всех вакцинируемых лиц.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по изучению влияния вакцины на способность управлять транспортными средствами и потенциально опасными механизмами не проводились.
Форма выпуска
Суспензия для внутримышечного введения, 0,5 мл/доза.
По 1 дозе (0,5 мл) вакцины в ампуле объемом 1 мл, из стекла 1-ro гидролитического класса.
По 10 ампул вместе с инструкцией по применению и ножом ампульным, при необходимости, в пачке из картона коробочного.
Условия хранения
Хранить при температуре от 2 до 8 °С включительно. Замораживание не допускается.
Хранить в недоступном для детей месте.
Условия транспортирования
В соответствии с СП 3.3.2.3332-16 при температуре от 2 до 8 °С включительно. Замораживание не допускается.
Срок годности
6 месяцев
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Для лечебно-профилактических учреждений.
Производитель
ФГБНУ «ФНЦИРИП им. М.П. Чумакова РАН», Россия, г. Москва, поселение Московский, посёлок Института полиомиелита.
Владелец регистрационного удостоверения/Организация, принимающая претензии потребителя:
ФГБНУ «ФНЦИРИП им. М.П. Чумакова РАН», Россия
108819, город Москва, поселение Московский, посёлок Института полиомиелита, домовладение 8, корп. 1.
Просьба, сведения о рекламации на качество препарата направлять в адрес ФГБНУ «ФНЦИРИП им. М.П. Чумакова РАН» (e-mail: sue_polio@chumakovs.su), о случаях повышенной реактогенности или развития поствакцинальных осложнений (ПППИ) направлять в службу фармаконадзора ФГБНУ «ФНЦИРИП им. М.П. Чумакова РАН» (е-mail: pv@chumakovs.su) и в Федеральную службу по надзору в сфере здравоохранения (в базу АИС Росздравнадзор extemal.roszdravnadzor.ru или e-mail: info@roszdravnadzor.gov.ru).
Узнать наличие вакцины КовиВак и записаться на прививку можно по телефонам центра:
Если хотите пригласить определённого специалиста, оставьте заявку и мы вам перезвоним!
А еще мы отвечаем на интересующие вас вопросы в специальном разделе! Чаще всего это вопросы индивидуального характера в отношении вакцинации, иммунитета и тому подобного.
КовиВак
«КовиВак» — вакцина от коронавируса, разработанная «Научным центром исследований имени М.П. Чумакова». На сегодняшний день является одной из трех вакцин, поступающих в регионы России для вакцинации от коронавируса.
Вакцина «КовиВак» зарегистрирована 20 февраля 2021 года. Поставки вакцины в гражданский оборот начались с 28 марта.
Вакцина «КовиВак»
Вакцина «КовиВак» для профилактики COVID-19 сделана из «убитого» коронавируса, не способного размножаться и инфицировать, но надежно формирующего иммунитет. Это отработанная в течение десятков лет технологическая платформа. С ее помощью создают вакцину от полиомиелита. «КовиВак» зарегистрирован в феврале этого года, в гражданский оборот поступило миллион доз.
Директор по качеству Федерального научного центра исследований и разработки иммунобиологических препаратов Александра Синюгина сообщила, что вакцина КовиВак, разработанная центром, на 98,4% защищает от заражения коронавирусной инфекцией и на 99,1% — от тяжелой формы течения болезни. Ранее генеральный директор центра Айдар Ишмухаметов заявил, что «КовиВак» эффективен от штамма коронавируса «дельта».
Вакцина
Разработчик
«Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М. П. Чумакова».
Производитель
«Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М. П. Чумакова», г. Москва, поселение Московский, посёлок Института полиомиелита, Россия.
Стадия
Регистрационное удостоверение ЛП-006800 19.02.2021.
25.09.2020 получено разрешение Минздрава России на клинические испытания вакцины. Безопасность исследовалась в рамках первой фазы исследований, когда были привиты 200 добровольцев. Нежелательных явлений после вакцинации у добровольцев не выявлено. Вторая фаза, в ходе которой Центр должен будет доказать эффективность разработанной вакцины, стартовала в декабре 2020 года в Санкт-Петербурге, Новосибирске и Кирове с участием 200 добровольцев. Вакцина официально зарегистрирована 20 февраля 2021 года. Первые поставки вакцины в гражданский оборот начались 28 марта. По состоянию на 6 апреля выпущено 70 тыс. доз. Плановое производство составит 1 млн доз в месяц.
02.06.2021 получено разрешение на проведение третьей фазы клинических исследований, в которых примут участие более 30 тысяч человек.
По данным Центра им. Чумакова на 23.09.2021, всего в гражданский оборот было выпущено 1,5 млн доз и планируется до конца года ввести дополнительно 2,5 млн доз. Третья фаза исследований проходит в Москве и Санкт-Петербурге. Кроме того, Центр Чумакова модернизировал производство, это позволит нарастить мощности в 2-2,5 раза.
Основная информация
Из чего состоит вакцина?
«КовиВак» относится к классическому типу вакцин — это цельновирионная инактивированная, она производится на основе цельного «убитого» (инактивированного) коронавируса SARS-CoV-2 с гидроксидом алюминия в роли адъюванта.
Опубликованы первые данные по инактивированной вакцине против COVID-19 «КовиВак»
Вступление
Продолжающаяся в настоящее время пандемия новой коронавирусной инфекции 2019 года (COVID-19), вызванная коронавирусом 2 тяжелого острого респираторного синдрома SARS-CoV-2, унесла более 4 миллионов жизней (по данным на март 2021 года [1, 2]), и необходимость быстрого внедрения безопасных и эффективных вакцин против данного вируса остается очень высокой. Беспрецедентное в новейшей истории повсеместное распространение пандемии требует применения всех существующих вакцинных платформ, чтобы в конечном счете обеспечить доступность вакцин против SARS-CoV-2 для жителей каждой страны мира.
SARS-CoV-2 относится к подроду Sarbecovirus рода Betacoronavirus и семейству Coronaviridae [3]; в качестве основного рецептора для проникновения в клетки человека вирус использует ангиотензинпревращающий фермент 2 (АПФ2) [4, 5]. Диаметр заключенного в оболочку вириона SARS-CoV-2 составляет 100–150 нм; сам вирион имеет сферическую форму. В нем содержится несколько структурных белков: шипиковый гликопротеин (S), мембранный белок (M), белок оболочки (E), расположенный на поверхности, и белок нуклеокапсида (N), который связан с РНК внутри вирусной частицы. S-белок представляет собой трансмембранный белок слияния I типа, который во время синтеза подвергается значительному гликозилированию; протеаза хозяина расщепляет его на два фрагмента — S1 и S2. Фрагмент S1 содержит рецептор-связывающий домен (РСД), который взаимодействует с рецептором клетки хозяина (т.е. АПФ2). Фрагмент S2 необходим для слияния мембран после еще одного расщепления протеазами клетки хозяина и дальнейших структурных перестроек [6]. Благодаря этим свойствам шипиковый белок и его РСД являются основными мишенями для нейтрализующих антител организма хозяина (НАт) в процессе развития иммунного ответа [7].
Иммунный ответ на инфекцию SARS-CoV-2 активно изучается с целью разработки и улучшения как диагностики заболевания, так и создания и совершенствования вакцин. Как было выявлено в ходе экспериментов, титры НАт являются одними из основных маркеров защиты от SARS-CoV-2, поскольку адоптивный перенос очищенных IgG, которые были получены от выздоравливающих макак-резусов, дозозависимо способствовал формированию иммунной защиты от заражения SARS-CoV-2 у наивных макак-реципиентов [8]. Легкая или средняя степень тяжести течения COVID-19 приводит к выработке НАт, концентрация которых коррелирует с титрами IgG к РСД, определенными методом ELISA; данные титры НАт сохраняются примерно от двух-трех [9, 10] до пяти месяцев [11]. Учитывая возможность снижения концентраций антител после заражения, пристально исследуется более трудный для изучения клеточный компонент иммунитета.
Для разработки вакцин против COVID-19 тестируются многочисленные методы. В настоящее время наиболее часто применяются инактивированные вирусные векторные вакцины, вакцины на основе нуклеиновых кислот (РНК, ДНК) и белковые (субъединичные, вирусоподобные (ВПВ)) вакцины [12]. В качестве основных антигенов, вызывающих синтез НАт, в большинстве вакцин используются S-белок и РСД. Различные передовые технологии разработки вакцин уже продемонстрировали свой потенциал в плане предотвращения развития COVID-19, и несколько таких препаратов, таких как вакцины на основе мРНК и аденовирусные векторные вакцины, после успешного завершения клинических испытаний были одобрены для использования по всему миру [13, 14]. Тем не менее, разработка инактивированных вакцин как более традиционный метод является надежным и экономичным способом, имеющим долгую и успешную историю применения [15, 16]. В Центре Чумакова на культуре клеток Vero были успешно разработаны две инактивированные вакцины против клещевого энцефалита и полиомиелита [22, 23]. Таким образом, вакцина против COVID-19 создавалась на основе ранее отработанной платформы для культивирования клеток с использованием уже отлаженных методов.
Во всем мире разрабатывается несколько инактивированных вакцин против инфекции SARS-CoV-2, и по крайней мере пять из них успешно прошли доклинические и клинические испытания, и их применение было одобрено [17–20]. Тем не менее, несмотря на множество высококачественных публикаций о клинических испытаниях различных вакцин, подробных сведений об общей токсичности, репродуктивной токсичности, профилактической эффективности, иммуногенности и устойчивости иммунного ответа на животных моделях крайне мало.
В данной работе авторы провели оценку безопасности, иммуногенности и устойчивости иммунного ответа на вакцину «КовиВак», созданную на основе цельного вириона, инактивированного β-пропиолактоном, у грызунов и нечеловеческих приматов. У исследованных видов животных не было обнаружено признаков острой/хронической, репродуктивной, эмбрио- и фетотоксичности, тератогенного действия, а также аллергенных свойств. Вакцина привела к формированию стабильного и сильного гуморального иммунного ответа как в виде специфических IgG к SARS-CoV-2, так и НАт у мышей линии BALB/c, сирийских хомячков и обыкновенных игрунок. В течение года титры НАт существенно не снизились. Профилактическая эффективность вакцины изучалась на сирийских хомячках. Надежность производственного процесса была продемонстрирована путем оценки четырех партий вакцины и сравнения их иммуногенных свойств на мышах.
Результаты
Производство и описание вакцины
Ранее был представлен процесс выделения и генетического описания вакцинного штамма AYDAR-1 [21]. Вирус удалось профильтровать на третьем пассаже и дополнительно очистить путем разбавления. Были созданы первичные, основные и рабочие посевные серии штамма (а именно пассажи под номерами 7, 8 и 9), которые были охарактеризованы в соответствии с национальными руководствами по производству вакцин.
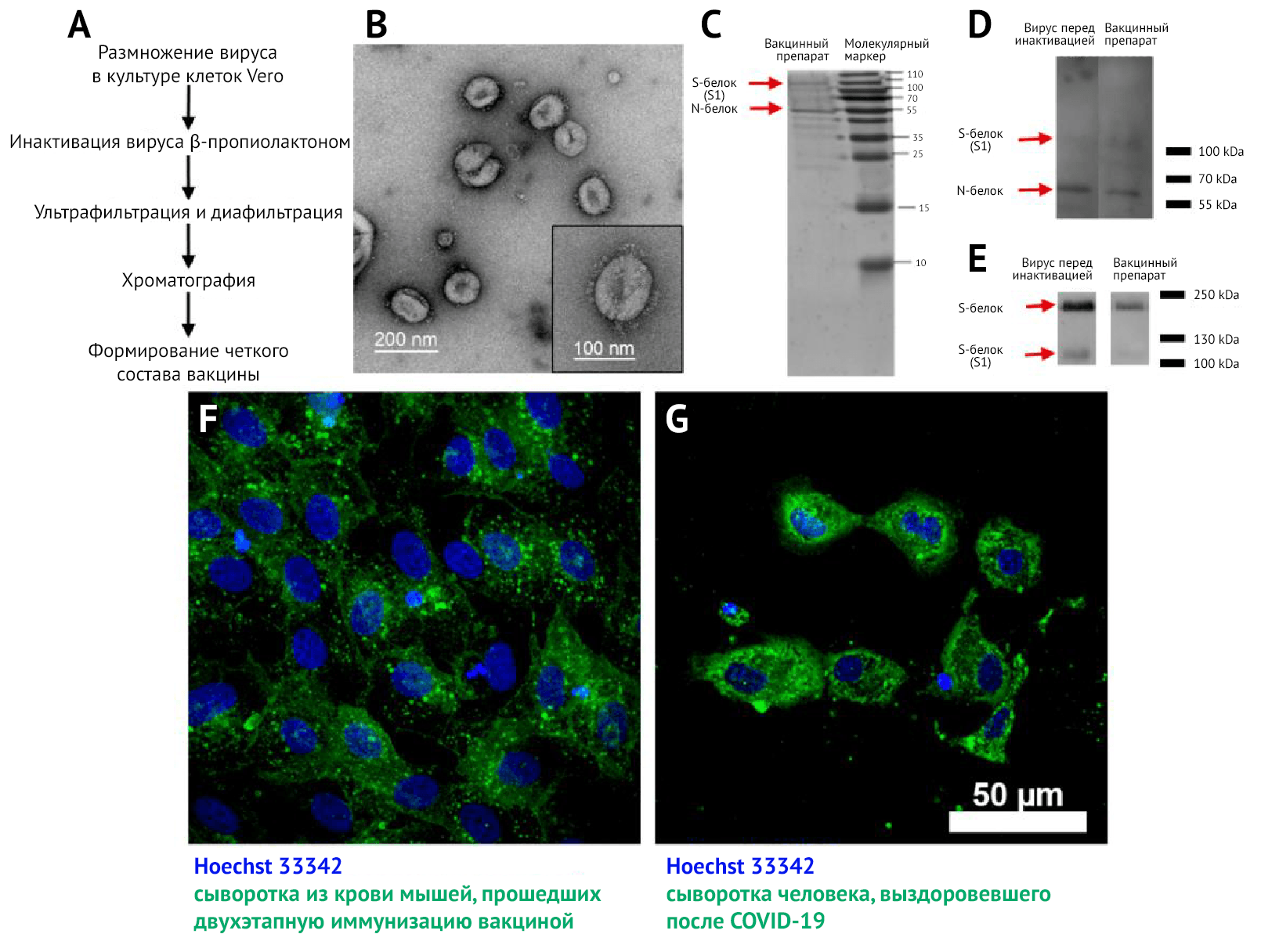
Благодаря трансмиссионной электронной микроскопии (ТЭМ) (рис. 1B) с негативным контрастированием концентратов были обнаружены плеоморфные сферические вирусные частицы диаметром около 120 нм, покрытые шиповидными структурами длиной 16–20 нм.
Методом ТЭМ (рис. 1B) были подтверждены гомогенность и чистота вакцинного препарата и выявлены вирионы с шипиковыми белками, соотносящиеся по форме и размеру с таковыми, выявляемыми в других исследованиях [26, 27].
В ходе электрофореза SDS-PAGE и вестерн-блоттинга (ВБ) концентратов вакцин перед инактивацией и после хроматографии, окрашенных сыворотками реконвалесцентов после COVID-19 (рис. 1 C и D), были выявлены два основных белка в концентратах: N и S, которые должны содержаться и в препарате вириона. С помощью окрашивания сывороткой анти-S-белка (рис. 1E) были обнаружены две формы S-белка в вирусных препаратах до и после инактивации: S1 и полноразмерный S-белок. Это свидетельствует о том, что в вакцинном препарате присутствует антиген-мишень для индукции синтеза НАт.
Специфичность реактивности антител подтверждается отсутствием свечения (флуоресценции) в неинфицированных клетках культуры Vero.
Изучение эмбрио-, фетотоксичности и тератогенных эффектов в антенатальном и постнатальном периодах развития
Беременные крысы линии Wistar (N = 60) были случайным образом распределены в три группы и иммунизированы внутримышечно на 2, 9 и 16 дни беременности. Крысам из первой исследуемой группы вводили одну дозу вакцины (6 мкг/доза; 0,5 мл), из второй — двойную дозу (12 мкг/доза; 1,0 мл), а из третьей контрольной группы — двойную дозу плацебо (1,0 мл). Ежедневно проводилось измерение массы тела и общего физического состояния животных; на поздних сроках беременности с помощью теста «открытое поле» оценивалась исследовательская активность и состояние самок. Прибавка в весе у самок проходила нормально; летальных исходов или признаков интоксикации не наблюдалось. Ни в одной из исследуемых групп не было признаков преждевременных или трудных родов. В тесте «открытое поле» на 18-е сутки беременности все самки крыс продемонстрировали преимущественно сбалансированный тип поведения с умеренной двигательной и поисковой активностью без признаков беспокойства.
Половину (N = 10 из каждой группы) животных в каждой группе умерщвляли на 20-й день беременности. Статистически значимых различий между исследуемыми группами по количеству желтых тел в яичниках, местах имплантации в матке, живым и мертвым плодам не было. Плоды сформировались нормально, топография всех исследованных органов была в пределах анатомической нормы, гистологическое строение соответствовало возрасту эмбрионов, развитие костей было нормальным. Патологических изменений органов и тканей обнаружено не было.
Другая половина (N = 10 из каждой группы) животных в каждой из трех групп вакцинированных была использована для выявления возможных нарушений эмбрионального развития, проявляющихся в постнатальном периоде. За потомством наблюдали в течение 60 дней после рождения. Проводилась оценка общего состояния потомства крыс, выживаемость, прибавка в весе, физическое развитие, сформированность сенсомоторных рефлексов, эмоционально-произвольного поведения и способности точно координировать движения. Соотношение самцов и самок в потомстве во всех группах было практически одинаковым (примерно 1: 1). Во всех исследуемых группах за весь период наблюдения (от рождения до двухмесячного возраста) смертность детенышей не превышала 4 % и достоверно не различалась между группами. В группах не было различий в физическом и неврологическом развитии детенышей крыс, а индивидуально обусловленные значения исследуемых показателей находились в пределах физиологической нормы.
Таким образом, вакцина «КовиВак» не оказала отрицательного влияния на общее состояние беременных крыс. Эмбриотоксических, фетотоксических или тератогенных эффектов обнаружено не было. Вакцинация не привела к увеличению смертности потомства и не повлияла на физическое и психологическое развитие детенышей крыс.
Обсуждение результатов
Безопасность
Существует множество тестов для оценки различных параметров безопасности разрабатываемых вакцин на животных моделях. Авторы выбрали классические модельные объекты для исследования безопасности (мыши, морские свинки, крысы и приматы). Для вакцины «КовиВак» проводилась оценка общей острой токсичности у трех видов (мышей, морских свинок и игрунок), хронической токсичности у двух видов (мышей и морских свинок) и гиперчувствительности у морских свинок. По сравнению с группой плацебо никаких изменений выявлено не было. Все показатели были в пределах физиологической нормы.
Существовали предположения о возможной репродуктивной токсичности вакцинных препаратов, содержащих S-белок SARS-CoV-2. Исходя из данных экспериментов авторов на крысах линии Wistar, был сделан вывод о том, что многократная иммунизация вакциной «КовиВак» до или во время беременности не оказывает отрицательного эффекта на внутриутробное или постнатальное развитие потомства.
Таким образом, вакцина «КовиВак» безопасна и может быть использована в клинических испытаниях на людях.
Иммунитет и его стойкость
Краткосрочная иммуногенность вакцины «КовиВак» была оценена на трех животных моделях (двух генетических линиях мышей, сирийских хомячках и обыкновенных игрунках), иммунизированных разными дозами. Вакцина индуцировала синтез НАт у всех изученных видов. Более того, у мышей были обнаружены антитела к двум основным структурным белкам вируса (S и N). В течение первых 2–4 недель не наблюдалось значительных различий между титрами НАт, синтез которых был вызван различными дозами антигена. Различия проявились начиная с пятой недели после первой иммунизации.
Как было отмечено выше, синтез НАт является одним из основных маркеров защиты от SARS-CoV-2 [8]. Следовательно, длительность антительного ответа (НАт) коррелирует с длительностью защиты. После естественного заражения, особенно в случае легкого течения инфекции, ответ в виде НАт довольно слабый и непродолжительный [11].
Сведений об устойчивости иммунитета, вызванного вакциной, очень мало. Хотя в опубликованных доклинических исследованиях показана индукция титров IgG и НАт к SARS-CoV-2 IgG вследствие введения различных вакцин, лишь в немногих работах содержатся данные о продолжительности иммунного ответа. Например, для препарата PiCoVacc (инактивированная вакцина), опубликованы результаты доклинических испытаний, согласно которым титр антител после вакцинации мышей и крыс сохраняется в течение шести недель, а у макак-резусов — до трех недель [25]. В работе, опубликованной Wang с соавт., анализ иммуногенности у животных был ограничен четырьмя неделями [27].
В случае вакцины-кандидата BBV152 измерение иммуногенности при трехдозовом режиме введения проводилось до 25-го дня [29]. Авторы провели оценку долгосрочной иммуногенности у мышей и игрунок в течение одного года. За этот период значительного снижения титров НАт обнаружено не было. Более низкие дозы вводимого антигена приводили к формированию более низкого титра НАт в течение длительного периода наблюдения. Хотя очевидно, что окончательные сведения о длительности иммунитета, обеспечиваемого вакцинами против COVID-19, будут получены в ходе длительных клинических исследований, в данной ситуации животные модели могут служить в качестве удобных суррогатных индикаторов на ранних этапах процесса разработки вакцины. В недавней работе, посвященной клиническому исследованию вакцины на основе мРНК компании Moderna, сообщается о существовании повышенного титра специфических антител в течение как минимум трех месяцев [30]. Согласно экспериментальным данным авторов статьи, вакцина «КовиВак» обеспечивала формирование стабильного длительного иммунитета у мышей и игрунок после двухкомпонентного режима введения препарата.
Профилактическая эффективность
В большинстве недавних исследований в качестве удобной и достоверно нелетальной животной модели профилактической эффективности вакцин против COVID-19 используется золотистый (сирийский) хомячок. У сирийских хомячков инфекция SARS-CoV-2 вызывает значительные патологические изменения в легких и, таким образом, поддерживает развитие стабильного постинфекционного гуморального иммунного ответа в экспериментах с пассивным переносом [35]. Более того, наблюдаемые иммуногистохимические изменения и характер потери массы тела у хомячков сходны с легкой формой инфекции SARS-CoV-2 у человека [36]. В ряде работ продемонстрирована пригодность сирийского хомячка в качестве модели для изучения профилактической эффективности НАт и вакцин против SARS-CoV-2 [37–46], хотя симптомы пневмонии у животного развиваются быстро и протекают тяжело.
Сирийский хомячок в качестве модельного объекта был использован для оценки профилактической эффективности нескольких инактивированных вакцин [47–48], в том числе одобренных для клинического применения [29]. К основным параметрам оценки относят вес животного и присутствие вируса и/или вирусной РНК в мазках из носа, легких и других органов в разные сроки после инфицирования.
В исследовании авторов животные из группы контроля теряли вес до пятого — седьмого дня с момента заражения, тогда как вакцинированные набирали вес с начиная с третьего дня после заражения, что соотносится с данными о BBV152 [29]. Однако потеря веса у контрольных животных в экспериментах авторов была более выраженной — 15 % против 2–10 % в исследовании BBV152. Скорость выведения вирусной РНК из верхних дыхательных путей также была сходной: начиная с седьмого дня после инфицирования в большинстве мазков из носа вирусная РНК не содержалась. Уровень вирусной РНК в легких контрольных животных был одинаковым в обоих исследованиях; по данным авторов, в органах всех контрольных животных содержалась вирусная РНК на четвертые, седьмые и 14-е сутки. Ткани легких вакцинированных животных в основном не содержали вируса: только у одного из пяти хомячков на четвертый и седьмой дни можно было выявить РНК вируса в легких; однако к 14-му дню ткань легких очищалась от вируса. Вирусная РНК была обнаружена в иных тканях (помимо легочной) у животных контрольной группы только на третий день после заражения. Аналогичные результаты были получены для вакцинного препарата BBV152 [29]. Таким образом, представленные результаты демонстрируют профилактическую эффективность вакцины «КовиВак» на модели сирийского хомячка.
Таким образом, для вакцины «КовиВак» не было обнаружено признаков острой/хронической, репродуктивной, эмбрио- и фетотоксичности или тератогенного влияния в антенатальном и постнатальном периодах развития, а также признаков гиперчувствительности у исследованных видов животных. Вакцина способствовала формированию стабильного и устойчивого гуморального иммунного ответа — как в виде специфических IgG к SARS-CoV-2, так и НАт у грызунов и обезьян. Значительного снижения титров НАт в течение одного года не наблюдалось. «КовиВак» продемонстрировала профилактический эффект по отношению к инфекции SARS-CoV-2 у сирийских хомячков. Эти данные стимулируют дальнейшее изучение вакцины «КовиВак» в клинических испытаниях.