Нативная плазма что это
Нативная плазма что это
Плазму можно получить:
• фракционированием дозы консервированной крови методом центрифугирования;
• на сепараторах (автоматический аферез);
• фильтрацией консервированной крови через специальные мембраны, задерживающие клеточные элементы;
• путем спонтанного оседания клеточной массы крови под действием силы тяжести (малоэффективен и практически не используется).
Из одной стандартной дозы крови — 450—500 мл получают 200—250 мл плазмы. Различаются два вида плазмы: нативная и свежезамороженная.
Практически всю плазму получают из консервированной крови в пределах 6 ч после забора крови. Полученная плазма сразу же подвергается глубокому замораживанию при температуре —45 °С. При —30 °С СЗП может храниться до одного года. Такие условия позволяют сохранить с минимальными потерями факторы V и VIII, а также другие неустойчивые факторы свертывающей системы крови.
Нативная плазма, так же как и СЗП, содержит весь комплекс стабильных и лабильных факторов гемостаза, фибринолиза, системы комплемента и пропердина, разномолекулярные белковые комплексы, обеспечивающие онкотическое давление; антитела и другие факторы, составляющие иммунологическую часть крови.
Белки плазмы обладают высокой иммуногенностью, что может явиться причиной сенсибилизации больных, особенно в результате многократных трансфузий. В период или непосредственно после трансфузии СЗП у больных, сенсибилизированных к белковым комплексам плазмы, могут возникнуть осложнения в виде анафилактических трансфузионных реакций. Больные с дефицитом иммуноглобулина А в этом отношении должны находиться под особым наблюдением, поскольку входят в группу повышенного риска предрасположенности к анафилактическим реакциям.
В рамках анализа лабораторных показателей в трансфузии СЗП нет необходимости (стандарты американских патологов, 1994) при условии, что:
• протромбиновое время превышено не более чем в 1,5 раза (> 18 с) среднего нормального показателя;
• активированное парциальное протромбиновое время (АПТВ) превышено не более чем в 1,5 раза верхней границы нормы (> 50-60 с);
• выявляется менее 25 % активности фактора свертывания. При назначении СЗП необходимо помнить, что:
• не определена эффективность СЗП у больных с тяжелым заболеванием печени при активном кровотечении;
• не определена роль трансфузии СЗП у больных, оперированных на печени, в послеоперационном периоде;
• СЗП не может корригировать коагуляционные нарушения, связанные с тяжелыми заболеваниями печени;
• в целях купирования кровотечения у больных с поражением печени необходимы большие объемы СЗП — не менее 5 доз;
• СЗП малоэффективна при лечении иммунодефицитных состояний;
• одна доза СЗП для лечения взрослого больного во многих случаях малоэффективна;
• СЗП не должна назначаться профилактически без лабораторных исследований;
• СЗП поддерживает коагуляционные тесты в нормальных границах у больных с дефицитом факторов XI, VII, V, протеина С, протеина S, антитромбина III (AT-III).
При лечении тромботической тромбоцитопенической пурпуры рекомендуется плазмообмен с замещением СЗП.
Гиповолемия не требует трансфузий СЗП. Безопаснее, дешевле и доступнее в этих случаях инфузии коллоидных кровезаменителей в сочетании с кристаллоидами и (или) растворов альбумина. При отсутствии активного кровотечения больной не должен получать СЗП, если протромбиновое время не более чем на 3 с выше верхней границы нормы.
Число патологических состояний, при которых установлена эффективность трансфузий СЗП, весьма велико. СЗП обладает большой лечебной эффективностью при кровотечениях и кровоточивости, вызванных дефицитом комплекса свертывающих факторов, коагулопатиями.
В нашей стране в условиях недостаточного количества специфических концентрированных компонентов плазмы, соответствующих фармакологических препаратов трудно переоценить значение трансфузий СЗП как эффективного лечебного средства при ряде заболеваний. Особо следует отметить следующее обстоятельство — основная масса данных об эффективности СЗП была получена в тот период, когда на рынке отсутствовали факторы гемостаза в виде лекарственных препаратов. В настоящее время в большинстве из перечисленных случаев при наличии препаратов плазмы (белковых и специфических концентратов факторов свертывания) и кровезаменителей использование СЗП можно ограничить, а в ряде случаев предпочтительно обойтись без трансфузий плазмы.
Плазма (Plasm) инструкция по применению
⚠️ Срок действия регистрационного удостоверения данного продукта истёк 29.12.11
Владелец регистрационного удостоверения:
Лекарственные формы
Форма выпуска, упаковка и состав препарата Плазма
Лиофилизат для приготовления раствора для инфузий в виде сухой пористой массы светло-желтого цвета.
| 1 фл. | |
| плазма крови человека | 14 г |
Лиофилизат для приготовления раствора для инфузий в виде сухой пористой массы светло-желтого цвета.
| 1 фл. | |
| плазма крови человека | 4 г |
Фармакологическое действие
Плазма оказывает гемодинамическое, дезинтоксикационное, стимулирующее действие, устраняет белковую недостаточность.
Показания препарата Плазма
Режим дозирования
Препарат применяют с учетом совместимости по группам крови АВО и резус принадлежности. В качестве растворителя используют воду для иньекций, раствор натрия хлорида изотонический 0,9 % или раствор глюкозы 5 % в количестве, указанном на этикетке с плазмой.
Перед растворением тщательно проверяют состояние укупорки, целостность бутылок с плазмой и растворителем, этикетки. Снимают покрытие с горла бутылки, колпачок обрабатывают 96 % этиловым спиртом, стерильным пинцетом отгибают его створки. Резиновую пробку смазывают раствором йода и прокалывают двумя короткими стерильными иглами. Одну иглу присоединяют к фильтру, другая соединяет бутылку с плазмой растворителем. Порошок плазмы можно разводить до разных концентраций, приготовляя по показаниям гипертонический, изотонический или гипотонические растворы.
Раствор плазмы не должен содержать хлопьев, сгустков, нерастворимых взвесей после фильтрации через стандартную систему для переливания крови. Раствор используют для переливания сразу после растворения. Перед переливанием плазмы проводят биологическую пробу на индивидуальную совместимость. С этой целью больному вводят 15-20 капель препарата, затем 10 мл и 20 мл с перерывом между каждым введением 3 минуты. При отсутствии реакции у больного вводят всю дозу.
Указанные растворы могут быть использованы при травмах черепа, протекающих с церебральной гипертензией, а также при травмах другой локализации, где противопоказано большое введение жидкости.
Для получения стимулирующего эффекта рекомендуется вливать по 100-250 мл плазмы (при необходимости повторно).
Побочное действие
В отдельных случаях возможно появление аллергических реакций, связанных с повышенной индивидуальной чувствительностью реципиента. В этих случаях следует прекратить трансфузию и, не вынимая иглы из вены, провести по показаниям симптоматическую терапию.
Противопоказания к применению
Условия хранения препарата Плазма
Нативная плазма что это
Донорство плазмы

Процедуру плазмафереза выполняют двумя методами: дискретным и аппаратным.
В настоящее время служба крови НМИЦ гематологии может заготавливать несколько видов плазмы:
Процедура автоматического плазмафереза состоит из 3—4 циклов, занимающих всего 30—40 минут, начинается с обработки локтевого сгиба, венепункции, взятия крови в пробирки для анализов, затем следуют следующие этапы:
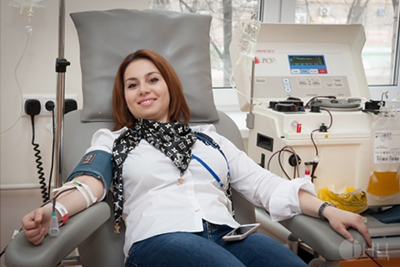
Аппараты снабжены системами безопасности, за их работой и состоянием донора наблюдают врачи-трансфузиологи и операционные сестры.
Следующая процедура разрешается через 14 дней. После 5 регулярных автоматических плазмаферезов следует перерыв 1 месяц, после 10 — 2 месяца.
Метод автоматического плазмафереза зарекомендовал себя как прогрессивный, его применение дает ряд преимуществ для донора и реципиента (больного, которому переливается плазма):
Плазму, полученную из дозы крови или методом автоматического плазмафереза, необходимо в течение 6 часов заморозить методом, обеспечивающим полное замораживание до –30 °C в течение 1 часа.

С учетом максимальной продолжительности латентного периода вирусного гепатита оптимально в течение 6 месяцев хранить свежезамороженную плазму (СЗП), полученную от доноров, обследованных в установленном порядке. Если по истечении этого срока данные лабораторных и клинических исследований донора остаются нормальными, плазма выдается для лечебного применения или фракционирования.
Максимальное время хранения свежезамороженной плазмы составляет 36 месяцев при температуре ниже –25 °C.
Процедура сдачи плазмы занимает примерно 40 мин, а общее время, которое вы у нас проведете — 1 ч 40 мин.
Плазмотерапия: методики и области применения
Обзор посвящен относительно новому методу регенеративной медицины — плазмотерапии. Приведены патогенетическое обоснование его лечебных эффектов, данные о разных методиках и результаты клинических исследований по изучению эффективности применения плазмотер
The review is devoted to plasmatherapy — a relatively new approach in the regenerative medical practice. Special attention is paid to the description of the pathogenic effects, variety of the modes of its application, as well as the results of clinical studies dedicated to the plasmatherapy effectiveness in various branches of medicine.
Регенеративная медицина — современное динамичное направление в терапии различных патологий, формирующееся на стыке биологии, биоинженерии и практической медицины. Методы регенеративной медицины направлены на стимуляцию процессов восстановления утраченной функции — либо через мобилизацию стволовых клеток самого организма, либо путем введения аллогенного (донорского) клеточного материала. В последнее время большое распространение получил метод плазмотерапии.
Понятие плазмотерапии и ее лечебные эффекты
Плазмотерапией называют использование в лечебных или косметических целях плазмы, полученной из аутологичной крови человека. Получение материала (плазмы) из собственной крови пациента обеспечивает безопасность лечения, так как в этом случае отсутствует опасность инфицирования и мутогенного эффекта.
Существует несколько методик плазмотерапии:
Лечебные эффекты плазмотерапии основываются на высвобождении из тромбоцитов — плоских безъядерных клеток, циркулирующих в кровотоке со сроком жизни 7–10 дней, в концентрации 150–400 тыс/мкл — различных факторов роста (ФР) — гормоноподобных полипептидов с широким спектром биологического действия, способных стимулировать или ингибировать митоз, хемотаксис, дифференцировку клеток. В цитоплазме тромбоцитов содержатся такие структуры, как электронно-плотные тельца, лизосомы и альфа-гранулы, в которых депонируется большое количество ФР, цитокинов, хемокинов и адгезивных белков (фибриноген, фибрин и др.). Основные ФР содержатся в альфа-гранулах и высвобождаются посредством экзоцитоза после активации тромбоцита и действуют локально, не существуя в свободной форме в кровотоке. К настоящему времени известно более 30 ФР; эффекты самых важных из них описаны в табл. 1.
Основными физиологическими активаторами тромбоцитов являются: коллаген (главный белок внеклеточного матрикса), тромбин (сериновая протеиназа, центральный фермент плазменной системы свертывания), АДФ (адениновый нуклеотид, который выделяется из разрушенных клеток сосуда или секретируется плотными гранулами самих тромбоцитов), а также тромбоксан А2 — липид из класса эйкозаноидов, синтезируемый и выделяемый тромбоцитами. Действие каждого из тромбоцитарных активаторов опосредуется через специализированные рецепторы в мембране тромбоцита. В последние годы было установлено, что Са 2+ также играет важную роль в активации тромбоцитов, поэтому для оптимизации высвобождения ФР наиболее часто используют хлорид (иногда глюконат) кальция или собственный тромбин. Активация также может происходить за счет механического или температурного воздействия. Активация плазмы приводит к высвобождению тромбоцитами ФР, а также к полимеризации фибрина, после чего из суспензии PRP образуется гель. Высвобождаемые ФР (естественные полипептиды) воздействуют на клетки-мишени с высокой аффинностью, создавая оптимальную среду для регенерации и репарации тканей. Известно, что лечебный эффект достигается при концентрации тромбоцитов в плазме от 750 тыс. до 1 млн клеток на 1 мкл плазмы.
Плазмолифтинг
.jpg)
Аутологичная плазма крови, обогащенная тромбоцитарными факторами роста (PRP)
Методика PRP более патогенетически обоснована, так как именно повышенная концентрация тромбоцитов, а не количество введенной плазмы запускает регенеративные способности организма. При PRP-терапии аутоплазма обогащается тромбоцитами за счет применения технологий «мягкого» центрифугирования в специальных пробирках в форме песочных часов.
В зависимости от биохимической структуры, получаемой с помощью различных методик и оборудования, PRP-продукты бывают нескольких видов:
1) PRP (Platelet Rich Plasma) — суспензия;
2) PRG (Platelet Rich Gel) — обогащенный тромбоцитами гель (активированная суспензия, в которой фибриноген преобразуется в фибрин в виде слабо сшитых волокон);
3) PRF (Platelet Rich Fibrin) — обогащенный тромбоцитами фибрин плазмы крови в виде сшитой фибриновой сети высокой плотности;
4) PRFM (Platelet Rich Fibrin Matrix) — представляет собой трехмерный фибриновый матрикс с высокой плотностью и степенью полимеризации фибрина за счет обогащения плазмы не только тромбоцитами, но и фибриногеном, с последующей активацией тромбоцитов. При этом сепарация клеточных компонентов происходит без использования антикоагулянтов.
Плотность препаратов (PRG, PRF) зависит от содержания в них фибриногена во время процесса концентрирования тромбоцитов и биохимической? структуры образующегося фибрина. Формирование же фибриновой сети происходит в результате активации тромбином фибриногена, концентрация которого сильно варьирует в зависимости от метода получения. Волокнистый белок фибрин выступает в качестве временной матрицы, которая обеспечивает поддержку при заживлении раны. Эта матрица способствует фильтрации и пролиферации клеток, то есть схождению краев раны и ее заживлению.
Получение PRP-продуктов
Согласно современной международной классификации, PRP подразделяют на различные разновидности в зависимости не от биохимической структуры, а от содержания тромбоцитов, лейкоцитов и фибрина, поэтому для обозначения различных методов получения PRP определенного состава используются коммерческие названия (табл. 2). Например, сертифицированный на территории Российской Федерации метод Endoret при отсутствии активации in vitro позволяет получить PRP с достаточно высоким содержанием тромбоцитов, низкой плотностью фибрина и отсутствием лейкоцитов. При применении клеточного сепаратора PRP содержание тромбоцитов в конечном продукте больше, чем при применении метода Endoret. При применении систем Vivostat PRF, PRGF Anitua, PRP Nahita тромбоциты в конечном продукте содержатся в малом количестве, лейкоциты отсутствуют, фибрин — низкой плотности. Коммерческие системы по получению L-PRP позволяют получать плазму с высоким содержанием и тромбоцитов, и лейкоцитов, но с низкой плотностью фибрина. Однако к настоящему времени для применения на территории РФ сертифицированы только системы Regen PRP и Ycellbiokit.
На территории США единственным методом, который зарегистрирован и разрешен Управлением по контролю за качеством пищевых продуктов и лекарственных средств (Food and Drug Administration, FDA) к использованию, является Fibrinet PRFM, позволяющий получить фибриновый матрикс, обогащенный тромбоцитами (PRF). Система состоит из двух пробирок. После забора крови и первого центрифугирования, без использования антикоагулянтов к плазме добавляют активатор (хлорид кальция). В результате происходит естественная полимеризация фибрина, с образованием сгустка PRF (обогащенного тромбоцитами фибрина), и высвобождение ФР; в зависимости от содержания лейкоцитов в сгустке выделяют L-PRF или P-PRF. После этого материал переносят в другую пробирку и повторно центрифугируют для образования прочного сгустка в виде трехмерной фибриновой сети — обогащенного тромбоцитами фибринового матрикса (PRFM). Высвобождение ФР происходит в течение 1 часа, потом тромбоциты «встраиваются» в фибриновую сеть, продолжая секретировать биоактивные вещества не менее 7 дней [1–3]. Считается, что такой трехмерный фибриновый матрикс является естественным «носителем» для тромбоцитов и ФР, интегрированных в фибриновую сеть во время полимеризации. PRFM способствует локальному увеличению концентрации ФР в очаге введения [4–6], что в совокупности с длительным секретированием ФР тромбоцитами способствует развитию устойчивого клинического эффекта.
Существуют общие принципы приготовления PRP. На первом этапе получения при центрифугировании кровь разделяется на 3 слоя (рис. 2):
Форма пробирки позволяет выделить PRP без смешения слоев. Далее к материалу добавляют антикоагулянты на основе солей цитрата натрия и раствора глюкозы — с аденином или без — для предотвращения спонтанной активации тромбоцитов, что важно для правильного приготовления PRP. Так как после однократного центрифугирования удается получить плазму с физиологическим (а не увеличенным) содержанием тромбоцитов, необходим второй этап центрифугирования. В зависимости от слоя, который будет отобран, получают чистую PRP (P-PRP) или PRP c лейкоцитами (L-PRP). При приготовлении обогащенной тромбоцитами плазмы (P-PRP) после забора верхнего слоя и верхней части промежуточного слоя материала в другую пробирку, оставшаяся плазма подвергается высокоскоростному центрифугированию, после чего клеточный осадок с большой концентрацией тромбоцитов (1/3 от получившегося продукта) повторно суспендируют. При заборе полностью верхнего и промежуточного слоев и последующем центрифугировании также получается клеточный осадок, но состоящий уже не только из тромбоцитов, но также и из лейкоцитов и небольшого количества эритроцитов, встречающихся в промежуточном слое; этот продукт и представляет собой плазму, обогащенную тромбоцитами и лейкоцитами: L-PRP. Активация P-PRP- и L-PRP-суспензий и преобразование их в гель отложена и происходит после контакта с тканями организма. Поэтому их иногда относят к «неактивированным» продуктам, имея в виду, что не происходит активации in vitro [7]. При добавлении активатора в пробирку после второго центрифугирования образуются P-PRP и L-PRP фибриновые гели, считающиеся активированными продуктами. Необходимо учитывать, что лейкоциты также высвобождают матриксные металлопротеиназы, например, коллагеназу и эластазу — цинк-зависимые протеолитические ферменты, способные разрушать компоненты межклеточного матрикса. Матриксные металлопротеиназы также участвуют в активации и деактивации хемокинов и цитокинов.
Области применения плазмотерапии
Плазмотерапия с успехом применяется в различных областях медицины. В травматологии PRP применяется при лечении артрозов, артритов, эпикондилитов, субакромиального синдрома, плантарного фасциита («пяточных шпор»); при этом реализуется спазмолитический эффект, восстанавливаются объем и состав суставной жидкости, активируется кровообращение в области пораженного сустава, укрепляются связки и мышцы, окружающие больной сустав. G. Bosh и соавт. в эксперименте с травмами сухожилий у лошадей исследовали влияние PRP на неоваскуляризацию и показали, что PRP способствует ангиогенезу [8].
В стоматологии метод плазмолифтинга успешно применяется для лечения воспалительных заболеваний — гингивитов, парадонтитов и др., а также при операциях удаления зубов и имплантациях. Уже через несколько процедур можно увидеть положительную динамику от лечения в виде улучшения показателей гигиенических и пародонтологических индексов, снижения кровоточивости десен [9, 10].
В 2016 г. на базе Сеченовского университета была доказана эффективность и безопасность применения аутологичной плазмы крови, обогащенной тромбоцитарными факторами роста для лечения эректильной дисфункции [11, 12]. В 2017 г. совместно с виварным экспериментальным комплексом МГУ им. М. В. Ломоносова начат доклинический эксперимент на крысах в области репродуктологии — оценка безопасности и эффективности применения PRP в различных модификациях для лечения мужского бесплодия [13.
Благодаря противовоспалительному, анальгетическому, противоотечному и гемостатическому эффектам PRP, сопоставимым с эффектом кортикостероидной терапии, данный метод нашел широкое применение в хирургии [14]. Способность запускать ангиогенез открывает новые возможности в кардиохирургии при введении PRP в очаги ишемизации у пациентов с инфарктом миокарда [15]. В офтальмологии PRP используют при лечении язв роговицы — показано, что аутоплазма, обогащенная тромбоцитами, способствует уменьшению воспаления, боли и субъективных ощущений [16]. Доказана эффективность PRP в составе комплексного лечения хронических заболеваний органов малого таза, сальпингоофоритов, эндометритов в гинекологии [17]. В 2017 г. B. Hersant и соавт. высказали положительное мнение о возможности применения PRP в микрохирургии [18].
Но, пожалуй, активнее всего аутологичная плазма крови, обогащенная тромбоцитарными ФР, используется в пластической хирургии, дерматологии и косметологии, так как очевидно, что ФР, цитокины и другие биологически активные вещества способны оказывать нормализующее влияние на процессы репарации и регенерации тканей. Поскольку ФР могут воздействовать на стволовые клетки в области фолликула волоса, стимулируя развитие новых фолликулов, способствуют неоваскуляризации и пролонгируют фазу анагеновой фазы роста волоса (период интенсивного деления клеток волосяного фолликула), PRP активно используется в трихологии. A. Trink с соавт. провели рандомизированное двойное слепое плацебо-контролируемое исследование на 45 пациентах по оценке безопасности и эффективности PRP при лечении очаговой алопеции [19]. Разным группам пациентов применяли либо аутоплазму, обогащенную тромбоцитарными факторами роста, либо триамцинолон ацетонид (ТА), либо плацебо. Каждая процедура выполнялась однократно раз в месяц — всего в течение 3 месяцев. У пациентов, кому вводили PRP, по данным дермоскопии значительно увеличился рост волос по сравнению с двумя остальными группами, при этом маркер пролиферации клеток Ki-67 у них был значительно выше, чем у остальных. Экспрессия ядерного антигена Ki-67 указывает на клетки, находящиеся в активной фазе клеточного цикла, то есть стремительно делящиеся. Также в группе больных, получавших PRP, полная ремиссия в течение 12 месяцев выявлена у 27 пациентов, в то время как при лечении ТА — у 12 пациентов. В последующие 6 месяцев в группе больных, получавших ТА, рецидив выпадения волос наблюдался у 17 больных, а в группе PRP — ни у одного из пациентов. Еще через 12 месяцев рецидив при лечении ТА обнаружен у 32 пациентов, а при лечении аутоплазмой лишь у 14 пациентов.
J. Donavan в 2015 г. опубликовал данные о случае успешного лечения офиазиса с использованием PRP. Эта форма гнездной алопеции характеризуется появлением очагов облысения в области затылка (или, иногда, в лобной области), которые, сливаясь, в виде ленты распространяются в сторону ушных раковин, достигая висков. Очень часто офиазис характеризуется торпидностью к проводимой терапии. В наблюдении J. Donavan длительность заболевания составила более 10 лет (рис. 3), заболевание было резистентно к лечению кортикостероидными препаратами и миноксидилу. При проведении PRP-терапии положительный эффект наблюдался уже после первой процедуры. PRP вводили однократно в месяц, всего 3 инъекции на курс лечения. Через 3 месяца длина волоса у пациентки составила 2,8 см. Авторы считают, что PRP может эффективно использоваться при лечении стероид-резистентных форм очаговой алопеции или при непереносимости стероидных препаратов [20].
В 2016 г. Thamer Mubki с соавт. также провели исследование эффективности PRP в лечении очаговой алопеции у пациентки с длительностью заболевания более 5 лет, которой проводилось лечение 0,05% клобетазола пропионатом, 2% миноксидилом, 2% кремом антралина. Эффективность данной терапии была признана недостаточной, так как был отмечен лишь частичный рост волос, в связи с чем пациентке был проведен курс лечения PRP и ТА на правую половину волосистой части головы; при этом на левую половину наносили только ТА. На правую половину волосистой части головы всего было проведено 8 процедур в течение 16 недель: по 4 инъекции PRP и ТА, на левую — только 4 инъекции ТА. Данные цифровой трихоскопии показали, что при использовании PRP и ТА увеличение количества волос составило 16% от исходных данных. Лечение ТА дало результат 12%. Однако при этом на правой половине головы (где применялись PRP и ТА) было отмечено увеличение среднего диаметра волоса на 35%, а на левой половине головы (лечение только ТА) — наоборот было отмечено уменьшение диаметра волоса. Таким образом, было констатировано, что лечение с применением аутоплазмы, обогащенной тромбоцитарными факторами роста, в комплексе с ТА дало лучшие результаты в лечении очаговой алопеции, чем терапия только стероидными препаратами (ТА) [21]. Также положительная динамика от терапии PRP отмечена при лечении андрогенной алопеции (АГА) в исследовании V. Cervelli и соавт. [22]. Было отмечено, что аутоплазма, обогащенная тромбоцитарными ФР, увеличивала транскрипционную активность β-катенина, являющегося белком сигнального пути Wnt, который определяет различные направления дифференцировки клеток. Также PRP увеличивала уровень антиапоптотических белков BCL-2, защищая клетки от апоптоза. Активация Akt- и ERK-сигнальных путей стимулирует перемещение β-катенина в ядро, обуславливая пролиферацию и дифференцировку клеток. Кроме того, PRP увеличивала экспрессию факторов роста фибробластов (ФРФ). Было обнаружено, что при лечении АГА особенно увеличивался уровень ФРФ-7, также известного как фактор роста кератиноцитов, который продлевал фазу анагена в цикле роста волос. Механизмы действия PRP при АГА описаны в табл. 3.
Метаанализ, проведенный в 2017 г. Salvatore Giordano и соавт., касательно применения PRP при лечении АГА показал, что данный метод клеточной терапии увеличивает количество волос, их структура становится толще при том, что побочные эффекты от малоинвазивной процедуры PRP минимальны [23]. Однако к настоящему времени еще не предложены конкретные стандартизированные протоколы приготовления PRP и лечения АГА аутоплазмой, обогащенной тромбоцитарными ФР.
Фото- и хроностарение кожи представляют собой полиэтиологические биологические процессы, при которых происходят изменения гомеостаза коллагена, основного структурного компонента кожи. Это приводит к нарушению опорного каркаса кожи, изменению ее морфологических свойств, формированию морщин. Источником коллагена являются фибробласты, которые помимо этого структурного белка вырабатывают практически все компоненты межклеточного матрикса дермы. Кроме того, они контролируют взаимодействие между кератиноцитами, эндотелиоцитами и обеспечивают гомеостаз и морфофункциональную организацию кожи [24]. Так как биоактивные вещества, вырабатываемые PRP, индуцируют пролиферативную и синтетическую активность фибробластов дермы, этот метод позволяет эффективно проводить коррекцию возрастных изменений кожи [25].
A. Redaelli с соавт. проводилась оценка эффективности применения PRP для коррекции морщин в области лица и шеи, а также рубцовых изменений кожи при постакне [26]. Под наблюдением в течение 3 месяцев было 23 пациента; контроль эффективности лечения проводился при помощи дерматоскопии и фотодокументирования. Был сделан вывод, что использование аутоплазмы, обогащенной тромбоцитами, приводит к улучшению текстуры кожи лица и шеи, уменьшению выраженности мелких морщин, выравниванию тона кожи и увеличению ее эластичности.
А. Sclafani проводил исследования по использованию обогащенного тромбоцитами фибринового матрикса PRFM с целью коррекции мелких, средних и глубоких морщин, а также субцизией рубцовой ткани [3, 5, 6]. Результаты показали визуально заметное уменьшение глубины морщин [3]. В другом проведенном исследовании А. Sclafani продемонстрировал выраженное уменьшение носогубных складок после 1 процедуры введения PRFM. Улучшение состояния кожи отмечалось через 2 недели после проведения инъекции, а эффект сохранялся более 10 недель [5]. По шкале оценке морщин WAS (Wrinkle Assessment Scale) средний показатель снизился на 2,12 ± 0,56 через 1 неделю. После 2, 6, и 12 недель показатель снижался на 0,97 ± 0,75, 1,08 ± 0,59 и 1,13 ± 0,72 соответственно.
Cabrera-Ramírez и соавт. в проведенном в 2017 г. исследовании приводят данные об уменьшении процессов фотостарения кожи рук при проведении процедуры PRP. Для определения результата была произведена биопсия кожи с дорсальной поверхности руки с целью проведения гистологического исследования. Данные показали увеличение числа фибробластов и коллагена, активацию ангиогенеза, что способствовало уменьшению проявлений старения кожи, количества морщин, снижению эластоза [27].
Н. В. Просянникова и соавт. доказали эффективность применения аутоплазмы, обогащенной тромбоцитарными ФР, в лечении хронических язвенных дефектов кожи, образовавшихся вследствие хронической венозной недостаточности или диабетической ангиопатии [28]. PRP оказала значительный эффект на длительно незаживающие раны в виде улучшения процессов регенерации, ускорения заживления дефектов. Гистологическая структура кожи стала более организованной и определенной, появились отчетливые признаки эпителизации. По данным бактериологического исследования снижался уровень микробной обсемененности. Авторы полагают, что PRP приводит к активизации местного иммунитета в ране, скорее всего, посредством привлечения в патологический очаг иммунных клеток. Тем не менее данная гипотеза требует дальнейшего исследования.
И. В. Фирсова и соавт. оценили эффективность PRP-терапии при эрозивно-язвенной форме красного плоского лишая слизистой оболочки полости рта [29]. В исследовании пациенты были разделены на две группы: в первой проводилась общепринятая медикаментозная терапия; во второй дополнительно применялась аутоплазма, обогащенная тромбоцитами. У пациентов второй группы уже через неделю была отмечена положительная динамика в виде улучшения показателей гигиенических и пародонтологических индексов, снижения размеров площади очагового поражения, активации эпителизации, исчезновения гиперемии и отечности слизистой оболочки, приобретения папулезным рисунком бледно-сероватого цвета. Данные цитологического исследования показали появление незрелых и зрелых форм метаплазированных клеток, что свидетельствует о повышении активности процесса регенерации эпителия. Также наблюдалось уменьшение количества нейтрофилов и кокковой микрофлоры, уменьшение признаков дегенеративных изменений в эпителиоцитах, а в последующем — более ранее увеличение количества эпителиальных клеток в сравнении с пациентами первой группы. При применении PRP процесс нормализации состояния эпителия слизистой оболочки рта в области очагов поражения протекал в более короткие сроки.
F. Casabona и соавт. (2017) полагают, что локальные инъекции PRP оказывают положительный терапевтический эффект при лечении склеротического лихена полового члена [30]. Они считают, что препаратами первой линии все же остаются кортикостероиды, однако аутоплазма, обогащенная тромбоцитарными ФР, способствует регенерации в местах рубцевания, уменьшает симптоматику и улучшает качество жизни. Необходимы дальнейшие исследования для оценки долгосрочных результатов.
Также описано применение различных терапевтических комбинаций плазмотерапии с другими лечебными факторами.
S. Tenna и соавт. в 2017 г. показали, что комбинация PRP с аутологичной жировой трансплантацией «Nano Fat grafting» совместно или по отдельности с лазерной шлифовкой может быть эффективна при коррекции атрофических рубцов после угревой болезни [32, 33]. Nano Fat grafting (микролипофилинг) представляет собой процедуру, при которой полученный аутологичный липоаспират проходит несколько этапов эмульгирования и фильтрации, а затем микроинъекционно вводится в корректируемые области. Как правило, зонами-донорами становятся колени и внутренняя поверхность бедра. В полученном образце практически отсутствуют зрелые адипоциты, однако имеется большое количество мезенхимальных стволовых клеток. Данная жидкая суспензия может быть введена в разные подкожные слои через тонкие иглы (27 G), такие же, как и при инъекции гиалуроновой кислоты, ботокса или инсулина [34]. Высвобождаемые факторы роста PRP при комбинированной терапии приводят к лучшему усвоению мезенхимальных стволовых клеток, увеличению пролиферации клеток и их дифференцировке. Результаты ряда клинических исследований показывают, что терапия методом микролипофилинга совместно с PRP приводила к увеличению толщины эпидермиса, усилению пролиферации фибробластов, увеличению синтеза коллагена [35–37]. Такая комбинированная терапия используется и при лечении хронических язв нижних конечностей [35].
M. Asif и соавт. изучали эффективность и безопасность применения PRP совместно с микроигольной терапией (Microneedling) для лечения рубцовых изменений после угревой болезни [38]. Принцип Microneedling заключается в инициировании синтеза коллагена. Это достигается за счет микроповреждений дермы с использованием микроигл — настолько тонких, что повреждение ткани незначительно, однако такое воздействие через «нервный стимул» активирует процесс заживления. При этом происходит высвобождение ФР, которые способствуют миграции фибробластов в очаг воздействия и стимуляции эндотелиальных клеток, что промотирует неоангиогенез. Кроме того, высвобождаемые из PRP ФР дополнительно стимулируют продукцию коллагена, запускают клеточную дифференцировку, а также оказывают противовоспалительный и антибактериальный эффект. Антибактериальное действие обеспечивается наличием в плазме антимикробных пептидов (фибринопептид A, фибринопептид B, тимозин b-4, основной белок тромбоцитов, активирующий соединительную ткань 3 пептид, RANTES, 4 фактор тромбоцитов) и содержащихся в L-PRP и L-PRF лейкоцитов, что оказывает прямой и опосредованный эффект за счет антиген-специфичных иммунных реакций. Данные эффекты дополнительно обуславливают эффективность комбинации PRP с травматизацией микроиглами [39, 40].
Совместное применение PRP c лазерной шлифовкой CO2-фракционным лазером описано в исследовании J.-I. Na и соавт. [41]. Лазерная шлифовка CO2-фракционным лазером часто используется с целью устранения морщин на лице. Однако нередко встречаются такие осложнения, как рубцевание и длительная эритема. В исследовании 25 пациентам была выполнена процедура с применением абляционного СО2-лазера на внутренние поверхности обеих рук для разглаживания морщин. После обработки лазером на одну руку местно наносили активированную хлоридом кальция PRP; поверхность кожи второй руки использовалась в качестве контроля. Исследование показало, что комбинация лазерной шлифовки СО2-фракционным лазером и PRP приводит к уменьшению выраженности побочных явлений от воздействия лазером (гиперпигментации, возникающей как следствие длительного воспалительного процесса, сопровождающегося выраженной эритемой). При гистологическом анализе, проведенном через месяц после процедуры, в срезах кожи, обработанных PRP, наблюдается большая толщина эпидермиса, более организованный роговой слой и толстые пучки коллагеновых волокон по сравнению с контрольными образцами. M. Shin и соавт. в аналогичном исследовании применяли комбинацию неабляционной лазерной шлифовки CO2-фракционным лазером и PRP с целью устранения морщин [42]. В результате в местах проведения комбинированной терапии наблюдалось большее количество фибробластов и большая плотность коллагена, чем в участках применения только лишь СО2-фракционного лазера. Также отмечены более высокие показатели эластичности кожи и, соответственно, выраженности моделирующего эффекта. Однако механизм действия PRP при применении ее после лазеротерапии до конца не изучен. Предполагают, что основную роль играют проангиогенные факторы, индуцирующие ангиогенез и регулирующие образование кровеносных сосудов, которые повреждаются под действием лазера [43]. Очевидно, что описанные лечебные комбинации при совместном применении оказывают синергическое действие, приводящее к более выраженному эффекту, чем достигаемый при использовании каждой из методик по отдельности.
Описано сочетание плазмолифтинга с введением ботулотоксина типа А [17]. По мнению Р. Р. Ахмерова, комбинация этих инъекций позволяет одновременно разгладить мимические морщины и улучшить качество кожи. Вместе с тем аутоплазма может быть полезна при коррекции побочных эффектов от избыточного введения ботулотоксина А (например, в виде опущения верхнего века), так как ее введение способствует улучшению кровоснабжения ткани и ускорению реиннервации. Также показана эффективность комбинации плазмолифтинга с контурной пластикой, филлерами на основе гиалуроновой кислоты, мезотерапией, биоревитализацией, интралипотерапией, химическими пилингами, нитевым лифтингом [17, 44].
Выводы
Таким образом, плазмотерапия представляет собой динамично развивающийся метод клеточной терапии, саногенетические эффекты которого востребованы в различных областях медицины. Наиболее активно происходит внедрение данной технологии в дерматовенерологию и косметологию, причем лечение плазмой все чаще применяется в качестве монотерапии. Однако метод остается все еще недостаточно полно изученным, к настоящему времени пока не накоплены достаточные статистические данные о результатах его применения и, соответственно, отсутствуют стандартизированные лечебные протоколы. Таким образом, дальнейшим направлением научного поиска в этой области является проведение полноценных долгосрочных двойных слепых рандомизированных плацебо-контролируемых исследований полезных свойств аутоплазмы, реализуемых посредством применения различных лечебных методик.
Литература
* ФГБОУ ДПО РМАНПО МЗ РФ, Москва
** ФГБОУ ВО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
*** ФГБОУ ВО РНИМУ, Москва
Плазмотерапия: методики и области применения/ И. В. Кошелева, Л. И. Шадыжева, Н. О. Переверзина, Н. А. Кливитская
Для цитирования: Лечащий врач № 1/2018; Номера страниц в выпуске: 59-66
Теги: косметолория, регенеративная медицина, плазма крови





_575.gif)
_575.gif)
.png)
.png)