Нбо у младенца что это
Для чего нужен неонатальный скрининг?
Врачи-неонатологи роддома больницы Вересаева рассказали, для чего нужен неонатальный скрининг, кому положен и когда проводится.
Неонатальный скрининг – важное обследование, позволяющее уже в первые дни жизни ребенка выявить серьезные врожденные патологии. Неофициально его называют «пяточным» тестом, поскольку кровь берется из пяточки и наносится на специальный тест-бланк.
Скрининг, который проводится в массовом порядке всем новорожденным, позволяет исключить такую пятерку серьезных заболеваний, как муковисцидоз (генетическая мутация, поражающая экзокринные железы органов дыхательной и пищеварительной систем); галактоземию (нарушение углеводного обмена), адреногенитальный синдром (нарушения, связанные с избыточной секрецией гормонов коры надпочечников), врожденный гипотиреоз (заболевание щитовидки) и фенилкетонурию (нарушение метаболизма аминокислот).
В Москве список расширен до 11 показателей, в него добавлена диагностика еще шести заболеваний из группы органических ацидурий, аминоацидопатий и нарушений обмена жирных кислот.
Все эти наследственно-генетические заболевания встречаются крайне редко, однако «поймать» их важно вовремя, поскольку их своевременное выявление позволяет избежать необратимых последствий и выбрать правильную тактику лечения.
Обычно скрининг делают в роддоме на четвертый день жизни младенца (для недоношенных малышей срок сдвигается), однако в Москве принята ранняя выписка: и мама с малышом (после естественных родов) могут оказаться дома уже на вторые сутки. Если тест не успеют провести в роддоме, то на руки родителям выдадут специальный бланк, где будет указана необходимость проведения скрининга. В таком случае анализ возьмет патронажная медсестра, которая придет навестить малыша в первые дни.
Анализ берут натощак после «голодной» паузы в три часа.
С февраля 2020 года расширенный неонатальный скрининг на 11 заболеваний доступен всем малышам, родившимся в Москве и получившим свидетельство о рождении в роддоме. Исследование проводится бесплатно.
Анализ готовится быстро. На связь с родителями специалисты выйдут только в случае, если какая-либо патология обнаружится. Однако большинство может забыть о тесте сразу после его выполнения, ведь частота встречаемости скринируемых заболеваний крайне мала.
Можно ли отказаться от неонатального скрининга?
Можно, но не стоит. Ведь именно в первые дни жизни малыша можно выстроить максимально эффективную схему лечения, которая в дальнейшем позволит ребенку избежать тяжелых осложнений и инвалидизации.
«Пяточный тест»: обычный и расширенный неонатальный скрининг
Неонатальный скрининг, известный как «пяточный тест» (или скрининг «пяточка», как называют его мамы) проводят всем новорожденным малышам без исключения. Анализ позволяет выявить наиболее распространенные генетические заболевания, которые представляют угрозу для жизни и здоровья ребенка.
Столь ранняя диагностика просто необходима, ведь дает возможность врачам своевременно начать лечение и избежать тяжелых осложнений. В России длительное время проводился неонатальный скрининг всего 5 наследственных заболеваний. Однако время не стоит на месте. С развитием новых технологий стало возможным расширить перечень болезней. Что сегодня включает «пяточный тест»?
Неонатальный скрининг: как проводится?
Обследование на генетические заболевания проводят детям в первые 10 дней после рождения. Забор капиллярной крови из пяточки выполняют медицинские сотрудники родильного дома или поликлиники доношенным детям на 4 сутки жизни, а недоношенным — на 7 сутки жизни.
Почему скрининг проводят так рано? Такие сроки обследования связаны с тем, что болезни, на которые проверяют малышей, дебютируют в первые месяцы жизни и угрожают развитием тяжелых необратимых осложнений.
Лечение, начатое до появления первых симптомов, увеличивает шансы на успех. Ребенок сможет полноценно расти и развиваться наравне со сверстниками.
Пребывая в хлопотах и заботах, родители порой забывают о том, что их малышу проводили скрининг. Действительно, ведь при отсутствии отклонений от нормы информировать их не принято. Зато при повышении того или иного показателя, у ребенка в кратчайшие сроки возьмут кровь на повторный анализ.
В дальнейшем, если диагноз будет подтвержден, то наблюдение и лечение будет осуществлять специалист в профильном учреждении.
Неонатальный скрининг: прошлое и настоящее
Неонатальный скрининг сейчас — это простой, доступный и перспективный метод обследования новорожденных для выявления тяжелых наследственных заболеваний.
Его история началась в 1960-х годах в США с проведения биохимического теста на выявление фенилкетонурии.
Затем технология распространилась во многих странах мира и стала основой для создания перечня генетических болезней, которые можно диагностировать у детей в первые дни после рождения.
Существуют определенные критерии, по которым заболевание включается в перечень для скрининга в стране:
Пожалуй, последний пункт особенно важен. Ведь основная цель неонатального скрининга — не столько выявить заболевание, сколько начать вовремя лечение, чтобы обеспечить полноценную жизнь ребенку.
На сегодняшний день неонатальный скрининг проводится более чем в 50 странах мира, а перечень насчитывает более 50-60 заболеваний.
При домашних родах или ранней выписке из родильного дома обследование тоже проводят. И пройти его нужно обязательно, это в интересах и родителей, и малыша.
Неонатальный скрининг: 5 основных заболеваний
В большинстве регионов России проводится неонатальный скрининг на 5 основных генетических заболеваний.
Характеризуется поражением центральной нервной системы. Единственный способ избежать тяжелых последствий — соблюдение диеты с низким содержанием фенилаланина уже с первой недели жизни ребенка.
Проявления заболевания разнообразны: от тяжелых нарушений водно-солевого обмена и полиорганной недостаточности до неправильного развития половых органов, маскулинизации и в дальнейшем бесплодия у девочек. В качестве лечения используется заместительная гормонотерапия.
При отсутствии должного лечения происходит задержка психомоторного и речевого развития, наступает отставание в физическом и половом развитии. Показана пожизненная заместительная терапия препаратами тиреоидных гормонов.
Основная роль в лечении отводится диете с пожизненным исключением продуктов, содержащих лактозу и галактозу.
Наиболее ярко болезнь проявляет себя со стороны органов дыхания — респираторная форма. Она дебютирует в раннем возрасте, проявляется частыми ОРВИ, бронхитами и пневмониями, сопровождается постоянным приступообразным кашлем с густой мокротой. В дальнейшем появляются и нарастают явления дыхательной и сердечной недостаточности.
Лечение муковисцидоза симптоматическое (единственное исключение из обязательной «пятерки» скрининга) направлено на снижение вязкости мокроты, восстановление проходимости бронхов и устранение инфекционного воспаления.
Скрининг новорожденных входит в программу ОМС и проводится бесплатно.
Расширенный неонатальный скрининг
Современная технология диагностики — тандемная масс-спектрометрия — позволила на порядок расширить перечень наследственных заболеваний, которые можно включить в программу скрининга новорожденных: болезни обмена веществ, гемоглобинопатии, спинальная мышечная атрофия, тяжелый комбинированный иммунодефицит и другие.
В Москве с 2018 года дополнительно включены 6 заболеваний, отвечающих критериям Всемирной организации здравоохранения:
Все эти заболевания со столь сложными названиями относят к врожденным болезням обмена веществ (ВБО) или врожденным аномалиям метаболизма.
Причина их появления — дефекты единичных генов, которые кодируют ферменты, способствующие превращению одних веществ в другие. В результате таких нарушений метаболизма происходит накопление токсических веществ, воздействующих на различные органы и ткани, и отмечается дефицит важных веществ.
25% всех врожденных болезней обмена веществ дебютирует уже в период новорожденности. При этом они протекают тяжело, часто скрываются под маской других заболеваний и могут привести к смерти ребенка без должного лечения.
Неонатальный скрининг позволяет предупредить дебют опасной болезни и вовремя начать терапию.
Все ВБО контролируются путем соблюдения соответствующей диеты, ограничивающей поступление в организм веществ, обмен которых нарушен. Или, наоборот, путем введения в организм недостающих метаболитов.
До внедрения технологии тандемной масс-спектрометрии в практику неонатального скрининга в Москве было проведено исследование в Свердловской области в 2012-2014 годах. Тестирование прошли более 150 тысяч новорожденных детей на 16 врожденных болезней обмена веществ. Всего было выявлено 9 больных детей, что составляет 1 случай на 1130 детей.
Результат близок к средней по стране распространенности этих заболеваний. Исследование доказало эффективность нового метода диагностики и возможность его внедрения в другие регионы страны.
Тяжелая комбинированная иммунная недостаточность — место в неонатальном скрининге
Первичные врожденные иммунодефициты характеризуются неспособностью организма противостоять микробам и вирусам. Это неизбежно приводит к частым инфекционным заболеваниям, протекающим тяжело, длительно, с осложнениями и необходимостью раз за разом принимать антибиотики.
Наиболее опасной формой первичного иммунодефицита является тяжелая комбинированная иммунная недостаточность (ТКИН), при которой у детей резко снижено число лимфоцитов.
Заподозрить врожденный иммунодефицит в первые месяцы жизни ребенка сложно, ведь какое-то время болезнь может ничем себя не проявлять или имитировать симптомы других более распространенных патологий. Однако именно время установления диагноза во многом определяет успех лечения.
Наиболее эффективный метод лечения детей с тяжелой комбинированной иммунной недостаточностью — это трансплантация гемопоэтических стволовых клеток. В случае ее проведения в возрасте до 3,5 месяцев и при отсутствии инфекционных процессов отмечается хороший результат.
Неонатальный скрининг на ТКИН уже проводится в США, Израиле, некоторых странах Европы, Ближнего Востока и Азии.
Внесение ТКИН в программу неонатального скрининга в нашей стране позволит на ранних сроках диагностировать тяжелый врожденный иммунодефицит, вовремя проводить соответствующее лечение и предупреждать инфекционные осложнения.
Скрининг новорожденным из пятки стандартный на 5 наследственных заболеваний и расширенный, 43 показателя
В детском медицинском центре «Санаре» проводится неонатальный скрининг на базе лаборатории Морозовской детской городской клинической больницы.

Суть скрининга в том, что выявляются достаточно часто встречающиеся в популяции заболевания, успех лечения которых целиком и полностью зависит от раннего начала терапии. В терапии этих состояний определяющую роль играет именно время и грамотный подход.
Согласно Приказу № 185 Минздравсоцразвития РФ от 22.03.2006 «О массовом обследовании новорожденных детей на наследственные заболевания», скрининг новорожденных проводится на 5 наследственных заболеваний:
Процедура забора крови для неонатального скрининга
Образец крови у новорожденного ребенка берется таким же способом, как для неонатального скрининга на фенилкетонурию, галактоземию, гипотиреоз, адреногенитальный синдром и муковисцидоз.
Исследование можно провести и для детей старшего возраста!
Если забор крови производится у ребенка старше 1 года, то кровь для проведения исследования берется из пальца.
Для новорожденного ребенка можно использовать пятна крови, которые были взяты для неонатального скрининга, у ребенка старшего возраста забор производится на специальный индивидуальный бланк-фильтр.
Диагностика и лечение недостаточности биотинидазы у детей раннего возраста
Наследственные болезни обмена (НБО) — обширный класс моногенных заболеваний, обусловленных нарушениями различных белков, выполняющих разнообразные функции в метаболизме клетки. Выделяют более 600 нозологических форм НБО, которые, в свою очередь, подраз
Наследственные болезни обмена (НБО) — обширный класс моногенных заболеваний, обусловленных нарушениями различных белков, выполняющих разнообразные функции в метаболизме клетки. Выделяют более 600 нозологических форм НБО, которые, в свою очередь, подразделяют в зависимости от пораженного метаболического пути на 22 подкласса. Суммарная частота НБО в популяции достаточно высока и составляет 1 на 3–5 тыс. живых новорожденных [1, 3]. БСльшая часть НБО, протекающих с поражением нервной системы, манифестирует в раннем детском возрасте и носит неуклонно прогрессирующий характер, приводя к тяжелой инвалидности и дезадаптации больных. Клиническая диагностика этих заболеваний представляет значительные трудности. Они связаны с малой распространенностью отдельных нозологических форм, отсутствием специфических симптомов на ранних стадиях заболевания (плохая прибавка веса, срыгивания, беспокойство, нарушения сна, мышечная гипотония/гипертония, слабость зрительного контакта, задержка психомоторного развития), выраженным клиническим полиморфизмом, наличием атипичных форм [2, 3].
До постановки правильного диагноза дети, как правило, наблюдаются в стационарах по поводу различных заболеваний: перинатальное поражение нервной системы, последствия внутриутробной инфекции, эпилепсия. Основными критериями, позволяющими заподозрить наличие заболевания из группы НБО, являются: дебют в определенном возрасте, прогрессирующая задержка психомоторного развития; судороги, плохо поддающиеся коррекции с помощью базовой антиэпилептической терапии. Кроме того, при некоторых болезнях происходит вовлечение в патологический процесс других органов и систем (гепато- и спленомегалия, поражение кожи и ее придатков) [2, 3]. Приоритетную роль в их диагностике играют биохимические и молекулярно-генетические методы исследования.
На протяжении последних 200 лет, вплоть до 30-х гг. ХХ в., выявление наследственного заболевания было равносильно приговору для больного и его семьи, а эмпирические попытки лечения пациентов с этими тяжелейшими недугами являлись безуспешными. В начале 1930-х гг. впервые в мире невролог и генетик С. Н. Давиденков, основываясь на собственном клиническом опыте и достижениях экспериментальной генетики, указал на ошибочность мнения о неизлечимости НБО. Однако отсутствие сведений о патогенетических механизмах развития этих заболеваний в тот период ограничивало возможности разработки методов их лечения, и все подобные попытки, несмотря на правильные теоретические установки, оставались длительное время эмпирическими [1]. В настоящее время благодаря успехам генетики в целом и существенному прогрессу теоретической и практической медицины многие НБО лечатся с помощью ферментзаместительной или специфической терапии [1, 18]. В частности, речь идет о таких заболеваниях, как фенилкетонурия, лейциноз (болезнь «мочи с запахом кленового сиропа»), гликогенозы, лизосомные болезни накопления (болезнь Гоше, болезнь Фабри), гомоцистинурия, недостаточность биотинидазы (НБ) и др. [11]. Поэтому вопросы ранней диагностики, лечения и профилактики этих недугов имеют не только большое медицинское, но и социально-экономическое значение [5, 17].
Недостаточность биотинидазы
Недостаточность фермента ведет к нарушению освобождения биотина из пищевого белка и рециркуляции эндогенного биотина. Активность биотинидазы в головном мозге человека крайне низка, поэтому для нормального функционирования нейронов необходимо достаточное и постоянное поступление биотина через гематоэнцефалический барьер. Уменьшение концентрации биотина при НБ на первых стадиях заболевания приводит к снижению активности пируваткарбоксилазы, что вызывает накопление лактата в головном мозге. Этот локальный лактат-ацидоз обусловливает появление в первую очередь неврологических симптомов [12]. Кетоацидоз является признаком продолжительной недостаточности биотина в организме и может не выявляться на начальных этапах заболевания. Причиной нейросенсорной тугоухости является накопление органических кислот, биоцитина и более крупных биотинильных белков [19]. Снижение уровня протективных жирных кислот, возможно, является причиной появления алопеции и кожной сыпи [11].
Клинические проявления
НБ манифестирует в среднем в 3–5,5 мес жизни. В редких случаях заболевание дебютирует в подростковом возрасте или на первой неделе жизни. Степень тяжести клинических проявлений заболевания зависит от уровня активности биотинидазы. Так, высокая остаточная активность фермента (от 25 до 30% от нормы) характерна для юношеских форм НБ [21]. При тотальной НБ (активность фермента менее 5% от нормы) заболевание манифестирует в первые месяцы жизни.
В раннем возрасте наиболее частыми начальными симптомами являются судороги: миоклонические, генерализованные или парциальные [9]. Иногда основным клиническим симптомом служит мышечная гипотония. В ряде случаев НБ манифестирует задержкой психомоторного развития, нарушениями ритма дыхания (дыхание по типу Куссмауля, ларингеальный стридор, апноэ), себореей, атопическим дерматитом, гнездной и/или тотальной алопецией, персистирующими конъюнктивитами, нейросенсорной тугоухостью [4, 8, 10, 13, 20].
У большинства пациентов имеет место сочетание неврологических и кожных нарушений. При дебюте заболевания в подростковом возрасте начальными симптомами являются мышечная слабость, спастические парапарезы, зрительные нарушения (снижение зрения, появление скотом, атрофия зрительных нервов) [14, 15].
В результате проведенных нами исследований за 2 года удалось выявить трех пациентов с точно верифицированным диагнозом: недостаточность биотинидазы. Диагноз был подтвержден биохимическими и молекулярно-генетическими методами: тотальное снижение активности биотинидазы в сыворотке крови, метаболического ацидоза, повышение уровня специфических органических кислот и концентрации лактата в крови и ликворе. При проведении ДНК-диагностики было установлено, что два пациента являются гомозиготными по мутации G98d7i3, а один — компаунд-гетерозиготой по частым мутациям G98d7i3/R538C. Известно, что наличие этих мутаций в любом сочетании сопровождается ранней и тяжелой манифестацией НБ [7].
В качестве иллюстрации приводим выписку из истории болезни одного из наблюдавшихся нами больных.
Больной Л. К., 5 мес, находился в отделении психоневрологии и эпилепсии РДКБ. Поступил с жалобами на судороги по типу серийных инфантильных спазмов, задержку психомоторного развития, снижение слуха, повышенную потливость.
Из анамнеза известно, что ребенок родился от 2-й беременности, протекавшей на фоне угрозы прерывания на 7–8-й неделе, роды первые, на 39-й неделе беременности, самостоятельные, вес при рождении 2900 г, рост 51 см, оценка по шкале Апгар — 9–10 баллов. Выписан из роддома на 5-е сутки жизни в удовлетворительном состоянии. Перенесенные заболевания: отит, конъюнктивит. С рождения отмечался тремор ручек и подбородка. В 2 мес появились серийные, флексорные, симметричные инфантильные спазмы до 10 раз в сутки. Проводился подбор противосудорожной терапии без явного положительного эффекта. На фоне гормональной терапии синактеном депо судороги стали реже, но сохранялись до 5–7 раз в сутки.
При поступлении — состояние средней тяжести. Кожные покровы чистые, сухие. Видимые слизистые бледно-розовые. Волосы на голове тонкие и редкие. Подкожная жировая клетчатка развита избыточно. Развернута нижняя апертура грудной клетки. Носовое дыхание свободное. Границы сердца не увеличены. Сердечные тоны ритмичные, шумов нет. В легких дыхание пуэрильное, хрипов нет. Живот мягкий, безболезненный, доступен глубокой пальпации. Печень: + 1 см из-под края реберной дуги, селезенка не увеличена. Наружные половые органы развиты по мужскому типу.
Неврологический статус: общемозговых и менингеальных симптомов нет. Сознание ясное. Форма головы округлая с выступающими лобными буграми. Окружность головы – 42 см.
Глазные щели — OD=OS, взор фиксирует, кратковременно прослеживает, зрачки округлой формы, симметричные, фотореакция сохранена, лицо симметричное, снижение реакции на звуковые раздражители, нистагм установочный в крайних отведениях, глоточные и небные рефлексы живые, дисфония, саливация не усилена. Голову не держит, поворачивается на бок с трудом. Мышечная гипотония, с умеренным повышением мышечного тонуса в дистальных отделах конечностей. Сухожильные рефлексы симметричные, живые. Патологические рефлексы — с двух сторон. На болевые раздражители реагирует. Задержка редукции безусловных рефлексов: ладонно-ротовой (+), Переса (+), Галанта (+).
В сознании, на осмотр реагирует адекватно, дифференцирует окружающих, успокаивается на руках у мамы.
При клиническом анализе крови и мочи отклонений от нормы не выявлено.
Ультразвуковое исследование внутренних органов: без патологии.
Электроэнцефалографическое исследование: типичных данных о наличии локальной, диффузной и генерализованной эпилептиформной активности за время данного исследования получено не было.
Компьютерная аудиометрия: регистрируется снижение слуха по типу нейросенсорной тугоухости I–II степени.
Офтальмоскопия: частичная атрофия зрительных нервов.
 |
| Рисунок 1. МРТ головного мозга пациента Л. К., 5 мес |
МРТ головного мозга: на сериях сагиттальных, фронтальных и аксиальных МР-томограмм в режимах Т1 и Т2 на фоне резко расширенных субарахноидальных конвекситальных пространств лобных, теменных, затылочных и височных областей и базальных цистерн отмечается хроническая субдуральная гематома обоих лобных и верхних отделов височных областей. Признаков кровоизлияний в вещество головного мозга не выявлено. Заключение: признаки задержки миелинизации мозгового вещества. Хроническая субдуральная гематома указанной области (рис.1).
Обследование в лаборатории наследственных болезней обмена веществ ГУ Медико-генетического научного центра РАМН показало снижение активности биотинидазы — 0,56 (4,40–12 нмоль/мин/мл).
К проводимой антиэпилептической терапии добавлен биотин в дозе 10 мг/сут. Спустя 2 нед после назначения биотина состояние улучшилось: ребенок стал держать голову и переворачиваться со спины на живот, судороги купированы, отметилась тенденция к нормализации биохимических показателей.
При повторном поступлении через 3 мес на фоне специфической терапии отмечалась положительная динамика: отсутствие судорог, ребенок хорошо переворачивается со спины на живот и наоборот, дифференцирует окружающих, улучшились слух, зрение и рост волос на голове, активный лепет, уровень лактата и органических кислот в норме (табл.).
Клинические проявления у всех обследованных нами больных достаточно сходные: начало болезни в первом полугодии жизни, сочетание неврологических нарушений с поражением кожи и ее придатков (алопеция, дерматит), судороги, не поддающиеся коррекции базовыми антиэпилептическими препаратами.
После установления диагноза всем пациентам был назначен биотин в суточной дозе 10 мг/сут, продолжалось проведение противосудорожной терапии. Через 1,5–2 нед от начала лечения отмечался парадоксальный эффект в виде регресса выявляемых до лечения расстройств. Судороги не возобновлялись (за исключением пациента Л. С., у которого диагноз был верифицирован на поздних стадиях болезни). Больные дети стали постепенно приобретать психомоторные навыки и проявлять реакцию эмоционального оживления на осмотр: улыбка, способность зрительного сосредоточения на лицах, улучшился мышечный тонус, отмечен рост волос (рис. 2). Столь высокая эффективность специфического лечения может объясняться нормализацией метаболических процессов в организме, что совпадает с данными литературы [6].
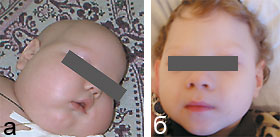 |
| Рисунок 2. Пациент Л. С. до терапии биотином (а) и после (б) |
Хотелось бы отметить, что от своевременной постановки диагноза и назначения специфической терапии зависит исход заболевания [16, 19]. Так, при ранней диагностике заболевания у больной П. Н. через 2 мес после начала патогенетической терапии психомоторное развитие соответствовало возрастной норме, тогда как у пациента Л. К. наблюдалась темповая задержка психомоторного развития. У одного из больных, несмотря на проведение специфического лечения, сформировался грубый неврологический дефицит (спастический тетрапарез, частичная атрофия зрительных нервов, нейросенсорная тугоухость, задержка психомоторного развития, редкие судороги), что может быть связано с наиболее ранним злокачественным течением заболевания (выраженный кетоацидоз и лактат-ацидоз) в исследуемой группе, а также его поздним выявлением (табл.).
Заключение
При выявлении у больного в первом полугодии жизни таких симптомов, как судороги, резистентные к проводимой антиэпилептической терапии, нарушения психомоторного развития, алопеция, дерматит, можно предположить наличие у пациента редкого недуга, относящегося к группе наследственных болезней обмена веществ, — недостаточности биотинидазы.
Применение специфической терапии биотином в дозе 10–30 мг/сут при данной патологии приводит к купированию судорог, регрессу неврологических расстройств, росту волос, восстановлению кислотно-основного равновесия и снижению уровня органических кислот в моче.
Исход заболевания зависит от своевременного установления правильного диагноза и назначения специфической терапии.
Литература
С. В. Михайлова
Е. Ю. Захарова, кандидат медицинских наук
Е. С. Ильина, кандидат медицинских наук
А. С. Петрухин, доктор медицинских наук, профессор
