стерилизация пробирок в автоклаве
Методы стерилизации питательных сред и посуды, микробиология
Методы стерилизации питательных сред и посуды, микробиология / Methods of sterilization of nutrient media and dishes, microbiology
Стерилизация является одним из важнейших и необходимых приемов в микробиологической практике. Слово «стерилизация» в переводе с латинского означает обеспложивание. В практической работе под стерилизацией понимают методы, применяемые для уничтожения всех форм жизни как на поверхности, так и внутри стерилизуемых объектов. Различают термическую и холодную стерилизацию. Способы термической стерилизации: прокаливание в пламени и обжигание, сухожаровая стерилизация (горячим воздухом), стерилизация насыщенным паром под давлением (автоклавирование), дробная стерилизация (тиндализация), кипячение. Методы холодной стерилизации: стерилизация фильтрованием, газообразными средствами, ультрафиолетовыми лучами и другими видами излучений.
Физико-химические свойства материала и стерилизация / Physical and chemical properties of the material and sterilization
Возможность и целесообразность применения того или иного способа определяется в первую очередь физико-химическими свойствами материала, подлежащего стерилизации, а иногда и целью исследования.
Стерилизация питательных сред насыщенным паром под давлением (автоклавирование) Совместное действие высокой температуры и давления пара обеспечивает особую эффективность данного способа (табл. 1).
Температура насыщенного пара при разных давлениях Давление Температура, нормальное, атм кПа °С 1,0 101,32 100 1,5 151,98 111 2,0 202,65 121 2,5 251,20 128 3,0 299,75 134 При этом погибают и вегетативные клетки, и споры микроорганизмов. Установлено, что споры большинства микроорганизмов не выдержи6 вают и 5-минутную экспозицию в насыщенном паре при 121 °С.
Стерилизацию текучим паром под давлением осуществляют в автоклавах. Автоклав представляет собой металлический двустенный резервуар, способный выдерживать высокое давление, в который помещают стерилизуемый материал на специальную подставку. Предметы следует размещать не слишком плотно, так как пар должен проходить между ними, иначе они не нагреваются до нужной температуры и могут остаться нестерильными. По окончании времени стерилизации автоклав открывают, когда давление в нем сравняется с атмосферным. Преждевременное открывание крана автоклава недопустимо, так как перегретые среды при резком снижении давления сразу же бурно закипают, смачивают и даже иногда выталкивают ватные пробки, что нарушает впоследствии стерильность материала. К работе с автоклавом допускаются только подготовленные лица! Подготовка сред к стерилизации.
Емкости заполняют средой не более чем на половину их высоты, чтобы предотвратить смачивание пробок. Сосуды со средами закрывают ватными пробками с бумажными колпачками. Стеклянные, резиновые, корковые и другие пробки завертывают в двойной слой оберточной бумаги и стерилизуют привязанными к склянке, закрытой ватной пробкой. Выбор режима автоклавирования. В микробиологической практике стерилизацию в автоклавах осуществляют при температуре в пределах 111-138 °С, т.е. от 0,5 до 2,5 атм. Температура ниже 111 °С не может считаться надежной; а выше 138 0С, как правило, не является необходимой, к тому же, чем выше давление пара, тем сложнее условия эксплуатации автоклава. Микробиологи чаще всего стерилизуют среды при 0,5 и 1 атм. Температура и длительность автоклавирования питательных сред определяются, прежде всего, их составом, термоустойчивостью или термолабильностью компонентов.
Стерилизация легко разрушающиеся субстраты при 0,5 атм в течение 15-30 мин / Sterilization of easily degraded substrates at 0.5 atm for 15-30 minutes
Стерилизующими фильтрами теоретически считают такие, размер пор которых не превышает 0,20 мкм. Наиболее широкое распространение в микробиологической практике получили мембранные фильтры, которые в зависимости от величины пор применяют для фильтрования и стерилизации. Для стерилизации используют отечественные фильтры фирм «Владипор», «Владисарт» с диаметром пор 0,20 мкм. Плотные диски, изготовленные из смеси асбеста с целлюлозой, называются фильтрами Зейтца. В зависимости от диаметра пор они обозначаются разными индексами.
Таблица 2 Время, необходимое для стерилизации стеклянной посуды сухим жаром Температура, °С Время, мин 140 180 150 150 160 120 170 60 Посуда перед стерилизацией должна быть тщательно вымыта и завернута в бумагу для сохранения стерильности после прогревания. После этого еѐ загружают в стерилизатор (или в сушильный шкаф) не слишком плотно, чтобы обеспечить циркуляцию воздуха и равномерный надежный прогрев стерилизуемого материала. По окончании стерилизации шкаф не открывают до тех пор, пока температура в нем не упадет до 80 °С, так как при резком охлаждении иногда нарушается стерильность материала, а сильно нагретое стекло может растрескаться. Стерилизация инструментов и приборов.
Стерилизация прокаливанием в пламени перед использованием, металлические инструменты / Flame sterilization before use, metal tools
Можно стерилизовать шприцы и в автоклаве при 1 атм в течение 15-20 мин. Автоклавируют их только в разобранном виде, иначе они повреждаются.
Стерилизация газообразными веществами / Sterilization with gaseous substances
Лабораторную аппаратуру, имеющую зеркальное, оптическое и радиоэлектронное оборудование, а также изделия из термолабильных пластмасс, например центрифужные пробирки, стерилизуют газовым методом. Для газовой стерилизации применяются только те соединения, которые обладают спороцидными свойствами. Это оксид этилена, метилбромид, оксид пропилена, формальдегид, глютаральдегид, бета-пропиолактон, озон и др. Газовую стерилизацию проводят в специальных герметически закрывающихся аппаратах.
Стерилизуемые объекты, помещаемые в камеру, упаковывают как при стерилизации в автоклаве или сушильном шкафу. При проведении газовой стерилизации строго соблюдают правила работы с ядовитыми газообразными веществами. Стерилизация облучением Для стерилизации помещений, оборудования, некоторых медицинских принадлежностей, пищевых продуктов используют различные виды излучений: инфракрасное, ультрафиолетовое, рентгеновские лучи, а-, Р- и у-лучи радиоактивных элементов. Чаще других в микробиологической практике используют ультрафиолетовое облучение. Мощность ультрафиолета измеряется в бактах. Доза УФ-излучения, губительная для различных видов микроорганизмов (кроме спор), составляет 5 мкб/см2
Правила стерилизации лабораторной посуды и инструментов
Стерилизация лабораторной посуды и инструментов.
Стерилизация — это уничтожение в материалах, продуктах, жидкостях, на поверхностях посуды и оборудования всех видов микроорганизмов и их спор.
Стерилизация посуды и инструментов не только позволяет увеличить точность опытов, но и снижает риск для здоровья сотрудников.
Подготовка и стерилизация посуды:
Промытую посуду просушивают и готовят к стерилизации. В верхнюю часть пипеток вставляют ватные тампоны, колбы и пробирки закрывают ватными пробками. Для того, чтобы пробки не выскакивали, их закрывают бумажными салфетками или фольгой.
Пипетки стерилизуют либо по отдельности, либо по несколько штук. Если пипетку стерилизуют отдельно, то ее заворачивают по спирали в длинные полоски бумаги, начиная с узкой части. Чаще всего стерилизуют несколько пипеток (не более 10 в одной упаковке). Для этого пипетки помещают в специальный металлический пенал или заворачивают в термостойкую (например, микалентную) бумагу.
Аналогично одиночным пипеткам обертывают шпатели, используя бумагу большей ширины.
Чашки Петри заворачивают в микалентную бумагу по 4-5 штук.
В микробиологической лаборатории используют различные виды стерилизации:
– стерилизация сухим жаром;
– стерилизация паром под давлением;
– стерилизация текучим паром (дробная стерилизация);
Прокаливание на огне — надежный метод стерилизации бактериологических петель, металлических и стеклянных предметов. Однако применяется ограниченно ввиду их порчи.
Стерилизация сухим жаром или горячим воздухом производится в сушильных шкафах или печах Пастера при температуре 1 50 — 200 °С в течение 1—1,5 ч по достижении заданной температуры. Этим методом стерилизуют лабораторную посуду, инструменты, минеральные масла, вазелин. Жидкости и резину сухим жаром стерилизовать нельзя. Предметы, подлежащие стерилизации, заворачивают в бумагу или закладывают в металлические пеналы для предохранения от последующего загрязнения. Необходимо помнить, что при температуре выше 170°С начинается обугливание бумаги, ваты, марли, а при более низкой температуре не происходит гибели спор. После окончания стерилизации дверцы шкафа не открывают до полного охлаждения, так как перепад внутренней и внешней температуры может вызвать растрескивание стеклянной посуды.
Стерилизация кипячением в течение 30 мин убивает вегетативные формы микробов. Споры многих бактерий при этом сохраняются, выдерживая кипячение в течение нескольких часов. Для уничтожения вирусов — возбудителей болезни Боткина необходимо кипячение в течение 45—60 мин. Кипячению в специальных стерилизаторах подвергают шприцы, хирургические инструменты, иглы, резиновые трубки. Для повышения точки кипения и устранения жесткости воды добавляют 2% гидрокарбоната натрия.
Стерилизация текучим паром проводится в аппарате Коха или в автоклаве при не завинченной крышке и открытом выпускном кране. На дно аппарата Коха наливают воду и нагревают до 100°С. Образующийся пар движется вверх через заложенный материал и стерилизует его. Так как однократное действие паров воды не убивает споры, применяют дробную стерилизацию — 3 дня подряд по 30 мин. Споры, не погибшие при первом прогревании, прорастают до следующего дня в вегетативные формы и погибают при втором и третьем прогревания.
Следует помнить, что персонал, который осуществляет стерилизацию посредством специальных печей, автоклавов, аппаратов для выработки текучего пара, должен предварительно проходить специальный инструктаж.
ГК “Униконс”
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
“Антисептики Септоцил”
Септоцил. Бытовая химия, антисептики.
“Петритест”
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
“АльтерСтарт”
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
5. МЕТОДЫ СТЕРИЛИЗАЦИИ ПОСУДЫ И ПИТАТЕЛЬНЫХ СРЕД
Основываясь на влиянии внешних условий на микроорганизмы, в микробиологической практике разработан ряд приемов, приводящих микроорганизмы к гибели. Одним из таких приемов является стерилизация.
Под стерилизацией (обеспложиванием) понимают полное уничтожение микроорганизмов и их спор в питательных средах, посуде, на инструментах и других предметах лабораторного оборудования. Для их стерильности наиболее часто пользуются воздействием высокой температуры.
5.1. СТЕРИЛИЗАЦИЯ ОБЖИГАНИЕМ НА ПЛАМЕНИ ГОРЕЛКИ
Небольшие стеклянные (палочка, шпатель) и металлические (игла, петля, пинцет, скальпель) предметы проводят несколько раз через пламя горелки. Стерилизация достигается обугливанием находящихся на их поверхности микроорганизмов. Обжиганием на пламени пользуются и для стерилизации поверхности ватных пробок.
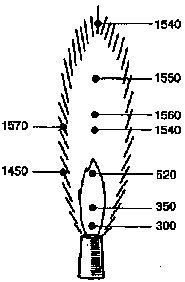
Рис. 14
Значение температуры в разных
участках пламени газовой горелки
5.2. СТЕРИЛИЗАЦИЯ КИПЯЧЕНИЕМ
Стерилизацию металлических инструментов и резиновых трубок проводят кипячением. Так как споры некоторых бактерий сохраняют жизнеспособность при кипячении в воде в течение нескольких часов, то рекомендуется стерилизацию кипячением проводить в 2%-ном растворе карбоната натрия в течение 10 мин. В этих условиях споры погибают.
5.3. СТЕРИЛИЗАЦИЯ СУХИМ ЖАРОМ
Сухим жаром стерилизуют стеклянную посуду. При этом пробирки, колбы предварительно закрывают ватными пробками. Чтобы избежать заражения простерилизованных предметов из воздуха, их перед стерилизацией заворачивают в оберточную бумагу и вынимают только перед работой.
Пипетки перед стерилизацией с концов закрывают ватой. Затем их обертывают длинными полосками бумаги шириной 3,5–4 см. Бумагу наматывают по спирали, начинная с конца пипетки, который будет погружен в среду. Концы обертки закрепляют ниткой. Тонкие пипетки обертывают бумагой вместе по несколько штук.
Чашки Петри заворачивают в бумагу в форме квадрата, сторона которого приблизительно равна трем диаметрам чашки. Чашку Петри помещают на середину листа, загибают его с двух противоположных сторон кверху так, чтобы края налегали друг на друга. Два свободных конца загибают вниз. При таком обертывании у чашек легко различать верх и низ.
Подготовленную таким образом посуду помещают в сушильный шкаф, в котором нагревают ее при температуре 160–170°С в течение 2 ч (с момента установления нужной температуры). При таком нагревании погибают не только бактерии, но и их споры.
Температуру в сушильном шкафу выше 175°С допускать не следует, так как при этом ватные пробки буреют, а бумажная обертка становится ломкой.
5.4. СТЕРИЛИЗАЦИЯ ТЕКУЧИМ ПАРОМ (ДРОБНАЯ СТЕРИЛИЗАЦИЯ), ИЛИ ТИНДАЛИЗАЦИЯ
Питательные среды, воду, резиновые трубки и другие предметы, портящиеся от действия сухого жара, и питательные среды, портящиеся под действием высокой температуры (среды, содержащие молоко, солод, желатину), обеспложивают действием текучего пара.
Стерилизацию текучим паром производят в кипятильнике Коха или в автоклаве с открытым вентилем. Воду в них доводят до кипения, и образующийся пар обтекает стерилизуемые объекты. Температура стерилизуемых питательных сред достигает 100°С. Нагревание в течение 30–45 мин приводит к гибели вегетативных клеток бактерий, но споры их не погибают. Затем жидкость охлаждают до температуры, благоприятной для прорастания спор (до 30°С). Нагревание приводит к активации спор и более быстрому их прорастанию. На следующий день нагревание повторяют. При этом погибают вегетативные клетки, развившиеся из спор. Для обеспечения полной стерильности жидкость оставляют еще на сутки и снова повторяют нагревание. Такую стерилизацию называют дробной или тиндализацией.
5.5. ПАСТЕРИЗАЦИЯ
В основе пастеризации лежит нагревание жидкостей до температуры меньше 100°С. Целью ее является уничтожение неспороносных бактерий в жидкостях, теряющих питательные свойства при кипячении (молоко, пиво, вино и др.). Осуществляется пастеризация путем нагревания жидкостей при 60°С в течение 30 мин, или при 75°С в течение 15 мин, или при 80°С в течение 10 мин.
5.6. ХОЛОДНАЯ СТЕРИЛИЗАЦИЯ
Органические жидкости, не выносящие нагревания, освобождают от бактерий, пропуская через стерильные мелкопористые фильтры. Эти фильтры задерживают микроорганизмы, их называют бактериальными фильтрами.
Бактериальные фильтры имеют разные номера. Фильтры № 1 имеют средний диаметр пор 0,3 мкм и являются наиболее надежными. Фильтры № 5 имеют самые большие отверстия пор, диаметром 1,2 мкм.
Перед употреблением мембранные фильтры стерилизуют кипячением. Фильтры помещают в теплую дистиллированную воду и кипятят 30 мин, меняя 2– 3 раза воду.
5.7. СТЕРИЛИЗАЦИЯ ПАРОМ ПОД ДАВЛЕНИЕМ (АВТОКЛАВИРОВАНИЕ)
Наиболее надежным и универсальным методом стерилизации питательных сред и материалов является стерилизация их насыщенным паром под давлением. Производят ее в автоклаве, в котором стерилизуемые объекты нагревают чистым насыщенным паром при давлении выше атмосферного. Когда насыщенный пар встречается с более холодным объектом, он конденсируется, превращаясь в воду. При конденсации выделяется большое количество теплоты, и температура стерилизуемого объекта быстро повышается.
Полная стерилизация питательных сред при 120°С и давлении 0,1 МПа обеспечивается нагреванием в течение 20 мин.
5.7.1. ПРАВИЛА РАБОТЫ С АВТОКЛАВОМ
Стерилизация в автоклаве производится при повышенном давлении, поэтому работа с ним требует определенной осторожности. Исправность автоклава в определенные сроки проверяют специалисты, которые устанавливают следующий срок проверки.
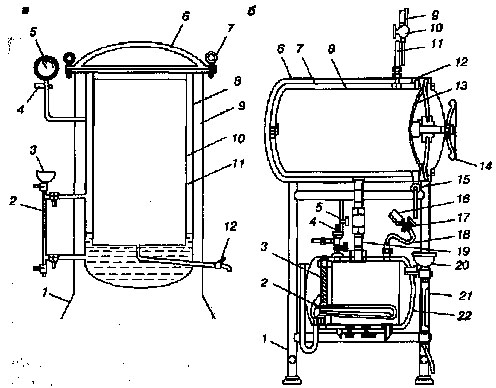
Системы автоклавов различаются, но все они имеют общие принципы устройства (рис. 15), и правила работы с ними однотипны.
Во внутренний котел автоклава (стерилизационную камеру) помещают материал, подлежащий стерилизации.
В водопаровую камеру наливают воду с таким расчетом, чтобы уровень ее в водомерной трубке был между верхней (максимальной) и нижней (минимальной) чертой.
Рис. 15
Устройство автоклавов:
а – вертикальный автоклав: 1 – подставка, 2 – водомерная трубка, 3 – воронка, 4 – предохранительный клапан, 5 – манометр, 6 – крышка, 7 – винтовые зажимы, 8 – котел, 9 – кожух, 10 – камера стерилизации, 11 – водопаровая камера, 12 – паровыпускной клапан;
б – горизонтальный автоклав: 1 – постамент, 2 – нагревательный элемент. 3 – крышка котла, 4 – предохранительный клапан, 5 – вентиль, 6 – кожух, 7 – паровая камера, 8 – стерилизационная камера, 9 – манометр паровой камеры, 10 – трехходовой кран, 11 – сифонная трубка паровой камеры, 12 – опорное кольцо, 13 – крышка паровой камеры, 14 – штурвал, 15 – впускной кран,
16 – манометр котелка, 17 – трехходовой кран котелка, 18 – сифонная трубка котелка, 19 – патрубок, 20 – воронка, 21 – водоуказательная колонка, 22 – котелок.
Крышку автоклава привинчивают болтами к корпусу. Завинчивают болты попарно, крест-накрест, чтобы избежать перекоса крышки, который может возникнуть при завинчивании болтов по кругу.
Открывают краны и включают источник обогрева. Когда пар из выпускного крана начинает выходить непрерывной струей, его закрывают и наблюдают за постепенным повышением давления в рабочей камере по манометру.
Отсчет времени стерилизации начинают с того момента, когда в автоклаве установится заданное давление.
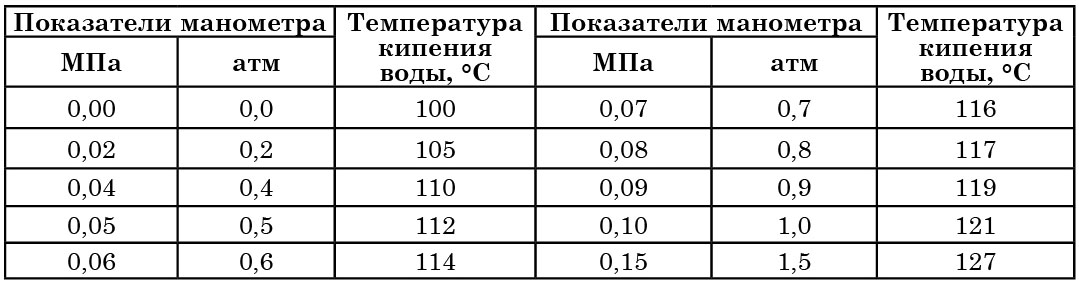
Зависимость давления и температуры в камере автоклава
Между показаниями манометра и температурой кипения воды имеется определенная зависимость (табл. 5). Время от времени эти соотношения следует проверять. Нарушение их указывает на неисправность автоклава и на необходимость его ремонта.
Проверку осуществляют следующим образом: в стерилизационную камеру автоклава помещают 100 г бензойной кислоты с добавлением небольшого количества фуксина или метиленового синего. Если при показании манометра в 0,1 МПа бензойная кислота расплавится, образуя с красителем сплав, то, значит, автоклав дает нужную температуру (120°С).
После окончания заданного срока стерилизации источник нагрева выключают, перекрывают вентиль водопаровой камеры и только после этого постепенно открывают выпускной клапан. При быстром выпускании пара могут быть вырваны ватные пробки из стерилизуемой посуды.
После полного выхода пара отвинчивают болты крышки (снова крест-накрест) и открывают ее, ориентируя крышку на себя для защиты от выходящего пара.
Если во время стерилизации давление начинает подниматься выше заданного уровня, его регулируют, уменьшая нагрев или выпуская часть пара через предохранительный клапан. Последний должен быть отрегулирован так, чтобы при повышении давления излишек пара выходил автоматически.
Практическая часть. Подготовка к стерилизации лабораторной посуды
Подготовка к стерилизации лабораторной посуды
1. Перед стерилизацией лабораторную посуду тщательно моют и сушат.
2. Пробирки, флаконы, бутыли, матрацы, колбы закрывают ватно-марлевыми пробками. Поверх пробки на каждый сосуд (кроме пробирок) надевают бумажный колпачок.
3. Чашки Петри стерилизуют завернутыми в бумагу по 1— 5 штук или в пеналах.
4. Пастеровские пипетки по 3—5—10—15 штук заворачивают в плотную оберточную бумагу. В верхнюю часть каждой пипетки вкладывают кусочек ваты. Во время работы пипетки из пакета вынимают за верхний конец.
Лабораторную посуду стерилизуют:
а) сухим жаром при температуре 150, 160 и 180°С соответственно 2 часа, 1 час и 30 минут.
б) в автоклаве при давлении 1 атм. в течение 20—30 минут.
Стерилизация металлических инструментов
Ножницы, скальпели, пинцеты и пр. стерилизуют в 2% содовом растворе (сода предупреждает появление ржавчины и потерю остроты). Лезвия скальпелей и ножниц перед погружением в воду рекомендуется обертывать ватой.
Стерилизация перчаток и других резиновых изделий
Перчатки, шланги, трубки и другие, загрязненные вегетативной формой микробов, стерилизуют кипячением в 2% растворе соды или текучим паром 30 минут; при загрязнении спороносной патогенной микрофлорой — в автоклаве при давлении 1 атм. в течение 30 минут.
Приготовление дезрастворов группы хлора
1. Хлорная известь обладает высоким бактериальным действием. Ее используют в микробиологической практике в виде порошка, 10—20% хлорно-известкового молока и 0,2—10% осветленного раствора.
2. Схема приготовления хлорно-известкового молока.
Концентрация хлорно-нзвсстко-вого молока (в %)
Количество хлорной извести в граммах на 10 л воды при содержании в ней активного хлора (в %)
В таблице показана взаимосвязь между содержанием активного хлора в хлорной извести и ее количеством, необходимым для приготовления 10 л хлорно-известкового молока 10—20% концентрации.
3. Хлорамин — содержит 25—26,5% активного хлора.
В микробиологических лабораториях пользуются 0,2— 10% растворами хлорамина.
Концентрация раствора (в%)
Количество хлорамина в 1 г на:
Приготовление маточного раствора хлорной извести
1. Взять емкость (стеклянные бутыли темного стекла с притертой пробкой, эмалированная или стеклянная посуда) и поместить в нее 1 кг сухой хлорной извести, после чего, продолжая помешивать, добавить постепенно небольшое количество воды до получения кашицеобразной массы. И затем, перемешивая, добавить воду до объема 10 литров, т. е. для приготовления 10% р-ра хлорной извести необходимо взять: 1 кг сухой хлорной извести + 9 литров воды = = 10 литрам раствора.
2. Свежеприготовленные растворы оставляют на 24 часа в прохладном темном помещении в закрытой посуде. Через 24 часа осторожно, не взбалтывая осадка, сливают осветленный раствор в другую емкость (стеклянные емкости темного цвета, эмалированная или пластмассовая посуда) для хранения до 10 дней.
3. При приготовлении маточного раствора на емкости (на этикетке, которая крепится на ней) указывается дата приготовления, концентрация раствора, должность, фамилия лица, приготовившего раствор.
Внимание! Использование оцинкованной посуды запрещено. Дезрастворы группы фенола
1. Карболовая кислота. Жидкая карболовая кислота содержит 90% кристаллического фенола и 10% воды. В микробиологических лабораториях используют 3—5 % растворы карболовой кислоты.
Схема приготовления растворов карболовой кислоты
2. Хромовая смесь. Пропись приготовления:
В колбу наливают 150 мл концентрированной серной кислоты, туда же всыпают 25 г двухромовокислого калия. Полученную смесь оставляют стоять до растворения. Через сутки раствор темно-оранжевого цвета может быть применен для мытья посуды. Перед употреблением смесь надо подогреть до 45—50°С. Если цвет смеси меняется на темно-зеленый, это говорит о ее непригодности.
Выделение бактериофага из патологического материала
Исследуемую жидкость фильтруют от микробов.
Твердый исследуемый материал (почва, пищевые продукты, оформленные испражнения) измельчают в ступке, эмульгируют, фильтруют. Наличие фага в полученном фильтрате определяют в жидких питательных средах или на плотных средах по методу Отто или Грациа.
Обнаружение бактериофага на плотных питательных средах по методу Отто
1,5% МПА разливают в чашки Петри (более высокая концентрация агара угнетает развитие колоний бактериофага). После застудневания МПА засевают 16—18-часовой бульонной культурой бактерий, гомологичных искомому фагу. Для получения сплошного роста посев растирают шпателем. Спустя 5—10 мин после посева на подсушенную поверхность каплями наносят исследуемый фильтрат. Чашки ставят в термостат на 18—24 часа при температуре 37°С.
Нет результатов: доказательством наличия бактериофага служит полное отсутствие роста культуры в месте попадания капли фильтрата (активный бактериофаг) или появление в этом месте мелких стерильных пятен-колоний бактериофага (бактериофаг слабой активности).
Техника фаготшшрования микробов по методу Креджи и Иенсена
В основу фаготипирования положен принцип совместного выращивания типируемой культуры с типовым бактериофагом. Наступление лизиса определяет типовую принадлежность бактерий. Для фаготипирования бактерий применяют 1,5% МПА с 5% глицерина. Пророщенную бульонную культуру каплями наносят на поверхность питательной среды. Капли не должны растекаться. Они должны впитаться в течение 3—10 мин.
Затем на поверхность каждой капли наносят по 1 капле типового фага с таким расчетом, чтобы часть культуры оставалась свободной от воздействия бактериофага (для контроля роста культуры). Чашки помещают в термостат при температуре 37°С: через 6—8 часов производят учет результатов фаготипирования.
Наличие хорошо выраженного лизиса исследуемой культуры с одним из типовых фагов указывает на принадлежность культуры к данному фаготипу.
Приложение 7.4 (справочное)
Средства и методы дезинфекции, используемые при работе с микроорганизмами III—IV групп патогенности
I. Бактерии, не образующие спор
1. Хлорамин Б или ХБ (содержание активного хлора — АХ не менее 26%):
0,5%, 1%, 2%, 3%-е (по препарату) растворы.
2. Хлорная известь (содержание АХ не менее 25%):
0,5%, 1%, 2%-е (по препарату) осветленные растворы;
10%-е (по препарату) осветленные и неосветленные растворы;
20%-и (по препарату) хлорно-известковое молоко.
3. Известь белильная термостойкая (содержание АХ не менее 25%):
0,5%, 1%, 2%-е (по препарату) осветленные растворы;
10%-е (по препарату) осветленные и неосветленные растворы.
4. Нейтральный гипохлорит кальция — НГК (содержание АХ не менее 52% для марки А и не менее 24% для марки Б):
0,15%-й (по АХ) раствор;
0,25%, 0,5%, 1 %-е (по АХ) осветленные растворы;
5%-е (по препарату) осветленные и неосветленные растворы.
5. Гипохлорит кальция технический — ГКТ (содержание АХ не менее 35%):
1%, 1,5%-е (по препарату) осветленные растворы;
5%-е (по препарату) осветленные и неосветленные растворы.
6. Двутретьосновная соль гипохлорита кальция — ДТС ГК (содержание АХ не менее 47%):
0,25 %, 0,5 %, 1 %-е (по препарату) осветленные растворы;
5%-е (по препарату) осветленные и неосветленные растворы.
7. Двуосновная соль гипохлорита кальция — ДСГК (содержание АХ не менее 30%):
1 %-й (по препарату) осветленный раствор;
5%-е (по препарату) осветленные и неосветленные растворы.
8. Гипохлорит натрия (содержание АХ не менее 14%):
9. Гипохлорит натрия, получаемый методом электролиза поваренной соли на установках, разрешенных к производству и применению 0,125%, 0,25%-е (по АХ) растворы.
10. Анолиты, получаемые на установках, разрешенных к производству и применению:
с содержанием 0,03%, 0,05%, 0,06% АХ.
11. Спорокс (содержание АХ не менее 2,5%):
2%, 5%-е (по препарату) растворы.
12. ДП-2 (содержание АХ не менее 40%)
0,1%, 0,2%-е (по препарату) растворы. 13.Дезоксон-1 или дезоксон-4 (содержание надуксусной кислоты — НУ К не менее 5%):
1%, 2%-е (по препарату) растворы.
14. Пергидроль (содержание перекиси водорода 30—35%):
3%-й (по ДВ) раствор перекиси водорода;
3%-й (по ДВ) раствор перекиси водорода с 0,5% моющего средства («Прогресс», «Новость», «Астра», «Лотос»);
6%-й (по ДВ) раствор перекиси водорода.
15. ПВК (содержание перекиси водорода не менее 30%):
0,5%, 0,75%, 2%-е (по перекиси водорода) растворы.
16. Пероксимед (содержание перекиси водорода 30% и ПАВ):
3%-й (по перекиси водорода) раствор.
17. Пероксогидрат фторида калия — ПФК-1 (содержание перекиси водорода не менее 30%):
3%, 6%, 7%, 9%-е (по препарату) растворы.
18. Полисепт (содержание полигексаметиленгуанидина хлорида 25%):
1 %-й (по препарату) раствор.
19. Демос (содержащий комплекс катионных и др. ПАВ):
5%, 10%-е (по препарату) растворы.
20. Велтолен (содержание клатрата мочевины с дидецилди-метиламмоний бромида 20%):
1 %-й (по препарату) раствор.
21. Фогуцид (содержание пол игексаметиленгуанидина фосфата 19-25%):
0,5—1 %-е (по ДВ) растворы.
22. Ника-экстра М (содержание алкилдиметил бензил аммоний хлорида 3,5—4,5%):
0,5%, 2%-е (по препарату) растворы.
23. Лизол А (содержание фенолов 50%):
5%-й (по препарату) раствор.
0,5%, 2%-е (по препарату) растворы.
10%-и (по препарату) раствор.
26. Аламинол (содержит катамин АБ, глиоксаль и др.):
1%-й (по препарату) раствор.
27. Бианол (содержит глутаровый альдегид, глиоксаль и ка-тамин АБ):
1,5%-й (по препарату) раствор.
28. Глутарал или Глутарал Н (содержание глутарового альдегида 2%):
готовое к применению средство.
3%, 10%, 20%, 40%-е (по формальдегиду) водные растворы.
30. Аммиак 25% (по ДВ) водный раствор.
Для нейтрализации формальдегида применяется соотношение 1:1.
31.Дихлор-1, Белка, Блеск, Блеск-2, Санита, Дезус и др. бытовые чистяще-дезинфицирующие средства: пасты, порошки и др. формы.
2%-й раствор пищевой соды;
2%-й раствор кальцинированной соды.
33. Обработка водяным насыщенным паром под давлением (автоклавирование).
34. Этиловый спирт 70%, 96%-е, смесь Никифорова.
35. Обработка горячим воздухом — 180°С.
38. Обработка в дезинфекционных камерах: паровоздушный, пароформалиновый методы.
39. Аэрозольный метод обеззараживания.
40. Газовый метод (дезинфекция парами формальдегида).
41. Ультрафиолетовое облучение.
1. Хлорамин Б или ХБ (содержание АХ не менее 26%):
5%-й (по препарату) раствор;
0,5% и 1%-е (по АХ) активированные растворы.
2. Хлорная известь (содержание АХ не менее 25%):
2—10%-е (по препарату) растворы;
20%-й (по препарату) хлорно-известковое молоко;
0,25 0,5%-е (по АХ) активированные растворы.
3. Известь белильная термостойкая (содержание АХ не менее 25%):
2—10%-е (по препарату) растворы;
0,25—0,5%-е (по АХ) активированные растворы.
4. Двутретьосновная соль гипохлорита кальция — ДТС ГК (содержание АХ не менее 47%):
20%-ное хлорно-известковое молоко;
1 %-й (по препарату) раствор.
5. Двуосновная соль гипохлорита кальция — ДСГК (содержание АХ не менее 30%):
6. Нейтральный гипохлорит кальция — НГК (содержание АХ не менее 52% для марки А и не менее 24% для марки Б):
1 %, 5%-и (по АХ) раствор.
7. Гипохлорит кальция технический — ГКТ (содержание АХ не менее 35%):
2%-й (по препарату) раствор.
8. Гипохлорит натрия, получаемый методом электролиза на установках, разрешенных к производству и применению:
0,25%, 0,5%-е (по АХ) растворы.
9. Анолиты, получаемые на установках, разрешенных к производству и применению с содержанием 0,05,0,09% АХ.
10. Спорокс (содержание АХ не менее 2,5%):
10%-и (по препарату) раствор.
11. ДП-2 (содержание АХ не менее 35%):
0,5%-и (по препарату) раствор.
12. Дезоксон-1 или Дезоксон-4 (содержание надуксусной кислоты — НУК не менее 5%):
0,25%, 0,5%, 1%-е (по НУК) растворы.
13. Пергидроль (содержание перекиси водорода — ПВ — не менее 30%):
14. Пероксимед (содержание ПВ не менее 30% и моющие компоненты):
3 и 4%-е (по ПВ) растворы.
15. ПВК (содержание ПВ не менее 30%):
16. Лизол марки А (содержание фенолов 50%):
0,5%-й (по препарату) раствор.
18. Глутарал или Глутарал Н (содержание глутарового альдегида 2%):
готовое к применению средство.
19. Аламинол (содержит катамин АБ, глиоксаль и др.):
1 %-й (по препарату) раствор.
20. Бианол (содержит глутаровый альдегид, глиоксаль и катамин АБ):
1,5%-и (по препарату) раствор.
2%-й раствор пищевой соды;
2%-й раствор кальцинированной соды.
22. Обработка водяным насыщенным паром.
23. Обработка горячим воздухом — 180°С.
26. Обработка в дезинфекционных камерах: паровоздушный, пароформалиновый методы.
27. Ультрафиолетовое облучение.
Ш. Бактерии, образующие споры
1. Хлорамин Б или ХБ (содержание АХ не менее 26%):
1—4%-е активированные растворы, содержащие 0,25— 1% АХ.
2. Хлорная известь или белильная термостойкая известь (содержание АХ не менее 25%):
20%-и осветленный и неосветленный раствор, содержащий не менее 5% АХ;
4%-й осветленный активированный раствор, содержащий не менее 1 % АХ.
3. Нейтральный гипохлорит кальция — НГК (содержание АХ не менее 52%):
15%-й осветленный раствор, содержащий не менее 5% АХ;
2%-й осветленный активированный раствор, содержащий не менее 1 % АХ.
4. Двутретьосновная соль гипохлорита кальция — ДТС, ГК (содержание АХ не менее 47%):
15%-й осветленный раствор, содержащий не менее 5% АХ;
2%-й осветленный активированный раствор, содержащий не менее 1 % АХ.
5. Двуосновная соль гипохлорита кальция — ДСГК (содержание АХ не менее 30%):
4%-й активированный раствор, содержащий не менее 1,2% АХ.
7. Пергидроль, содержащий 30—35% перекиси водорода (ПВ):
6%-й раствор ПВ с 0,5% моющего средства («Прогресс», «Новость», «Астра», «Лотос»);
3 %-й раствор ПВ с 0,5 % моющего средства при температуре раствора 50°С.
8. ПВК (содержание ПВ не менее 30%):
раствор, содержащий 4% ПВ при температуре 20°С; раствор, содержащий 3% ПВ при температуре 50°С.
9. Пероксимед (содержание ПВ 30% и ПАВ):
3%-й (по ПВ) раствор при температуре 20 и 50°С;
10. Дезоксон-1 или дезоксон-4 (содержание ПУК не менее раствор, содержащий 1 % надуксусной кислоты (НУ К).
15. Сухой горячий воздух.
16. Обработка паром под давлением.
17. Все емкости, в которых проводится обеззараживание, должны быть закрыты крышкой.
18. Обработка в камерах: паровоздушный и пароформали-1 новый методы.
19. Аэрозольный метод обеззараживания.
ВОПРОСЫ для самоконтроля
Дата добавления: 2015-05-28 ; просмотров: 1258 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ