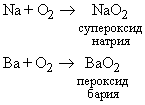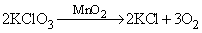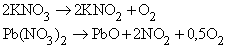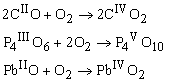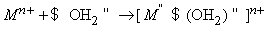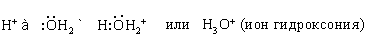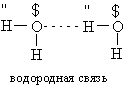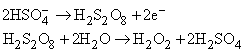депонирует молекулярный кислород какой элемент
Депонирует молекулярный кислород какой элемент
Молекулярный кислород явился мощным экологическим фактором, его накопление в атмосфере вызвало прогрессивную эволюцию одних организмов и гибель других.
Кислород широко распространен в природе, находясь как в связанном, так и в свободном состоянии. В первом случае он входит в состав молекул воды, органических и неорганических соединений. Во втором – присутствует в современной атмосфере в виде молекулярного кислорода (О2), объемная доля которого составляет 21%. Кислород является обязательным химическим компонентом любой клетки. Подавляющее большинство организмов удовлетворяет свои потребности в этом элементе, используя обе формы кислорода.
Среди прокариот существуют значительные различия в отношении к молекулярному кислороду. По этому признаку они могут быть разделены на несколько групп (рис. 3).
Прокариоты, для роста которых О2 необходим, называют облигатными (обязательными) аэробами. К ним относится большинство прокариотных организмов. Среди облигатных аэробов обнаружены существенные различия в отношении к уровню молекулярного кислорода в среде. Некоторые представители этой группы не способны к росту при концентрации О2, равной атмосферной, но могут расти, если содержание О2 в окружающей среде будет значительно ниже (порядка 2%). Такие облигатно аэробные прокариоты получили название микроаэрофилов.
Облигатные аэробы (aeros – воздух) для осуществления процессов метаболизма нуждаются в молекулярном кислороде. Они не способны получать энергию путем брожения. Их ферменты осуществляют перенос электронов от окисляемого субстрата к кислороду. Аэробы развиваются, как правило на поверхности питательных сред. К облигатным аэробам относятся B. subtilis, микрококки и др.
Облигатные анаэробы не используют молекулярный кислород. Более того, он для них токсичен. Многие ферменты этих бактерий денатурируются при контакте с молекулярным кислородом.
Губительное воздействие кислорода на облигатные анаэробы обусловлено тем, что в живой клетке в присутствии кислорода образуется пероксид водорода, который в больших концентрациях ядовит для бактериальной клетки. Облигатные анаэробы погибают при концентрации Н2О2 0,0003%, тогда как аэробы выдерживают до 0,015%, т.е. в 50 раз больше. Для обезвреживания пероксида водорода клетки аэробных бактерий вырабатывают фермент каталазу, разлагающую Н2О2 на воду и молекулярный кислород. Благодаря наличию каталазы Н2О2 не накапливается в клетках. У анаэробов и факультативных анаэробов каталаза отсутствует, что и является одной из причин их неспособности жить в аэробных условиях.
Значительное количество представителей анаэробных бактерий относится к роду Clostridium (C. tetani – возбудитель столбняка, C. botulinum – ботулизма, C. perfringens – возбудитель газовой гангрены). Они широко распространены в почве, озерных отложениях. Облигатные анаэробы принадлежат также к родам Methanobacterium, Bacteroides.
Факультативные анаэробы могут жить как при наличии, так и в отсутствии кислорода. Типичными представителями этой группы являются кишечная палочка, стрептококк, стафилококк. Кишечная палочка на среде с углеводами развивается как анаэроб, сбраживая сахара, а затем начинает использовать кислород, как типичный аэробный организм, окисляя до СО2 и Н2О образовавшиеся продукты брожения (например, молочную кислоту).
Степень аэробности или анаэробности среды может быть охарактеризована количественно при помощи окислительно-восстановительного потенциала. Окислительно-восстановительный потенциал выражают символом rH2. это индекс аналогичный рН. Но рН выражает степень кислотности и щелочности, а rH2 –степень аэробности и анаэробности. Это отрицательный лагорифм концентрации атомов водорода в среде.
В водном растворе, полностью насыщенным кислородоми, rH2 =41, а в условиях полного насыщения среды водородом rH2 =0. Таким образом, шкала от 0 до 41 характеризует любую степень аэробности.
Облигатные аэробы, не способные существовать без свободного кислорода, не могут жить при низких значениях rH2. нижним пределом для них является окислительно-восстановительный потенциал порядка 10. однако и величины rH2 выше 30 для этих организмов не благоприятны. Облигатные аэробы защищаются от чрезмерного окисления выделением в среду сильных восстановителей.
Орблигатные анаэробы жизнедеятельны при rH2 не выше 18-20. однако при этих показателях они уже не размножаются, а осуществляют обмен веществ, приводящий к выделению в среду восстановителей для снижения окислительно-восстановительного потенциала. Размножаться анаэробы могут лишь при значениях rH2 не выше 3-5. факультативно анаэробные микроорганизмы сохраняют метаболическую активность в широком диапазоне rH2 – от 0 до 30.
Степень аэробности среды учитывается при культивировании микроорганизмов. При солосовании (консервировании) кормов искусственно создается анаэробные условия для обеспечения метаболических преимуществ бактериям молочнокислого и уксуснокислого брожений. Чрезмерная аэрация промышленных стоков животноводческих ферм позволяет активизировать окисление органического вещества стоков, в том числе и содержащихся в них микроорганизмов.
Физические свойства. Методы получения молекулярного кислорода
Методы получения молекулярного кислорода
Кислород и его соединения
Главная подгруппа VI группы
Тема 13. VI группа ПСЭ
Побочная подгруппа V группы
Все элементы побочной подгруппы относятся к редким и рассеянным. Практически не имеют собственных руд, иногда входят в состав полиметаллических руд: Fe(NbO3)2, Fe(TaO3)2 и др. Получают электролизом расплавов соответствующих солей.
Химические свойства
1. Довольно инертные в химическом отношении элементы. Взаимодействуют в виде порошков при высоких температурах с кислородом, серой, углеродом, галогенами:
2. В расплавленном состоянии хорошо адсорбируют водород и азот.
3. Очень устойчивы к агрессивным средам. Так, ванадий растворяется в концентрированной азотной кислоте и царской водке, а на ниобий и тантал действует только смесь азотной и плавиковой кислот при длительном нагревании:
4. В щелочах не растворяются, но при окислительном сплавлении можно получить соли анионного типа:
5. С кислородом образуют ряд оксидов следующих составов: VO, V2O3 – основного характера, VO2 – амфотерный, V2O5, Nb2O5, Ta2O5 – кислотного характера.
Применение. Как легирующие добавки к высококачественным сталям. Тантал успешно заменяет золото при изготовлении химической посуды, устойчивой к воздействию агрессивных сред и используется в медицине.
1. Извлечение из воздуха путем фракционированной перегонки жидкого воздуха. Первым испаряется азот, а в жидкой фазе остается кислород с примесью аргона.
2. Электролиз водных растворов кислот и оснований. На аноде выделяется кислород.
3. Термическое разложение соединений, содержащих кислород:
Химические свойства
Большинство простых веществ взаимодействуют с кислородом с образованием оксидов. Лишь галогены, инертные газы и элементы платиновой группы не взаимодействуют с молекулярным кислородом. Реакции с кислородом, сопровождающиеся выделением большого количества тепла называются реакциями горения:
Применение. Кислород используется в промышленности для достижения высоких температур; при сварке и резке металлов в смеси с ацетиленом. Используется в производстве стали (выжигание примесей); в медицине.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
КИСЛОРОД
КИСЛОРОД, O (oxygenium), химический элемент VIA подгруппы периодической системы элементов: O, S, Se, Te, Po – член семейства халькогенов. Это наиболее распространенный в природе элемент, его содержание составляет в атмосфере Земли 21% (об.), в земной коре в виде соединений ок. 50% (масс.) и в гидросфере 88,8% (масс.).
Кислород необходим для существования жизни на земле: животные и растения потребляют кислород в процессе дыхания, а растения выделяют кислород в процессе фотосинтеза. Живая материя содержит связанный кислород не только в составе жидкостей организма (в клетках крови и др.), но и в составе углеводов (сахар, целлюлоза, крахмал, гликоген), жиров и белков. Глины, горные породы состоят из силикатов и других кислородсодержащих неорганических соединений, таких, как оксиды, гидроксиды, карбонаты, сульфаты и нитраты.
Историческая справка.
Первые сведения о кислороде стали известны в Европе из китайских рукописей 8 в. В начале 16 в. Леонардо да Винчи опубликовал данные, связанные с химией кислорода, не зная еще, что кислород – элемент. Реакции присоединения кислорода описаны в научных трудах С.Гейлса (1731) и П.Байена (1774). Заслуживают особого внимания исследования К.Шееле в 1771–1773 взаимодействия металлов и фосфора с кислородом. Дж.Пристли сообщил об открытии кислорода как элемента в 1774, спустя несколько месяцев после сообщения Байена о реакциях с воздухом. Название oxygenium («кислород») дано этому элементу вскоре после его открытия Пристли и происходит от греческих слов, обозначающих «рождающий кислоту»; это связано с ошибочным представлением о том, что кислород присутствует во всех кислотах. Объяснение роли кислорода в процессах дыхания и горения, однако, принадлежит А.Лавуазье (1777).
Строение атома.
Любой природный атом кислорода содержит 8 протонов в ядре, но число нейтронов может быть равно 8, 9 или 10. Наиболее распространенный из трех изотопов кислорода (99,76%) – это 16 8O (8 протонов и 8 нейтронов). Содержание другого изотопа, 18 8O (8 протонов и 10 нейтронов), составляет всего 0,2%. Этот изотоп используется как метка или для идентификации некоторых молекул, а также для проведения биохимических и медико-химических исследований (метод изучения нерадиоактивных следов). Третий нерадиоактивный изотоп кислорода 17 8O (0,04%) содержит 9 нейтронов и имеет массовое число 17. После того как в 1961 масса изотопа углерода 12 6C была принята Международной комиссией за стандартную атомную массу, средневзвешенная атомная масса кислорода стала равна 15,9994. До 1961 стандартной единицей атомной массы химики считали атомную массу кислорода, принятую для смеси трех природных изотопов кислорода равной 16,000. Физики за стандартную единицу атомной массы принимали массовое число изотопа кислорода 16 8O, поэтому по физической шкале средняя атомная масса кислорода составляла 16,0044 (см. также АТОМНАЯ МАССА).
В атоме кислорода 8 электронов, при этом 2 электрона находятся на внутреннем уровне, а 6 электронов – на внешнем. Поэтому в химических реакциях кислород может принимать от доноров до двух электронов, достраивая свою внешнюю оболочку до 8 электронов и образуя избыточный отрицательный заряд (см. также АТОМА СТРОЕНИЕ).
Молекулярный кислород.
Как большинство других элементов, у атомов которых для достройки внешней оболочки из 8 электронов не хватает 1–2 электронов, кислород образует двухатомную молекулу. В этом процессе выделяется много энергии (
490 кДж/моль) и соответственно столько же энергии необходимо затратить для обратного процесса диссоциации молекулы на атомы. Прочность связи O–O настолько высока, что при 2300 ° С только 1% молекул кислорода диссоциирует на атомы. (Примечательно, что при образовании молекулы азота N2 прочность связи N–N еще выше,
Электронная структура.
В электронной структуре молекулы кислорода не реализуется, как можно было ожидать, распределение электронов октетом вокруг каждого атома, а имеются неспаренные электроны, и кислород проявляет свойства, типичные для такого строения (например, взаимодействует с магнитным полем, являясь парамагнетиком).
Реакции.
В соответствующих условиях молекулярный кислород реагирует практически с любым элементом, кроме благородных газов. Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Вероятно, большинство реакций протекает только после диссоциации кислорода на атомы, а диссоциация происходит лишь при очень высоких температурах. Однако катализаторы или другие вещества в реагирующей системе могут способствовать диссоциации O2. Известно, что щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы реагируют с молекулярным кислородом с образованием пероксидов:
Получение и применение.
Благодаря наличию свободного кислорода в атмосфере наиболее эффективным методом его извлечения является сжижение воздуха, из которого удаляют примеси, CO2, пыль и т.д. химическими и физическими методами. Циклический процесс включает сжатие, охлаждение и расширение, что и приводит к сжижению воздуха. При медленном подъеме температуры (метод фракционной дистилляции) из жидкого воздуха испаряются сначала благородные газы (наиболее трудно сжижаемые), затем азот и остается жидкий кислород. В результате жидкий кислород содержит следы благородных газов и относительно большой процент азота. Для многих областей применения эти примеси не мешают. Однако для получения кислорода особой чистоты процесс дистилляции необходимо повторять. Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием. Кислород можно получать различными химическими методами, и некоторые из них применяют для получения малых количеств чистого кислорода в лабораторной практике.
Электролиз.
Один из методов получения кислорода – электролиз воды, содержащей небольшие добавки NaOH или H2SO4 в качестве катализатора: 2H2O ® 2H2 + O2. При этом образуются небольшие примеси водорода. С помощью разрядного устройства следы водорода в газовой смеси вновь превращают в воду, пары которой удаляют вымораживанием или адсорбцией.
Термическая диссоциация.
Важный лабораторный метод получения кислорода, предложенный Дж.Пристли, заключается в термическом разложении оксидов тяжелых металлов: 2HgO ® 2Hg + O2. Пристли для этого фокусировал солнечные лучи на порошок оксида ртути. Известным лабораторным методом является также термическая диссоциация оксосолей, например хлората калия в присутствии катализатора – диоксида марганца:
Диоксид марганца, добавляемый в небольших количествах перед прокаливанием, позволяет поддерживать требуемую температуру и скорость диссоциации, причем сам MnO2 в процессе не изменяется.
Используются также способы термического разложения нитратов:
а также пероксидов некоторых активных металлов, например:
Последний способ одно время широко использовался для извлечения кислорода из атмосферы и заключался в нагревании BaO на воздухе до образования BaO2 с последующим термическим разложением пероксида. Способ термического разложения сохраняет свое значение для получения пероксида водорода.
Физические свойства.
Кислород при нормальных условиях – бесцветный газ без запаха и вкуса. Жидкий кислород имеет бледно-голубой цвет. Твердый кислород существует по крайней мере в трех кристаллических модификациях. Газообразный кислород растворим в воде и, вероятно, образует непрочные соединения типа O2 Ч H2O, а возможно, и O2 Ч 2H2O.
Химические свойства.
Как уже упоминалось, химическая активность кислорода определяется его способностью диссоциировать на атомы O, которые и отличаются высокой реакционной способностью. Только наиболее активные металлы и минералы реагируют с O2 c высокой скоростью при низких температурах. Наиболее активные щелочные (IA подгруппы) и некоторые щелочноземельные (IIA подгруппы) металлы образуют с O2 пероксиды типа NaO2 и BaO2. Другие же элементы и соединения реагируют только с продуктом диссоциации O2. В подходящих условиях все элементы, исключая благородные газы и металлы Pt, Ag, Au, реагируют с кислородом. Эти металлы тоже образуют оксиды, но при особых условиях.
При окислении металлов кислородом происходит выделение тепла, величина которого коррелирует с прочностью связи M–O. При окислении некоторых неметаллов происходит поглощение тепла, что свидетельствует об их менее прочных связях с кислородом. Такие оксиды термически неустойчивы (или менее стабильны, чем оксиды с ионной связью) и часто отличаются высокой химической активностью. В таблице приведены для сравнения значения энтальпий образования оксидов наиболее типичных металлов, переходных металлов и неметаллов, элементов A- и B-подгрупп (знак минус означает выделение тепла).
| Реакции | Энтальпии образования, кДж/моль |
| 4Na + O2 ® 2Na2O a | –208 |
| 2Mg + O2 ® 2MgO | –297 |
| 4Al + 3O2 ® 2Al2O3 | –273 |
| Si + O2 ® SiO2 | –215 |
| 4P + 5O2 ® P4O10 | –151 |
| S + O2 ® SO2 | –74 |
| 2Cl2 + 7O2 ® 2Cl2O7 | +19 |
| 2Hg + O2 ® 2HgO | –45 |
| 2Cr + 3O2 ® 2CrO3 | –97 |
| 3Fe + 2O2 ® Fe3O4 | –140 |
| a При нормальных условиях предпочтительнее образование Na2O2. | |
О свойствах оксидов можно сделать несколько общих выводов:
1. Температуры плавления оксидов щелочных металлов уменьшаются с ростом атомного радиуса металла; так, tпл (Cs2O) tпл (SO2).
2. Оксиды химически активных металлов (IA–IIIA подгрупп) более термически стабильны, чем оксиды переходных металлов и неметаллов. Оксиды тяжелых металлов в высшей степени окисления при термической диссоциации образуют оксиды с более низкими степенями окисления (например, 2Hg 2+ O ® (Hg + )2O + 0,5O2 ® 2Hg 0 + O2). Такие оксиды в высоких степенях окисления могут быть хорошими окислителями.
3. Наиболее активные металлы взаимодействуют с молекулярным кислородом при повышенных температурах с образованием пероксидов:
5. Металлы и неметаллы A-подгрупп образуют оксиды со степенью окисления, соответствующей номеру группы, например, Na, Be и B образуют Na 1 2O, Be II O и B2 III O3, а неметаллы IVA–VIIA подгрупп C, N, S, Cl образуют C IV O2, N V 2O5, S VI O3, Cl VII 2O7. Номер группы элемента коррелирует только с максимальной степенью окисления, так как возможны оксиды и с более низкими степенями окисления элементов. В процессах горения соединений типичными продуктами являются оксиды, например:
Углеродсодержащие вещества и углеводороды при слабом нагревании окисляются (сгорают) до CO2 и H2O. Примерами таких веществ являются топлива – древесина, нефть, спирты (а также углерод – каменный уголь, кокс и древесный уголь). Тепло от процесса горения утилизируется на производство пара (а далее электричества или идет на силовые установки), а также на отопление домов. Типичные уравнения для процессов горения таковы:
а) древесина (целлюлоза):
б) нефть или газ (бензин C8H18 или природный газ CH4):
г) углерод (каменный или древесный уголь, кокс):
2C + O2 ® 2CO + тепловая энергия
2CO + O2 ® 2CO2 + тепловая энергия
Оксиды металлов или неметаллов с низшими степенями окисления элемента реагируют с кислородом с образованием оксидов высоких степеней окисления этого элемента:
Оксиды природные, полученные из руд или синтезированные, служат сырьем для получения многих важных металлов, например, железа из Fe2O3 (гематит) и Fe3O4 (магнетит), алюминия из Al2O3 (глинозем), магния из MgO (магнезия). Оксиды легких металлов используются в химической промышленности для получения щелочей или оснований. Пероксид калия KO2 находит необычное применение, так как в присутствии влаги и в результате реакции с ней выделяет кислород. Поэтому KO2 применяют в респираторах для получения кислорода. Влага из выдыхаемого воздуха выделяет в респираторе кислород, а KOH поглощает CO2. Получение оксида CaO и гидроксида кальция Ca(OH)2 – многотоннажное производство в технологии керамики и цемента.
Вода (оксид водорода).
Из-за высокой прочности связей H–O водород с трудом отщепляется от кислорода и вода проявляет очень слабые кислотные свойства. Многие свойства воды определяются распределением зарядов. Например, молекула воды образует с ионом металла гидрат:
Одну электронную пару вода отдает акцептору, которым может быть H + :
Молекулы воды связываются друг с другом в большие агрегаты (H2O)x слабыми водородными связями (энергия связи
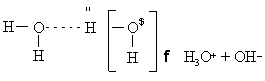
Вода в такой системе водородных связей подвергается диссоциации в очень слабой степени, достигающей концентрации 10 –7 моль/л. Очевидно, расщепление связи, показанное квадратными скобками, приводит к образованию гидроксид-иона OH – и иона гидроксония H3O + :
Пероксид водорода.
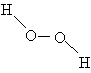
Другим соединением, состоящим только из водорода и кислорода, является пероксид водорода H2O2. Название «пероксид» принято для соединений, содержащих связь –O–O–. Пероксид водорода имеет строение асимметрично изогнутой цепи:
Пероксид водорода получают по реакции пероксида металла с кислотой
либо разложением пероксодисерной кислоты H2S2O8, которую получают электролитически:
Концентрированный раствор H2O2 может быть получен специальными методами дистилляции. Пероксид водорода используют как окислитель в двигателях ракет. Разбавленные растворы пероксида служат антисептиками, отбеливателями и мягкими окислителями. H2O2 добавляют ко многим кислотам и оксидам для получения соединений, аналогичных гидратам. В присутствии сильного окислителя (например, MnO2 или MnO4 – ) H2O2 окисляется, выделяя кислород и воду.
Оксоанионы и оксокатионы
2Na + 2H2O ® 2Na + + 2OH – + H2
Более сложные оксоанионы образуются из кислорода с ионом металла или неметаллической частицей, имеющей большой положительный заряд, в результате получается низкозаряженная частица, обладающая большей стабильностью, например:
Кроме атомарного кислорода O и двухатомной молекулы O2 существует третья форма кислорода – озон O3, содержащий три кислородных атома. Все три формы являются аллотропными модификациями. Озон образуется при пропускании тихого электрического разряда через сухой кислород: 3O2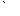
Разумовский С.Д. Кислород – элементарные формы и свойства. М., 1979
Термодинамические свойства кислорода. М., 1981