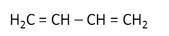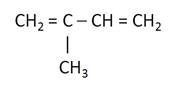для каких алкадиенов характерна изомерия углеродного скелета
Алкадиены
Номенклатура и изомерия алкадиенов
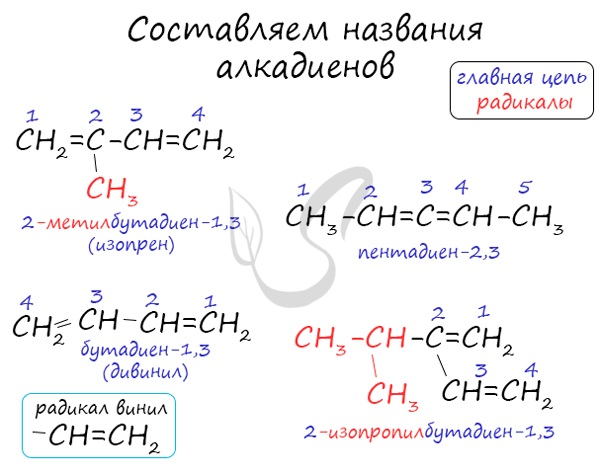
Названия алкенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.
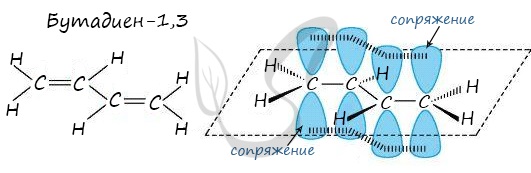
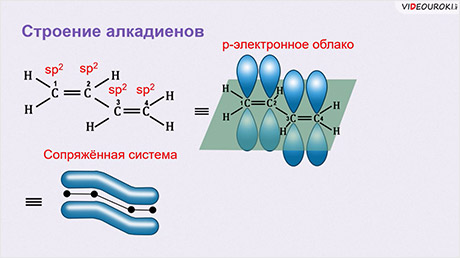
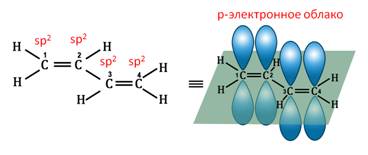
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
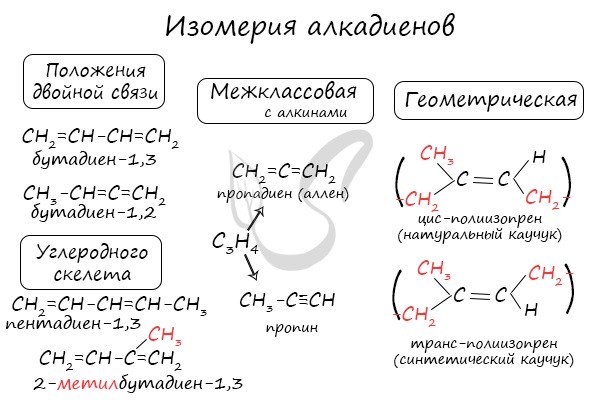
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
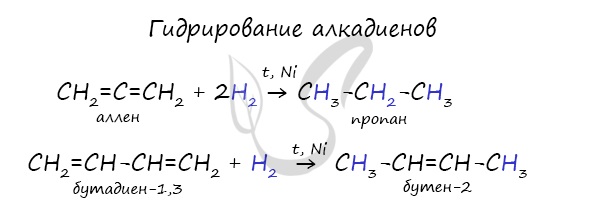
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).
В случае, если две двойные связи разделены двумя и более одинарными связями.
Получение алкадиенов
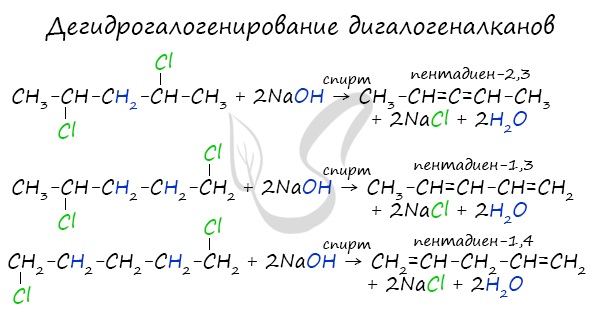
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта.
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.
В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора.
Химические свойства алкадиенов
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
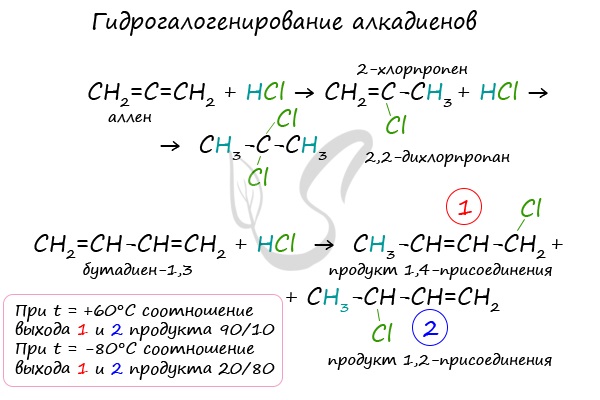
Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алкадиены: гомологический ряд, номенклатура и изомерия
Урок 13. Химия 10 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Алкадиены: гомологический ряд, номенклатура и изомерия»
Диеновые углеводороды – это непредельные углеводороды, в составе которых есть кратные связи.
Алкадиены, или диены – это углеводороды, содержащие в составе молекул две двойные связи.
Диены довольно широко распространены в природе: это растительные пигменты моркови, помидоров, листьев деревьев, плодов шиповника. Здесь растительным пигментом является β-каротин.
Простейшим представителем диенов, у которого двойные связи разделены одной одинарной, является бутадиен-1,3.
Из этой формулы видно, что общая формула алкадиенов будет CnH2n-2. В бутадиене-1,3 все атомы углерода находятся в состоянии sp 2 -гибридизации и молекула имеет плоскостное строение. р-Электроны двойных связей образуют единое р-электронное облако (сопряжённую систему) и делокализовано между всеми атомами углерода. Здесь нет чисто одинарных и число двойных связей. В молекуле бутадиена-1,3 длина одинарной С – С-связи равна 0,148 нм, что короче С – С-связи в алканах, но длиннее, чем в алкенах. Это всё приводит к особым химическим свойствам диенам.
Рассмотрим алкадиены, имеющие пять атомов углерода.
H2C = C = CH – CH2 – CH3 пентадиен-1,2 (кумулятивные)
H2C = CH – CH = CH – CH3 пентадиен-1,3 (сопряжённые)
H2C = CH – CH2 – CH = CH2 пентадиен-1,4 (изолированные)
По правилам IUPAC главная цепь диенов должна содержать обе двойные связи. Нумерацию проводят так, чтобы двойные связи получили наименьшие номера. Суффикс –ан заменяется на суффикс –диен. Цифры, указывающие положение двойных связей, записывают после суффикса, а названия заместителей указывают вначале. Например, пронумеруем углеводород:
Выбираем для этого самую длинную цепь. В главной цепи 4 атома углерода и здесь один заместитель – метил у второго атома углерода. Поэтому данный углеводород называется 2-метилбутадиен-1,3, или изопрен.
Кроме изопрена, тривиальное название имеет и бутадиен-1,3, который называют дивинилом.
CH2 = CH – CH = CH2 бутадиен-1,3
Для диенов характерны следующие виды изомерии: структурная (изомерия углеродного скелета и изомерия положения двойной связи), а также межклассовая изомерия с алкинами и циклоалкенами.
Составим изомеры к диену, содержащему 6 атомов углерода. Рассмотрим изомерию углеродного скелета. Диену, у которого 6 атомов углерода, соответствует гексадиен-1,3 и 4-метилпентадиен-1,3.
Если составить к диену с 6-ю атомами углерода изомеры по положению двойных связей, то такими изомерами будут гексадиен-2,4 и гексадиен-1,3.
H3C – CH = CH – CH = CH – CH3
Межклассовым изомерами бутадиена-1,3 будут: бутин-1 и циклобутен.
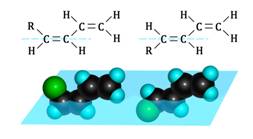
Для алкадиенов характерна и пространственная цис-транс-изомерия. Эта изомерия обусловлена различным расположением заместителей в пространстве относительно π-связи, вокруг которой невозможно внутримолекулярное вращение.
Таким образом, общая формула алкадиенов CnH2n-2. В молекулах диенов длина одинарной С – С-связи равна 0,148 нм. Для диенов характерны следующие виды изомерии: структурная (изомерия углеродного скелета и изомерия положения двойной связи), а также межклассовая изомерия с алкинами и циклоалкенами.
Для каких алкадиенов характерна изомерия углеродного скелета
1. Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи.
Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах.
1.Изолированные двойные связи разделены в цепи двумя или более
2. Кумулированные двойные связи расположены у одного атома углерода: СН2=С=СН2(аллен)
Подобные диены (аллены) относятся к довольно редкому типу соединений.
2. Номенклатура алкадиенов
По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода), в которых последняя буква заменяется окончанием –диен.
Местоположение двойных связей указывается в конце названия, а заместителей – в начале названия.
Название «дивинил» происходит от названия радикала –СН=СН2 «винил«.
3. Изомерия сопряженных диенов
1. Изомерия положения сопряженных двойных связей:
2. Изомерия углеродного скелета:
3. Межклассовая изомерия с алкинами и циклоалкенами.
Например, формуле С4Н6 соответствуют следующие соединения:
Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис—транс-изомерию.
4. Получение алкадиенов
Общие способы получения диенов аналогичны способам получения алкенов.
1. Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах:
- Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен:

2. Синтез дивинила по Лебедеву:
3. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):
4. Действие спиртового раствора щелочи на дигалогеналканы:
Алканы
Органическая химия
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
Номенклатура алканов
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Природный газ и нефть
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Химические свойства алканов
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алканы. Свойства алканов.
Строение алканов.
Каждый атом углерода находится в sp 3 – гибридизации, образует 4 σ— связи (1 С-С и 3 С-Н). Форма молекулы в виде тетраэдра с углом 109,5°.
Связь образуется посредством перекрывания гибридных орбиталей, причем максимальная область перекрывания лежит в пространстве на прямой, соединяющей ядра атомов. Это наиболее эффективное перекрывание, поэтому σ-связь считается наиболее прочной.
Изомерия алканов.
Для алканов свойственна изомерия углеродного скелета. Предельные соединения могут принимать различные геометрические формы, сохраняя при этом угол между связями. Например,
Различные положения углеродной цепи называются конформациями. В нормальных условиях конформации алканов свободно переходят друг в друга с помощью вращения С-С связей, поэтому их часто называют поворотными изомерами. Существует 2 основные конформации – «заторможенное» и «заслоненное»:
Изомерия углеродного скелета алканов.
Количество изомеров возрастает с увеличением роста углеродной цепи. Например у бутана известно 2 изомера:
Для пентана – 3, для гептана – 9 и т.д.
Если у молекулы алкана отнять один протон (атом водорода), то получится радикал:
Физические свойства алканов.
В нормальных условиях – С1-С4 – газы, С5-С17 – жидкости, а углеводороды с количеством атомов углерода больше 18 – твердые вещества.
С ростом цепи повышается температура кипения и плавления. Разветвленные алканы имеют более низкие температуры кипения, чем нормальные.
Алканы нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях. Легко смешиваются друг с другом.
Получение алканов.
Синтетические методы получения алканов:
2. Из галогенпроизводных – реакция Вюрца: взаимодействие моногалогенаклканов с металлическим натрием, в результате чего получаются алканы с удвоенным числом углеродных атомов в цепи:
3. Из солей карбоновых кислот. При взаимодействии соли с щелочи, получаются алканы, которые содержат на 1 атом углерод меньше по сравнению с исходной карбоновой кислотой:
4. Получение метана. В электрической дуге в атмосфере водорода:
Химические свойства алканов.
В нормальных условиях алканы – химически инертные соединения, они не реагируют с концентрированной серной и азотной кислотой, с концентрированной щелочью, с перманганатом калия.
Устойчивость объясняется прочностью связей и их неполярностью.
Соединения не склонны к реакциях разрыва связи (реакция присоединения), для них свойственно замещение.
1. Галогенирование алканов. Под воздействием кванта света начинается радикальное замещение (хлорирование) алкана. Общая схема:
Реакция идет по цепному механизму, в которой различают:
А) Инициирование цепи:
Суммарно можно представить в виде:
2. Нитрование (реакция Коновалова) алканов. Реакция протекает при 140 °С:
Легче всего реакция протекает с третитичным атомом углерода, чем с первичным и вторичным.
3. Изомризация алканов. При конкретных условиях алканы нормального строения могут превращаться в разветвленные:
4. Крекинг алканов. При дейсвии высоких температур и катализаторов высшие алканы могут рвать свои связи, образуя алкены и алканы более низшие:
5. Окисление алканов. В различных условиях и при разных катализаторах окисление алкана может привести к образованию спирта, альдегида (кетона) и уксусной кислоты. В условиях полного окисления реакция протекает до конца – до образования воды и углекислого газа:
Применение алканов.
Алканы нашли широкое применение в промышленности, в синтезе нефти, топлива и т.д.