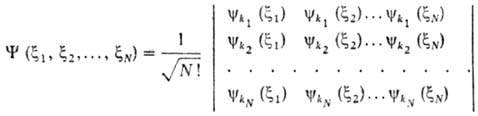для каких частиц справедлив принцип паули
Принцип Паули
Из Википедии — свободной энциклопедии
Для случая электронов в атомах его можно сформулировать следующим образом: невозможно, чтобы два электрона многоэлектронного атома имели бы одинаковые значения четырёх квантовых чисел n, (главное квантовое число), l (орбитальное квант число), m (магнитное квантовое число) и ms, (квантовое число проекции спина). Например, если два электрона находятся на одной орбитали, то их значения для тройки квантовых чисел n, l, m — одинаковы, поэтому значения ms должны различаться, и, таким образом, электроны должны иметь противоположные проекции спина 1/2 и −1/2 (в единицах h).
Более строгое утверждение касается обмена двух идентичных частиц: полная (многочастичная) волновая функция антисимметрична для фермионов и симметрична для бозонов. Это означает, что если поменять местами пространственные и спиновые координаты двух одинаковых (тождественных) частиц, то полная волновая функция меняет знак для фермионов и не меняет знака для бозонов.
Если бы два фермиона находились в одном и том же состоянии (например, на одной и той же орбитали атома с одинаковым спином), их перестановка ничего не изменила бы, и полная волновая функция не поменялась бы. Единственная возможность для полной волновой функции изменить знак, как требуется для фермионов, и остаться неизменной, — это равенство её нулю во всех области определения, что означает отсутствие такого состояния. Это рассуждение неприменимо для бозонов, потому что знак полной волновой функции не меняется.
Принцип запрета Паули
Два электрона в атоме не могут находиться в одном состоянии.
Австрийский физик Вольфганг Паули — один из нескольких европейских физиков-теоретиков, сформулировавших в конце 1920-х — начале 1930-х годов основные принципы и постулаты квантовой механики. Принцип, носящий его имя, является одним из основополагающих в этом разделе физической науки. Проще всего представить себе, в чем именно заключается принцип Паули, если сравнить электроны с автомобилями на многоярусной крытой стоянке. В каждый бокс помещается только одна машина, а после того, как все боксы на нижнем этаже стоянки заняты, автомобилям приходится в поисках свободного места заезжать на следующий этаж. Так же и электроны в атомах — на каждой орбите вокруг ядра их помещается не больше, чем там имеется «парковочных мест», а после того, как все места на орбите заняты, следующий электрон ищет себе место на более высокой орбите.
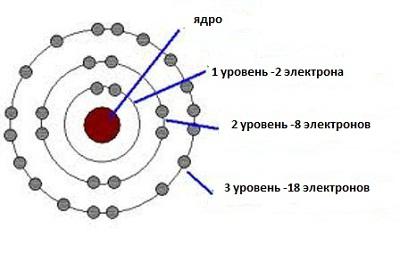
Далее, электроны ведут себя, условно говоря, так, будто они вращаются вокруг своей оси (то есть, обладают собственным моментом вращения, который в этом случае принято называть спином и который может принимать лишь два значения: +1/2 или –1/2). Два электрона с противоположным спином могут занимать одно место на орбите. Это, как если бы в один бокс помещались одновременно машина с правым рулем и машина с левым рулем, а две машины с одинаковым расположением руля не помещались. Вот почему в первом ряду периодической системы Менделеева мы видим всего два атома (водород и гелий): на нижней орбите отведено всего одно сдвоенное место для электронов с противоположным спином. На следующей орбите помещается уже восемь электронов (четыре со спином –1/2, и четыре со спином +1/2), поэтому во втором ряду таблицы Менделеева мы видим уже восемь элементов. И так далее.
Внутри стареющих звезд температура настолько высока, что атомы в основном находятся в ионизированном состоянии, и электроны свободно перемещаются между ядрами. И здесь снова срабатывает принцип запрета Паули, но уже в видоизмененной форме. Теперь он гласит, что в определенном пространственном объеме может одновременно находиться не более двух электронов с противоположным спином и определенными интервалами предельно допустимых скоростей. Однако картина резко изменяется после того, как плотность вещества внутри звезды превысит пороговое значение порядка 10 7 кг/м 3 (для сравнения — это в 10 000 раз выше плотности воды; спичечный коробок такого вещества весит около 100 тонн). При такой плотности принцип Паули начинает выражаться в стремительном росте внутреннего давления в звезде. Это дополнительное давление вырожденного электронного газа, и его проявлением становится тот факт, что гравитационный коллапс старой звезды останавливается после того, как она сжимается до размеров, сопоставимых с размерами Земли. Такие звезды называют белыми карликами, и это последняя стадия эволюции звезд с массой, близкой к массе Солнца (см. Предел Чандрасекара).
Выше я описал действие запрета Паули применительно к электронам, но он действует и в отношении любых элементарных частиц с полуцелым спиновым числом (1/2, 3/2, 5/2 и т. д.). В частности, спиновое число нейтрона равно, как и у электрона, 1/2. Это значит, что нейтронам, как и электронам, требуется определенное «жизненное пространство» вокруг себя. Если масса белого карлика превышает 1,4 массы Солнца (см. Предел Чандрасекара), силы гравитационного притяжения заставляют протоны и электроны внутри звезды попарно объединяться в нейтроны. Но тогда нейтроны, подобно электронам в белых карликах, начинают производить внутренне давление, которое называется давлением вырожденного нейтронного газа, и в этом случае гравитационный коллапс звезды останавливается на стадии образования нейтронной звезды, диаметр которой сопоставим с размерами большого города. Однако при еще большей массе звезды (начиная примерно с тридцатикратной массы Солнца) силы гравитации сламывают и сопротивление вырожденного нейтронного газа, и звезды коллапсируют дальше, превращаясь в черные дыры.
Принцип запрета Паули представляет собой яркий пример закона природы нового типа, и по мере развития компьютерных технологий такие «неявные» законы будут неизбежно играть всё большую роль. Законы этого типа принципиально отличаются от законов классической физики, таких как законы механики Ньютона, — они не предсказывают, что произойдет в системе. Вместо этого они определяют, чего в системе не может произойти. Именно их биолог и структурный теоретик Харольд Моровиц (Harold Morowitz, р. 1927) назвал «правилами отсечения»: такие правила, в частности, принцип запрета Паули сводятся к тому, что при решении самых сложных и комплексных проблем (а расчет орбит электронов в сложных атомов к таковым, несомненно, относится) следует запрограммировать компьютер таким образом, чтобы он даже не рассматривал заведомо невозможные варианты решения. Тем самым такое правило отсекает от ствола возможных решений задачи заведомо мертвые ветви, оставляя лишь допустимые возможности для ее решения, благодаря чему время компьютерных расчетов сокращается до разумных пределов. Таким образом, правила, подобные принципу запрета Паули, становятся всё более важными, поскольку мы всё больше зависим от компьютеров в решении самых сложных и комплексных проблем.
Раньше ученые масштаба Исаака Ньютона или Майкла Фарадея успешно сочетали в себе навыки экспериментаторов и теоретиков — сами проводили эксперименты по исследованию различных аспектов физического мира и сами же разрабатывали теории для объяснения полученных ими опытным путем результатов. Те времена прошли. Примерно с начала ХХ столетия узкая специализация, эпидемией пронесшаяся по всем отраслям человеческой деятельности, распространилась и на естествознание, включая физику. Сегодня мы видим, что подавляющее большинство ученых относится к одной из двух категорий — экспериментаторов или теоретиков. Совместить в себе две эти ипостаси в наше время практически невозможно.
Правда всё это или нет, но «эффект Паули» — способность человека разрушительно влиять на эксперимент одним своим присутствием — прочно вошел в физический фольклор. Однако, как и в объяснении Бора, в нем, скорее всего, много преувеличений, если разобраться.
Австрийский, затем швейцарский физик-теоретик. Родился в Вене, в семье профессора Венского университета. Крёстным отцом Паули был Эрнст Мах (см. Ударные волны). Ещё школьником освоил частную и общую теорию относительности. Изучал теоретическую физику в Мюнхенском университете в одной группе с Вернером Гейзенбергом (см. Принцип неопределенности Гейзенберга), диплом защитил в 1922 году.
Паули явился одним из пионеров квантовой механики, внеся в новую научную дисциплину ряд принципиальных вкладов, самым поразительным из которых, вероятно, является его принцип запрета, сформулированный в 1924 году, — за него в 1945 году Паули был удостоен Нобелевской премии по физике. Его идея наличия квантовых спиновых чисел у элементарных частиц была экспериментальна подтверждена двумя годами позже. Кроме того, Паули удалось объяснить кажущееся нарушение закона сохранения энергии при бета-распаде (см. Радиоактивный распад) посредством предположения об излучении при нём, помимо электрона, неизвестной частицы, позже названной нейтрино.
В годы второй мировой войны Паули работал в США, в Принстонском Институте перспективных исследований. По окончании войны вернулся в Европу, принял швейцарское гражданство и занял должность профессора экспериментальной физики в федеральном Институте технологии в Цюрихе.
Что такое принцип запрета Паули и какой? Что гласит правило Паули?
Содержание:
Принцип Паули сформулирован в 1925 году швейцарским физиком Вольфгангом Паули. Также этот принцип называют «запретом» Паули. Он заключается в том, что в атоме не существует пары электронов с одинаковыми свойствами.
Каждый атом можно определить с помощью квантовых чисел. Поэтому правило Паули формулируют следующим образом: существование пары электронов с идентичными квантовыми числами невозможно.
Квантовые числа
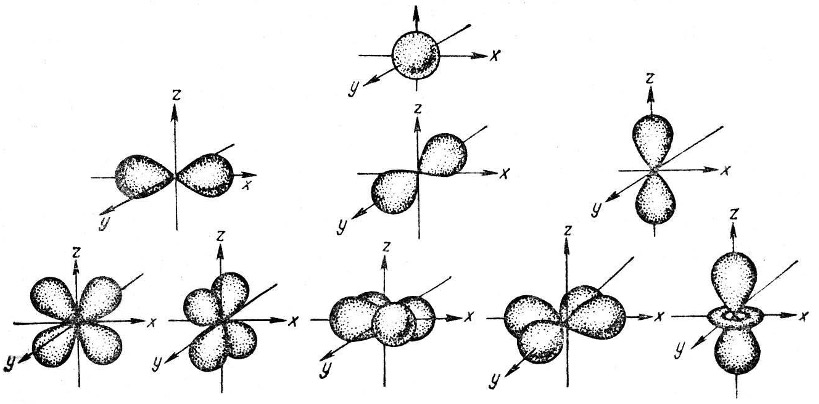
Орбиталь – вероятная область местонахождения электрона. По побочному числу устанавливают состояние энергии отрицательной частицы на орбитали. Благодаря тому, что электрону свойственен дуализм (одновременное действие частицы и волны) образуется электронное облако, форма которого определяется магнитным квантовым числом l.
Доказательства «запрета» Паули
Например, на третьем энергетическом уровне на s-орбитали находятся два электрона. Тогда, согласно закону Паули, набор квантовых чисел для первого электрона будет выглядеть следующим образом:
Для другого электрона характерен такой набор:
Принцип Паули – одно из важнейших правил квантовой химии, которое позволило науке шагнуть вперед и понять природу разнообразия веществ на планете. Ему подчиняются электроны, протоны и нейтроны. Принцип объясняет существование различных атомов в периодической системе Дмитрия Ивановича Менделеева. Запрет Паули также объяснил, почему частицы не ведут себя так, как им вздумается. Он также интересен тем, что не поддерживается никакими физическими силами.
Принцип Паули в физике и химии: особенности применения
История атомной физики насчитывает немало взлетов и падений. Но благодаря техническому прогрессу любое предположение, возникшее в умах теоретиков, могло быть проверено в лабораторных условиях. Поскольку многие аспекты поведения элементарных частиц до сих пор не поддаются законами логики, ученые-первооткрыватели микромира договорились принимать их «как есть», без объяснения причин. Принцип Паули относится к результатам тех экспериментов, которые до сих пор не нашли своего единственного объяснения.
Противоречия в теории атома
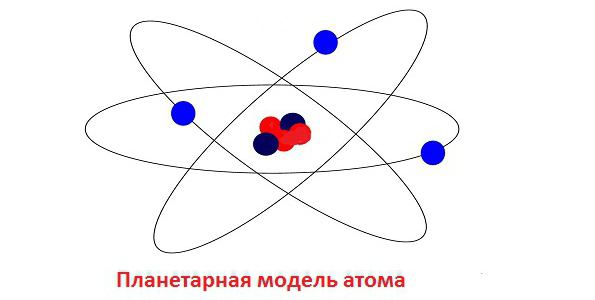
Одним из самых распространенных успешных заблуждений в атомной физике явилась планетарная атомная модель, предложенная английским ученым Эрнестом Резерфордом. Она в итоге оказалась не совсем достоверной, но дала возможность сделать столько правильных выводов, что польза от нее была несомненной.
Теория Бора
В 1913 году молодой неизвестный физик из Дании предложил включить в классическую физику два изменения, с помощью которых можно было объяснить факты наблюдений и совершить множество полезных открытий. Бор не смог объяснить причину поведения электрона на орбите, поэтому в основу своих правил положил принцип «как есть». Данные правила в дальнейшем сослужили хорошую службу и проложили дорогу к новым открытиям.
Правила Бора
Первое правило гласило, что планетарная модель атома, предложенная Резерфордом, все-таки является верной. Но электроны в ней движутся по своим орбитам без излучения. Второе правило Бора утверждает, что движение электронов возможно лишь по определенным «разрешенным» орбитам. У электрона, совершающего свое движение по разрешенной орбите, произведение импульса на радиус этой орбиты всегда кратно постоянной Планка. Таким образом, орбиты электронов могут находиться лишь на тех энергетических уровнях, для которых выполняется следующее правило:
(импульс электрона * длину окружности орбиты) = n * h,
где h – это постоянная планка, а n – натуральное число. Таким образом, при наименьшей разрешенной орбите n = 1. Третье правило говорит о том, что электроны атомов можно переместить (например, бомбардируя их тяжелыми частицами) на свободную внешнюю орбиту. После этого электрон в состоянии вернуться на свободную внутреннюю орбиту. При этом атом испускает избыток энергии в виде кванта света.
Квантовые ограничения
Квантовое правило Бора предполагает, что электроны, которые находятся на самом близком расстоянии к ядру, имеют наименьшую разрешенную орбиту. На этом уровне электрон обладает минимальной энергией. Можно было бы ожидать, что все электроны в атоме должны были бы занять эту орбиту и оставаться на этом уровне. Однако этого не происходит. Объяснить данное противоречие помог принцип Паули.
Вольфганг Паули
Этот знаменитый австрийский физик родился в Вене в 1869 году. В Мюнхенском университете он получил отличное всестороннее образование, но все свои научные труды посвятил квантовой физике. В двадцатилетнем возрасте Паули пишет обзорную статью для Физической энциклопедии, многие страницы которой и в наше время являются актуальными. Его научные работы редко публиковались, важнейшие свои мысли и гипотезы Паули озвучивал в переписке со своими коллегами по научной деятельности. Наиболее оживленная переписка велась с Н. Бором и В. Гейзенбергом. Именно совместная работа трех этих ученых положила начало основам современной квантовой физики. Основываясь на данных экспериментов этих трех виднейших ученых, свой принцип Паули и сформировал. За него в 1945 году австрийский ученый получил Нобелевскую премию.
Движение электронов
Исследуя движение электрона, В. Паули натолкнулся на множество странных моментов в поведении этой элементарной частицы. Например, электроны при движении ведут себя так, как будто вращаются вокруг своей оси. Собственный момент вращения электрона называется спином. На одном месте на орбите могут уместиться два электрона, при этом спины у них должны быть противоположны друг другу, как утверждает принцип Паули. Физика этого ограничения действует не только для электронов, но и для других частиц с полуцелым значением спина.
Периодическая система и принцип Паули
Химия воспользовалась принципом неопределенности для объяснения внутреннего строения веществ. Теперь становится вполне объяснимым, почему в первом ряду таблицы Менделеева находятся лишь два элемента. И водород, и гелий имеют в своем распоряжении единственную нижнюю орбиту, на которой имеется лишь одно сдвоенное место для электронов, имеющих противоположные спины. Следующая орбита вмещает в себя уже восемь таких мест. Поэтому второй ряд периодической системы смогли занять восемь элементов. Данная закономерность простирается на все ряды периодической системы.
Физика звезд
Как ни странно, законы поведения элементарных частиц простираются далеко за пределы микромира. Например, внутренним миром стареющих звезд занимается звездная физика. Принцип Паули работает и здесь, только его понимают немного иначе. Теперь данное правило говорит о том, что в определенном пространственном объеме имеется возможность расположиться лишь двум элементарным частицам с противоположными спинами. Особенно наглядно этот закон действует при наблюдении за стареющими звездами. Как известно, после взрыва сверхновая звезда стремительно коллапсирует, но далеко не все звезды при этом превращаются в черные дыры. При повышении порога предельной плотности (а для стареющей звезды это значение составляет порядка 10 7 кг/м 3 ) внутреннее давление космического тела начитает стремительно расти. Данный процесс имеет особый научный термин – давление вырожденного электронного газа. Таким образом, звезда прекращает терять свой объем и превращается в небольшое небесное тело размером с нашу Землю. Такие звезды в астрофизике называются белыми карликами.
Итоги
Принцип неопределенности – это один из первых законов нового типа, который отличается от всех известных нам представлений об окружающем мире. Новые законы принципиально отличаются от известных нам с детства правил классической физики. Если старые правила говорили о том, что может произойти при осуществлении тех или иных действий, то законы нового типа указывают нам на то, что происходить не должно.
Алгоритмы решения многих задач стоит строить по слегка видоизмененному принципу Паули. Отсекая в самом начале невозможные варианты решения задач, есть шанс найти единственно верный ответ. Практическое использование принципа неопределенности заметно уменьшает время, необходимое для компьютерной обработки информации. Известный ранее лишь в кругу физиков-теоретиков принцип Паули давно вышел за пределы квантовой физики, тем самым обозначив новые методы изучения законов природы.
ПАУЛИ ПРИНЦИП
Если к.-л. две строки детерминанта совпадают, он тождественно обращается в нуль. Отсюда следует, что все наборы квантовых чисел k p должны быть разными, т. е. не м. б. двух электронов в одном состоянии.
Принцип запрета относится и к перестановочной симметрии составных частиц, напр, атомных ядер. В зависимости от спина ядра можно говорить о ядрах-бозонах и ядрах-фермионах. Учет Паули принципа для ядер молекулы проявляется, в частности, во вращательных спектрах. Напр., в молекуле 16 O 2 ядра атомов 16 O состоят из четного числа нуклонов-фсрмионов и потому имеют целочисл. спин (являются бозонами). Это означает, что волновая ф-ция молекулы 16 O 2 должна быть симметричной относительно перестановок ядер. Это приводит к запрету всех вращат. уровней энергии с нечетными значениями вращат. момента, что подтверждается наблюдаемыми закономерностями во вращат. спектрах.
Понятие квантового состояния частицы в системе справедливо в тех случаях, когда взаимод. между частицами можно заменить нек-рым эффективным полем, а каждую частицу можно характеризовать индивидуальным набором квантовых чисел; при строгом рассмотрении системы взаи мод. частиц существуют только квантовые состояния всей системы в целом. Одночастичное приближение лежит в основе метода самосогласов. поля (метод Хартри-Фока; см. Молекулярных орбиталей методы), широко применяемого в теории атомных и мол. спектров, квантовой теории хим. связи, при описании оболочечных моделей атома и ядра и т.д.
Лит.: Ван-Дер-Варден Б., в сб.: Теоретическая физика 20 в., M., 1962, с. 231; Паули В., там же, с. 357; Каплан И. Г., “Успехи фнз. наук”, 1975, т. 117, в. 4, с. 691–704; его же, в сб.: Теоретико-групповые методы в физике, т. 1, M., 1980, с. 175; Ландау Л. Д., Лифшиц E. M., Квантовая механика, 4 изд.. M., 1989. И. Г. Каплан.