для каких элементов разработано правило таммана
Принципы коррозионностойкого легирования
Если легирующий элемент, обладающий более высокой коррозионной стойкостью или лучшей пассивируемостью, образует с основным металлом твердый раствор в достаточно широком диапазоне концентраций, коррозионная устойчивость сплава при условии незначительной диффузионной подвижности его компонентов резко возрастает при определенных содержаниях легирующего элемента, кратных 1/8 его атомной доли (правило n/8 Таммана). Скачкообразное изменение коррозионной стойкости с изменением состава сплава, объясняется образованием в сплаве при определенных концентрациях сверхструктур, характеризующихся упорядоченным расположением атомных плоскостей, обогащенных атомами более благородного или легко пассивирующегося металла. Конкретные значения пороговых концентраций зависят как от природы легирующей добавки, так и от состава коррозионной среды.
В соответствии с правилом n/8 могут быть рассчитаны теоретически возможные пороги устойчивости двойных и тройных металлических систем, что позволяет более рационально подойти к выбору состава коррозионностойких сплавов. Для расчета содержания легирующего элемента в стойком бинарном сплаве, выраженного в массовых процентах применяются соотношения:
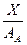
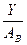
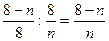
Для тройного сплава:
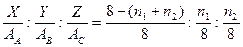
где, входит массовый процент Z и атомная масса AС третьего компонента, а также целые числа n1 и n2.
Правило Таммана в значительной степени носит феноменологический характер. Исследования по изучению влияния легирования на коррозионную стойкость сплавов показали, что не всегда содержание легирующего компонента, вызывающее скачкообразное увеличение коррозионной стойкости, строго соответствует правилу n/8. При этом скачкообразное увеличение коррозионной стойкости при легировании сплава более легко пассивирующимся компонентом может происходить и без образования упорядоченного твердого раствора.
Дата добавления: 2017-02-13 ; просмотров: 2035 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Систематическое изучение механизма реакций в смесях твердых веществ было начато примерно 35—40 лет назад работами Хедвала [226, 227], Таммана [228, 229] и их сотрудников. Пользуясь методом снятия кривых нагревания исходных смесей и конечных продуктов (рис. 44), Хедвал и Хейбергер [226] наблюдали так называемые реакции перемены мест кислотных остатков, протекающие между кристаллическими окислами металлов и солями кислородных кислот по схеме
С помощью того же метода Тамман с сотрудниками [228, 229] исследовал многочисленные взаимодействия кислотных окислов с основными, окислов металлов с сульфатами, нитратами, сульфидами и металлами, а также солей с металлами.
На основании своих исследований Тамман [2281 и Хедвал [230] сформулировали ряд принципиальных заключений о механизме и специфических закономерностях реакций в кристаллических смесях.
Эти заключения могут быть сведены к следующему.
1. Реакции, возникающие в смесях кристаллических тел, например солей кислородных кислот и окислов основных и кислотных, металлов и окислов, сульфидов и металлов, сульфидов и окислов ит. п., при их нагревании протекают за счет непосредственного взаимодействия между зернами этих тел. Сколько-нибудь существенная роль жидких и газообразных веществ в этих реакциях исключается.
2. Реакция • между твердыми веществами идет с выделением тепла. Иначе говоря, между твердыми веществами возможны лишь экзотермические взаимодействия.
4. Температура начала реакции соответствует температуре интенсивного обмена местами элементов кристаллических решеток реагирующих веществ и температуре начала их спекания (совпадает с этой температурой). Температура начала реакции между окислом и солью («реакции перемены места кислотного остатка») определяется подвижностью элементов кристаллической решетки окисла.
5. В случае полиморфного превращения одного из компонентов смеси при относительно низкой температуре (ниже температуры реакции в отсутствие такого превращения) химическая реакция начинается и интенсивно протекает в точке этого полиморфного превращения.
При нагревании кристаллических тел жидкость может появляться в результате их плавления и газ — главным образом в результате их возгонки и диссоциации. Эти явления не играют сколько-нибудь существенной роли в строго твердофазовых реакциях, осуществляемых за счет непосредственного взаимодействия между кристаллическими телами.
В связи с этим целесообразно вкратце рассмотреть обоснования приведенных выше положений Таммана и Хедвала.
Подчеркнем прежде всего еще раз следующее часто упускаемое из виду обстоятельство: в любом случае довод основателен для признания процесса строго твердофазовым, если доказано одновременное отсутствие существенной роли жидкой и газовой фаз в механизме этого процесса.
Известно, что очень многие исследования Таммана и Хедвала касаются взаимодействий окисей бария и стронция.с различными реагентами. Баларев [44, 245, 259] в свое время обращал внимание на возможность содержания Н.:0 в этих окислах и плавления их гидратов в опытах Таммана и Хедвала. Много лет спустя это соображение Баларева было экспериментально подтверждено точными исследованиями Ягича, установившего, что полностью освободиться обычными методами от содержания воды в окислах бария и стронция практически невозможно [239].
Для подтверждения второго из приведенных выше доводов, касающегося протекания реакции при температурах, более низких, чем температура появления жидкой фазы в системе, Тамман провел специальное исследование. Он сопоставил температуру появления жидкой фазы в смесях некоторых окислов с температурой реакции между ними. О температуре появления жидкой фазы судили при этом по вызываемому ею резкому уменьшению электрического сопротивления системы.
Во всех изученных Тамманом в связи с этим случаях реакционная смесь самопроизвольно разогревалась за счет тепла реакции. На основании полученных данных Тамман заключил, что так как температура t1 начала реакции никак не связана с температурой t3 появления жидкой фазы в системах, то последняя не играет сколько-нибудь существенной роли в процессах взаимодействия кристаллическ их тел и эти процессы являются твердофазовыми (табл. 16).
В связи с этим следует заметить, что в первых двух случаях (СuО + Мо03 и СuО + WO3) реакция начинается после появления жидкой фазы в системе; в последующих четырех случаях температура начала реакции совпадает с температурой появления жидкой фазы. Таким образом, половина приведенных результатов даже на первый взгляд не согласуется с заключением, сделанным в свое время по данным таблицы. Почти во всех случаях (кроме одного) t2 > t3, т. е. изученные реакции протекали фактически при температуре t2, превышающей температуру t3 появления жидкой фазы в системе, хотя начало реакций и относилось к t1
Для каких элементов разработано правило таммана
В нашей онлайн базе уже более 10821 рефератов!
|










