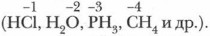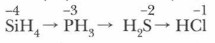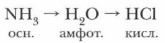для каких элементов характерны летучие водородные соединения
Большая Энциклопедия Нефти и Газа
Летучее водородное соединение
Летучие водородные соединения В и элементов подгрупп IVA-VIIA газообразны; в них связь близка к ковалентной. [2]
Какие летучие водородные соединения образуют элементы подгруппы углерода. [8]
Из летучих водородных соединений в табл. 8 приведены только простейшие. Наряду с ними образуются также высокомолекулярные летучие водородные соединения, которые получаются вследствие соединения более простых радикалов. Особенно сильно это проявляется в случае углерода, который, как известно, кроме СН4, образует большое число высших углеводородов. В меньшей степени это характерно для бора и кремния. Для летучих соединений водорода с остальными элементами способность к образованию цепей, если она вообще проявляется, ограничивается объединением двух радикалов. [9]
Из летучих водородных соединений в табл. 8 приведены только простейшие. Наряду с ними образуются также высокомолекулярные летучие водородные соединения t которые получаются вследствие соединения более простых радикалов. Особенно сильно это проявляется в случае углерода, который, как известно, кроме СН4, образует большое число высших углеводородов. В меньшей степени это характерно для бора и кремния. Для летучих соединений водорода с остальными элементами способность к образованию цепей, если она вообще проявляется, ограничивается объединением двух радикалов. [10]
Из летучих водородных соединений в табл. 8 приведены только простейшие. Наряду с ними образуются также высокомолекулярные летучие водородные соединения, которые получаются вследствие соединения более простых радикалов. Особенно сильно это проявляется в случае углерода, который, как известно, кроме СН4, образует большое число высших углеводородов. В определенной степени это характерно для бора и кремния. Для летучих соединений водорода с остальными элементами способность к образованию цепей, если она вообще проявляется, в основном ограничивается объединением двух радикалов. [12]
Усиление восстановительных свойств летучих водородных соединений в подгруппах по мере увеличения порядкового номера элемента является общей закономерностью для всех главных подгрупп. [14]
Как изменяются свойства летучих водородных соединений в периодах. [15]
Для каких элементов характерны летучие водородные соединения
Водородные соединения неметаллов представляют собой газообразные соединения, кроме воды. Они летучие и легкоподвижные, быстроиспаряемые.
Электроотрицательность неметаллов больше электроотрицательности водорода, поэтому в водородных соединениях неметаллы проявляют минимальную отрицательную степень окисления: углерод — минус четыре, азот — минус три, фосфор — минус три и так далее.
Водородные соединения неметаллов проявляют основные, кислотные или амфотерные свойства. Водородные соединения неметаллов являются, как правило, сильными восстановителями.
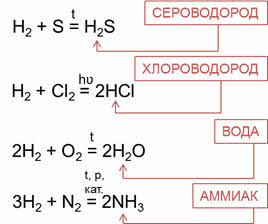
Водородные соединения неметаллов можно получить непосредственно взаимодействием неметалла с водородом. Сероводород можно получить реакцией водорода с серой, хлороводород – реакцией водорода с хлором, воду – реакцией водорода и кислорода, аммиак – реакцией водорода и азота.
В водородных соединениях присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую решётку.
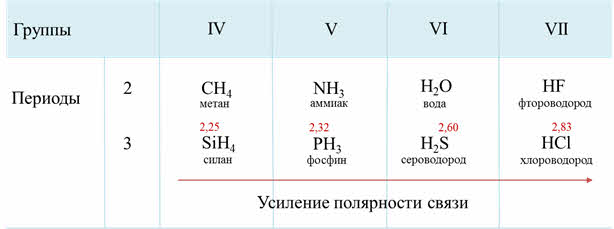
Как известно, электроотрицательность усиливается по периоду слева направо, поэтому полярность связи в водородных соединениях возрастает, а в группах сверху вниз электроотрицательность уменьшается, поэтому и полярность связи будет уменьшаться.
Если рассмотреть третий период, то от силена до хлороводорода будет наблюдаться усиление полярности связи из-за увеличения электроотрицательности неметаллов.
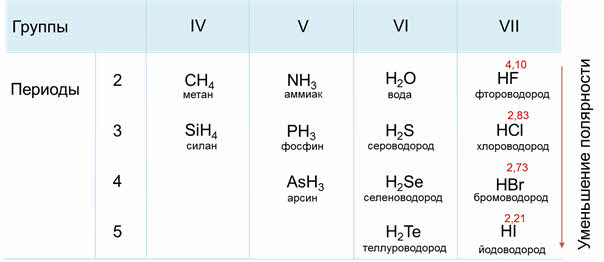
В седьмой A группе сверху вниз будет идти уменьшение полярности связи от фтороводорода к йодоводороду, потому что идёт уменьшение электрооотрицательности элемента-неметалла в водородном соединении.
Полярность связи влияет на растворимость водородного соединения в воде. Например, так как молекула воды сильно полярна, то возникает сильное межмолекулярное взаимодействие с образованием водородных связей.
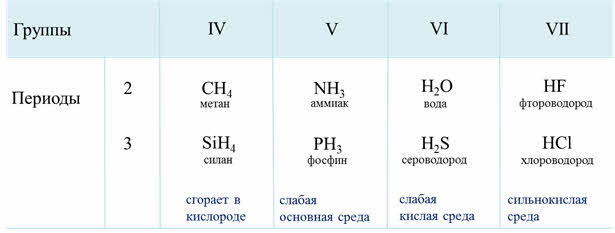
Если рассмотреть водородные соединения неметаллов третьего периода, то здесь можно проследить следующую закономерность: при растворении в воде силана не наблюдается проявление кислотно-основного характера соединения, он сразу сгорает в кислороде, фосфин в воде даёт слабую основную среду, сероводород – слабую кислую среду, а хлороводород – сильнокислую среду. Это объясняется тем, что от силана до хлороводорода радиус иона неметалла уменьшается, а заряд ядра увеличивается, полярность связи в молекулах возрастает, поэтому усиливаются кислотные свойства.
В группах сверху вниз кислотные свойства водородных соединений неметаллов усиливаются, так как прочность связи водород-элемент уменьшается, из-за увеличения длины связи.
Например, водородные соединения седьмой A группы: хлороводород, бромоводород, йодоводород в воде – это сильные кислоты, которые полностью диссоциируют. Из этих кислот самой слабой является фтороводородная. Это объясняется тем, что у фтора самый маленький радиус, кроме этого, в этой молекуле присутствуют межмолекулярные водородные связи.
Таким образом, в периодах и группах главных подгруппах с увеличением заряда ядер элементов-неметаллов усиливаются кислотные свойства, а ослабевают основные свойства.
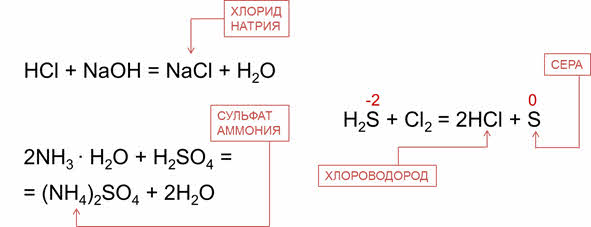
Например, водный раствор хлороводорода – проявляет кислотные свойства, поэтому реагирует со щелочами. Так, в реакции соляной кислоты с гидроксидом натрия образуется соль – хлорид натрия и вода. Водный раствор аммиака проявляет основные свойства, поэтому реагирует с кислотами. Так, в реакции аммиака с серной кислотой образуется сульфат аммония и вода.
Как было сказано, водородные соединения неметаллов проявляют восстановительные свойства, так как элемент-неметалл здесь в минимальной степени окисления. Например, в реакции сероводорода с хлором сероводород является восстановителем, потому что сера повышает свою степень окисления с минус двух до нуля.
Таким образом, все солеобразующие оксиды, образованные неметаллами, обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления неметалла и радиуса иона. В периодах слева направо кислотный характер гидроксидов, образованных оксидами неметаллов усиливается, а в группах сверху вниз кислотный характер гидроксидов ослабевает. В периодах слева направо кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются. В группах сверху кислотные свойства водородных соединений увеличиваются. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
Домашнее задание: выполните в тетрадь один из предложенных вариантов.
Цель: Рассмотрите строение метана и силана, особенности их свойств.
1. Строение молекулы метана.
а) определите тип химической связи, изобразите механизм образования химической связи в молекуле метана;
б) составьте электронную и структурную формулы метана;
в) охарактеризуйте пространственное строение метана;
г) исчерпаны ли валентные возможности атома углерода в молекуле метана;
2. Химические свойства метана.
а) отношение к воде;
б) взаимодействие с галогенами, азотной и серной кислотами. Составьте УХР этих взаимодействий.
в) отношение к нагреванию без доступа кислорода воздуха. Составьте УХР разложения метана.
г) взаимодействие СН4 и SiH4 с кислородом. Составьте УХР горения метана и силана. Чем отличаются реакции взаимодействия с кислородом метана и силена?
Цель: Изучить строение и свойства водородных соединений азота и фосфора.
1. Строение молекул аммиака и фосфина.
а) определите тип химической связи в молекулах NH3 и PH3. Какой тип кристаллической решетки имеют вещества?
б) опишите физические свойства этих соединений.
в) составьте электронную формулу аммиака, охарактеризуйте пространственное строение аммиака.
2. Химические свойства аммиака.
а) отношение аммиака к воде и кислотам. Составьте УХР этих взаимодействий.
б) окислительно – восстановительные свойства аммиака. Составьте УХР следующих взаимодействий:
— взаимодействие с кислородом при различных условиях;
— взаимодействие с оксидом меди ( II );
— хлор и бром энергично окисляют аммиак до азота.
Чем в этих ОВР выступает аммиак?
Демонстрация: Получение аммиака и растворение его в воде.
Цель: Изучить строение молекулы воды и ее свойства.
а) Составьте электронную и структурную формулы молекулы воды;
б) Каково пространственное строение молекулы воды?
в) Исчерпаны ли валентные возможности воды?
г) Физические свойства воды.
2. Химические свойства воды.
а) отношение воды к неорганическим веществам:
— кислотным и основным оксидам;
Составить возможные УХР.
б) отношение к органическим веществам:
— сложным эфирам (жирам);
Составьте возможные УХР.
в) окислительно-восстановительные свойства воды:
— взаимодействие воды с натрием, углем.
Цель: Изучить строение и свойства сероводорода.
1. Строение молекулы сероводорода:
а) Составьте электронную и структурную формулы молекулы H2S
б) Особенности пространственного строения молекулы сероводорода.
2. Физические и химические свойства сероводорода:
а) особенности физических свойств;
б) химические свойства:
— кислотно-основные (приведите примеры УХР, где сероводород проявляет кислотные свойства);
Составить УХР горения H 2 S в кислороде. Закончите УХР взаимодействия сероводорода с раствором перманганата калия в кислой среде (уравнять методом полуреакций).
Цель: Рассмотреть строение и свойства галогеноводородов.
1. На примере хлороводорода рассмотрите электронное строение молекулы. Изобразите электронную и структурную формулы молекулы хлороводорода.
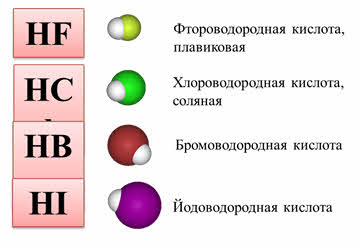
2. Как изменяется сила кислот в ряду HF-HCl-HBr-HI? Почему?
3. Химические свойства галогеноводородов на примере HCl.
— охарактеризуйте отношение водородных соединений галогенов к органическим веществам:
Составьте возможные УХР взаимодействия HCl с органическими веществами.
Домашнюю работу высылать не нужно, просмотрю в школе
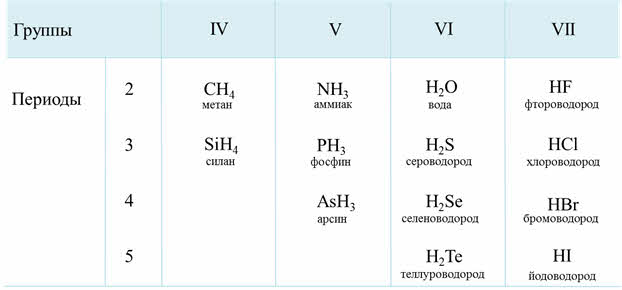
Летучие водородные соединения.



В ПС внизу есть горизонтальная строка «Летучие водородные соединения».
Там перечислены формулы: RH4 RH3 RH2 RH
Каждая формула относится к своей группе.
Например, написать формулу летучего водородного соединения N(азот).
Находим его в ПС и смотрим, какая формула записана под V группой.
Там RH3. Вместо R подставляем элемент азот, получается аммиак NH3.
SiH4 – силан бесцветный газ с неприятным запахом
PH3 – фосфин ядовитый газ с запахом гнилой рыбы
NH3 аммиак газ с резким раздражающим запахом.
Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве которых неметалл имеет низшую степень окисления.
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметалла с водородом, т. е. синтезом:
Все водородные соединения неметаллов образованы ковалентными полярными связями, имеют молекулярное строение и при обычных условиях являются газами, кроме воды (жидкость).
При растворении в воде сероводорода, селеноводорода, теллуроводорода, а также галогеноводородов образуются кислоты с той же формулой, что и сами водородные соединения: H2S, H2Se, Н2Те, HF, НСl, HBr, HI.
Если сравнить кислотно-основные свойства водородных соединений, образованных неметаллами одного периода, например 2-го (NH2, Н2O, HF) или 3-го (РН3, H2S, НСL), то можно сделать вывод о закономерном усилении их кислотных свойств и соответственно ослаблении основных. Это связано с тем, что увеличивается полярность связи Э—Н (где Э — неметалл).
Кислотно-основные свойства водородных соединений неметаллов одной подгруппы также отличаются. Например, в ряду галогеноводородов HF, НСl, HBr, HI прочность связи Э—Н уменьшается, так как увеличивается длина связи. В растворах НСl, HBr, HI диссоциируют практически полностью — это сильные кислоты, причем их сила увеличивается от HF к HI. При этом HF относится к слабым кислотам, что обусловлено еще одним фактором — межмолекулярным взаимодействием, образованием водородных связей:
Атомы водорода Н связаны с атомами фтора F не только своей молекулы, но еще и соседней.
Обобщая сравнительную характеристику кислотно-основных свойств водородных соединений неметаллов, сделаем вывод об усилении кислотных и ослаблении основных свойств этих веществ по периодам и главным подгруппам с увеличением атомных номеров образующих их элементов.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителей, ведь в них неметалл имеет низшую степень окисления.
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
§ 14. Водородные и кислородные соединения неметаллов

Приведенные в нижней части периодической системы Д.И. Менделеева общие формулы высших кислородных и летучих водородных соединений элементов разных групп отражают типичные для этих групп элементов формы их соединений. Понятие «форма соединений» ввел в химию Д.И. Менделеев.
Общие формулы отражают состав соединений, типичный для целой группы или подгруппы элементов.
Задание. Опираясь на общие формулы водородных и кислородных соединений элементов 3-го периода, отметьте закономерные изменения состава и свойств этих соединений, а также изменения характера элементов.
Элементы-неметаллы, в отличие от металлов, имеют газообразные водородные соединения.
Их состав зависит от степени окисления неметалла
При рассмотрении свойств летучих водородных соединений неметаллов в соответствии с их положением в периодах периодической системы можно наблюдать некоторые общие закономерности в изменении их свойств (полярность, растворимость, характер водородных и кислородных соединений).

В этом же порядке возрастают растворимость соединений в воде, их кислотность и прочность.
Вы уже знакомы с хорошей растворимостью хлороводорода в воде.

Рассмотрим сущность этого процесса: молекулы хлороводорода полярны, хорошо растворимы в воде и диссоциируют в ней по уравнению:
В периодах слева направо усиливается кислотный характер водородных соединений неметаллов:
В А-группах полярность молекул, растворимость и основный характер водородных соединений неметаллов в воде, наоборот, уменьшаются при переходе сверху вниз:
Газообразные водородные соединения, присущие p-элементам главных подгрупп, подчеркивают их неметаллический характер.