для наследственной сенсорно вегетативной полиневропатии 3 типа какие существуют критерии диагностики
Наследственная моторная и сенсорная невропатия
Общая информация
Краткое описание
Протокол «Наследственная моторная и сенсорная невропатия»
Коды по МКБ-10: G 60,0
— Болезнь Шарко-Мари Тута (наследственная мотосенсорная невропатия, тип I)
— Наследственная моторная и сенсорная невропатия, типы I-IV
— Гипертрофическая невропатия у детей
— Перонеальная мышечная атрофия (аксональный тип, гипертрофический тип)
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Клинико-генетическая классификация наследственных мотосенсорных невропатий
Аутосомно-доминантная наследственная мотосенсорная невропатия, тип I:
— обусловленная дупликацией 17 р 11.2;
— обусловленная точковыми мутациями гена миелина РМР-22.
Тип I В: обусловленная точковыми мутациями гена миелина Ро.
Тип I С: с неидентифицированным генетическим дефектом.
Аутосомно-рецессивная наследственная мотосенсорная невропатия, тип I: с неидентифицированным генетическим дефектом.
Аутосомно-доминантная наследственная мотосенсорная невропатия, тип II: с неидентифицированным генетическим дефектом.
Аутосомно-рецессивная наследственная мотосенсорная невропатия, тип II: с неидентифицированным генетическим дефектом.
Наследственная мотосенсорная невропатия, тип III:
— обусловленная дупликацией 17 р 11.2;
— обусловленная точковыми мутациями гена миелина РМР-22;
— обусловленная точковыми мутациями гена миелина Ро.
Х- сцепленная наследственная мотосенсорная невропатия:
— обусловленная точковыми мутациями и делециями коннексина 32;
— с неидентифицированным генетическим дефектом.
Сложные формы наследственных мотосенсорных невропатий:
— с пирамидными симптомами;
— с атрофией зрительных нервов;
— с атрофией зрительных нервов и глухотой;
— с пигментной ретинопатией;
— с кератодермией ладоней и стоп.
Диагностика
Диагностические критерии
Жалобы и анамнез: мышечная утомляемость, атрофии, боли в дистальных отделах конечностей по «полиневритическому типу», костные деформации, нарушение походки, задержка моторного развития, прогрессирующее течение.
Для наследственной мотосенсорной невропатии, тип I характерен аутосомно-доминантный тип наследования, дебют заболевания преимущественно в 1-2 десятилетие жизни, медленно-прогрессирующий характер течения.
Лабораторные исследования: общий анализ крови и мочи без патологии.
Инструментальные исследования
ЭМГ различна: для наследственной мотосенсорной невропатии, тип I характерно снижение скорости проведения импульса по моторным и сенсорным волокнам.
Для болезни Шарко-Мари снижение скорости проведения импульса по моторным и сенсорным волокнам.
Для болезни Дежерина-Сотта значительное снижение (менее 12 м/с) скорости проведения импульса по периферическим нервам.
Для наследственной мотосенсорной невропатии, тип II (аутосомно-рецессивная форма) на ЭМГ характерно значительное снижение скорости проведения импульса по периферическим нервам (менее 38 м/с).
Для наследственной мотосенсорной невропатии, тип II (аутосомно-доминантная форма) умеренное снижение скорости проведения импульса по периферическим нервам.
Показания для консультации специалистов:
Минимум обследования при направлении в стационар:
1. Общий анализ крови и мочи.
4. Кал на яйца глист.
Основные диагностические мероприятия:
1. Общий анализ крови.
2. Общий анализ мочи.
Дополнительные диагностические мероприятия:
Дифференциальный диагноз
Дифференциально-диагностические признаки аутосомно-доминантных наследственных мотосенсорных невропатий
Аутосомно-доминантная наследственная мотосенсорная невропатия
Для наследственной сенсорно вегетативной полиневропатии 3 типа какие существуют критерии диагностики
Наследственные периферические сенсорные невропатии редки, и окончательный диагноз достаточно сложен. Из-за противоречивой терминологии классификация не упорядочена (Axelrod и Pearson, 1984), а некоторые диагностические тесты могут быть недоступны за пределами специализированных центров. Общее лечение сенсорных невропатий обсуждается Klein и Dyck (2005а).
а) НСВН I (сенсорная корешковая невропатия, acropathie ulceromutilante). НСВН I отличается от всех остальных НСВН тем, что при ней симптомы появляются поздно, обычно после первого десятилетия жизни, а не в грудном возрасте. Наследование аутосомно-доминантное. Ген классической формы, ген длинноцепочечной субъединицы 1 серин-пальмитоилтрансферазы (SPTLC1), участвует в биосинтезе фосфолипидов и картирован на 9q22.1-q22.3 (Dawkins et al., 2001). Патоморфологическое исследование показывает заметное сокращение числа немиелинизированных волокон. Уменьшение толстых и тонких миелинизированных волокон меньше, но достаточно выраженное.
Ганглии задних корешков и задние корешки спинного мозга, связанные с нижними конечностями, дегенерированы. Симптомы появляются в старшем детском возрасте или пубертатном периоде в виде прогрессирующей потери чувствительности в нижних конечностях, быстро осложняющейся эпизодами целлюлита и трофическими язвами на ногах. Может встречаться спонтанная пронизывающая боль. При этом происходит потеря болевой и температурной чувствительности с сохранением тактильной чувствительности. Позднее возможно полное исчезновение чувствительности и поражение дистальных отделов верхних конечностей. Часто присутствует нейросенсорная тугоухость. В конечном итоге нередка перонеальная слабость. Моторные скорости проведения по нерву умеренно снижены, а сенсорные потенциалы действия отсутствуют. Течение заболевания медленно прогрессирующее. НСВН I гетерогенна. Мутации RAB7 могут вызвать подобную картину или более типичный фенотип синдрома Шарко-Мари-Тута (ШМТ 2В).
Другой похожий аутосомно-доминантный синдром с более поздним началом и явными симптомами гастроэзофагеального рефлюкса и кашлем был локализован на 3р22-р24 (Kok et al., 2003). Зарегистрирована форма с рано начинающейся деменцией (Wright и Dyck, 1995).
б) НСВН II (врожденная сенсорная невропатия). Заболевание представляет собой аутосомно-рецессивное состояние с врожденным или ранним началом. У большинства пациентов клинически проявляется отсутствие всех видов болевой чувствительности, приводящее к ожогам и калечащим повреждениям губ или кончиков пальцев и к безболезненным переломам, особенно в метатарзальной области. Тактильная чувствительность также заметно нарушена. Зоны нормальной чувствительности сохраняются у некоторых пациентов с преобладающим поражением конечностей и лица. При растяжении мочевого пузыря может нарушаться его ощущение (Verity et al., 1982). У некоторых пациентов описана глухота (Verity et al., 1982). У большинства пациентов болезнь не выглядит прогрессирующей или же развивается очень медленно (Ferriere et al., 1992).
Некоторые случаи могут иметь более быстрое течение с клиническими признаками прогрессии (Johnson и Spalding, 1964), что согласуется с дегенерацией и регенерацией нервных волокон, выявляемых при биопсии нерва. Моторные скорости проведения сохранны или только немного уменьшаются, но сенсорные потенциалы действия не выявляются. Кроме того, у некоторых пациентов отсутствовали соматосенсорные вызванные потенциалы с нижних конечностей. Биопсия нерва часто показывает значительно атрофированные нервы. Количество миелинизированных аксонов сильно уменьшается, но немиелизированные волокна обычно в пределах нормы или незначительно уменьшены. Анализ связей двух многочисленных канадских семей позволил идентифицировать новый ген, HSN2, который располагается в пределах 8 интрона гена PRKWNK1 (Lafreniere et al., 2004). Функция HSN2 неизвестна. Мутация в том же самом гене была впоследствии идентифицирована в пораженной семье из Ливана.
в) НСВН III (семейная вегетативная дисфункция, синдром Райли-Дея). НСВН III является наиболее распространенной среди сенсорных и вегетативных невропатий. Заболевание преобладает среди евреев-ашкенази, у которых частота болезни между 0,5 и 1 на 10000 живых новорожденных с предполагаемой частотой носительства 1 на 50. Имеются редкие сообщения о случаях у нееврейских пациентов (например, Guzzetta et al., 1986). Заболевание передается как аутосомно-рецессивный признак, вызванный мутациями гена IKBKAP, который картирован на участке хромосомы 9q31 (Slaugenhaupt et al., 2005). Результаты гистопатологического исследования включают потерю нейронов в задних корешках, краевой зоне Лиссауэра и интермедиолатеральных столбах серого вещества (Pearson и Pytel, 1978) и потерю немиелинизированных и миелинизированных волокон в периферических нервах, где отмечается недостаток катехоламинэргических окончаний (Pearson et al., 1974).
Иммунологическая реактивность субстанции Р в substantia gelatinosa спинного мозга и в продолговатом мозге равным образом истощается (Pearson et al., 1982). Симпатические ганглии гипоплазированы.
Клинические проявления относятся главным образом к вегетативной нервной системе. Начало является врожденным, и гипотония, проблемы с сосанием, слабый крик и рвота присутствуют с рождения. Задержка роста становится заметной в дальнейшей жизни. Избыточное слезотечение не проявляется. Кожная сыпь, моторная дискоординация, нестабильность температуры и кровяного давления, циклическая рвота и слюнотечение варьируют. Типично относительное безразличие к боли (Axelrod et al., 1981). Восприятие температуры, потоотделение и иннервация кожи были изучены Hilz et al. (2004). Приступы апноэ и пневмония распространены, являясь обычно причиной смерти в грудном возрасте и детстве. Часто выявляются дилатация пищевода и нарушения моторики желудка. Постуральная гипотензия присутствует практически всегда. Большой проблемой является сколиоз. Глоточный рефлекс часто слабый. Диагностические критерии включают отсутствие грибовидных сосочков на языке, снижение или отсутствие глубоких сухожильных рефлексов, отсутствие слезотечения, миоз после закапывания в глаза 2,5% метахолина хлорида и отсутствие аксонального покраснения после гистаминовой инъекции внутри-кожно (Axelrod et al., 1974). Ни один из критериев не специфичен и может выявляться при других невропатиях. Пренатальный диагноз возможен.
Течение семейной вегетативной дисфункции тяжелое; ранние исследования показывают, что в 1960-е годы только 20% пациентов доживало до взрослого возраста, хотя к 1980-м за счет улучшения лечения показатель возрос до 50% (Axelrod и Abularrage, 1982). Осложнения со стороны пищеварительной и дыхательной систем распространены и могут усугубляться часто развивающимся кифосколиозом. Распространена эмоциональная неустойчивость с повторяющимися тяжелыми приступами задержки дыхания. Интеллект остается нормальным.
Лечение симптоматическое. Риск аспирационной пневмонии должен быть минимизирован за счет внимания к позе и тщательной профилактики во время кормления, что может потребовать питания через зонд, гастростомии или фундопликации. Диазепам эффективен в сочетании с хлорпромазином для лечения острых кризов и гипертензии. Лечение сколиоза затруднительно, в некоторых случаях возможна лишь частичная хирургическая коррекция искривления (Kaplan et al., 1997). Семьи больных детей нуждаются в значительной психологической поддержке.
г) НСВН IV (врожденная нечувствительность к боли с ангидрозом). При этом редком нарушении из-за мутации гена рецептора фактора роста нервов TRK/NGF отмечается отсутствие немиелинизированных нервных волокон в периферических нервах (Goebel et al., 1980). Также поражаются тракт Лиссауэра и дорсальные корешки спинного мозга. Заболевание возникает как врожденное с эпизодами необъяснимого повышения температуры, часто связанного с температурой окружающей среды. Типично отсутствие потоотделения (ангидроз). Нечувствительность к боли универсальна и приводит к ранам, самотравмированию и остеомиелиту, особенно нижних конечностей. Часто происходит прикусывание языка. Встречаются кожная сыпь и повышенная чувствительность зрачков к метахолина хлориду (Axelrod и Pearson, 1984). Как правило, имеется задержка интеллектуального развития, показатели IQ варьировали от 41 до 78, в большинстве случаев около 60 (Rosemberg et al., 1994). Моторные и сенсорные скорости проведения нерва нормальны или почти нормальны. Об умеренной форме без ангидроза сообщено Pavone et al., (1992).
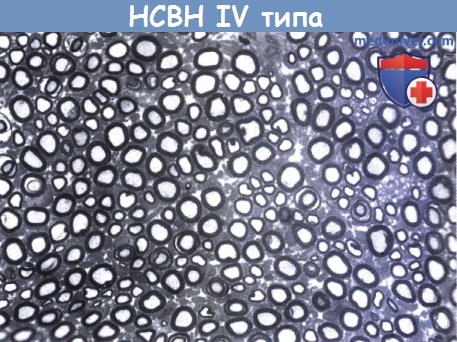
Имеется очаговый дефицит тонких миелинизированных волокон.
Немиелинизированные волокна были очень разреженные при электронном микроскопическом исследовании.
д) НСВН V. НСВН V типа представляет собой врожденную нечувствительность к боли со сниженной тепловой чувствительностью, но с сохранением реакции на осязательные и механические стимулы и задержкой глубоких сухожильных рефлексов (Low et al., 1978). С патоморфологической точки зрения характерно практически полное исчезновение малых миелинизированных волокон и умеренным уменьшением числа немиелинизированных волокон. Результаты рутинных исследований моторного и сенсорного проведения по нерву в пределах нормы. Возможный локус для НСВН V на участке хромосомы 1р11.2-р13.2 был идентифицирован в многочисленной шведской семье со сниженным ощущением глубокой боли и температуры, но с нормальными когнитивными способностями. Анализ функционирующих генов-кандидатов в критической для болезни области показывает мутацию в кодирующем участке гена бета-рецептора фактора роста нерва (NGFb) (Einarsdottir et al., 2004).
е) Другие формы НСВН с нечувствительностью. Описано несколько редких и/или спорных типов НСМН. Дополнительные типы включают НСВН с дефицитом гормона роста (Liberfarb et al., 1993), прогрессирующую панневропатию с гипотензией (Axelrod и Pearson 1984), тип НСВН без трофических изменений (Bye et al., 1990), НСВН с нейротрофическим кератитом (Donaghy et al., 1987), врожденную сенсорную невропатию с ихтиозом и синдромом передней камеры глаза (Quinlivan et al., 1993), глухоту, сенсорную невропатию и овариальный агенез (Linssen et al., 1994), и НСВН с катарактами, олигофренией и поражениями кожи (Heckmann et al., 1995). НСВН, связанная со спастической параплегией, включает два различных типа, один поражает в основном мелкие сенсорные волокна (Cavanagh et al., 1979а), а другой — крупные волокна с немногочисленными невропатическими симптомами (Schady и Smith 1994). Кроме того, два различных типа сенсорной невропатии были описаны у детей индейского племени навахо (Appenzeller et al., 1976; Johnsen etal., 1993).
Некоторые случаи сенсорной невропатии могут имитировать жестокое обращение с детьми (Makari et al., 1994).
Термин нечувствительность к боли в принципе относится к пациентам, у которых аналгезия — результат патологии периферических нервов, нервных окончаний в коже или центральных сенсорных проводящих путей, тогда как безразличие к боли относится к тем, кто имеет нормальные сенсорные проводящие пути, но не в состоянии определить болезненную природу стимулов (Manfredi et al., 1981). Такое различие может быть во многом искусственным, и Dyck et al. (1983) подчеркнули факт, что точный анализ безразличия к боли с помощью современных методов показывает патологию периферической сенсорной системы. Однако сообщалось о случае с нормальным результатом морфометрического исследования нерва (Landrieu et al., 1990), и недавно описаны семейные случаи из-за мутаций в гене натриевого канала Navi.7 (Сох et al., 2006, Goldberg et al., 2007).
е) Смешанные сенсорные и вегетативные невропатии. Для редких случаев поражения вегетативной нервной системы характерна боль. Описан семейный доминантный синдром раннего начала пароксизмальной ректальной боли, связанной с одно- или двусторонней вазодилятацией в нижних конечностях и органах брюшной полости и часто вызываемой дефекацией. Позже возможна боль глазной и субмаксиллярной локализации. Во время приступов часто встречаются обмороки. Данное состояние, именуемое теперь пароксизмальным расстройством с чрезвычайной болью было определено как результат мутаций в гене рецептора Nav1.7 (Fertleman et al., 2007). Этот же ген мутирует и при эритромелалгии, характеризующейся приступами дистальной боли и эритемы, провоцируемой высокой температурой. Часто эффективно лечение карбамазепином.
Полиневропатия различной тяжести с демиелинизацией и интерстициальным фиброзом была описана в сочетании с хронической кишечной псевдообструкцией и частой офтальмоплегией. Заболевание, вероятно, имеет семейный характер (Steiner et al., 1987). Лейкоэнцефалопатия была показана на МРТ в похожих случаях, для которых был предложен акроним «POLIP» (polyneuropathy, ophthalmoplegia, leukoencephalopathy и intestinal pseudo-obstruction — полиневропатия, офтальмоплегия, лейкоэнцефалопатия и кишечная псевдообструкция) (Simon et al., 1990). В некоторых из этих случаев была продемонстрирована связь с дефицитом цитохрома с оксидазы в биоптатах мышц (Haftel et al., 2000).
Синдром беспокойных ног, который является особым типом сенсорной невропатии, частой у взрослых, также существует у детей (Kotagal и Silber, 2004). Для родственного с ним синдрома периодических движений конечностей во сне в 20% случаев характерно начало до 10-летнего возраста.
— Вернуться в оглавление раздела «Неврология.»
Редактор: Искандер Милевски. Дата публикации: 11.1.2019
Наследственные нейропатии
, MDCM, New York Presbyterian Hospital-Cornell Medical Center
Наследственные невропатии классифицируются как
Двигательные и сенсорные
Сенсорные и вегетативные
Сенсорно-моторные нейропатии
Выделяют 3 типа (I, II и III) моторной и сенсорной нейропатий, каждый из которых начинается в детстве. Реже встречающиеся типы дебютируют с рождения и приводят к более тяжелой инвалидизации.
Обычно это аутосомно-доминантные, реже – X-сцепленные заболевания. Типы I и II (разновидности болезни Шарко–Мари–Тута, или перонеальной амиотрофии) являются наиболее частыми. Заболевание I типа связано с дупликацией гена периферического миелинового белка 22 типа ( PMP22), расположенного на коротком плече 17-й хромосомы.
Типы I и II характеризуются слабостью и атрофией, преимущественно малоберцовых и дистальных мышц ног. Часто в семейном анамнезе пациента имеются данные о нейропатии. Данные анамнеза заболевания могут варьировать: у некоторых пациентов заболевание протекает бессимптомно и у них отмечается только замедление скорости проведения по нервам (при исследовании скорости распространения возбуждения); у других пациентов заболевание проявляется более тяжело.
Болезнь I типа дебютирует в среднем детском возрасте со слабости в стопах и медленно прогрессирующей дистальной амиотрофии («ноги аиста»). Характерные амиотрофии кистей развиваются позднее. Вибрационная, температурная и болевая чувствительность нарушаются по типу «перчаток» и «носков». Выпадают глубокие сухожильные рефлексы. Иногда единственными признаками, которые выявляются у членов семьи – носителей заболевания, – это деформации стоп (высокий свод вплоть до «полой» стопы) и молоткообразная деформация пальцев на ногах. Скорость проведения нервных импульсов замедлена, а дистальные латентности удлинены. Имеет место сегментарная демиелинизация и ремиелинизация. Иногда удается пальпировать утолщенные периферические нервы. Заболевание прогрессирует медленно и не уменьшает продолжительность жизни. При одном из подтипов у мужчин симптомы более выражены, а у женщин проявляются слабо или вовсе отсутствуют.
Болезнь II типа прогрессирует медленнее, слабость развивается позднее. Скорость проведения возбуждения относительно нормальна, однако амплитуда потенциалов действия чувствительных нервов снижена, определяются полифазные потенциалы действия мышц. При биопсии выявляется аксональная (валлеровская) дегенерация.
Тип III(гипертрофическая нейропатия, болезнь Дежерина–Сотта) – редкое аутосомное доминантное или рецессивное заболевание, которое начинается в детстве с прогрессирующей слабости, потери чувствительности и отсутствия глубоких сухожильных рефлексов. Вначале напоминает болезнь Шарко–Мари–Тута, но мышечная слабость прогрессирует быстрее. Демиелинизация и ремиелинизация приводят к утолщению периферических нервов и формированию «луковиц», что определяется при биопсии.
Сенсорно-вегетативные нейропатии
Наследственные сенсорно-вегетативные нейропатии встречаются редко. Описано 5 типов заболевания.
Диагностика
Характерное распределение мышечной слабости, деформации стопы и наследственный характер заболевания позволяют заподозрить наследственную нейропатию, которая должна быть подтверждена при нейрофизиологическом исследовании.
Возможен генетический анализ.
Лечение
Фиксация помогает при коррекции отвислой стопы; ортопедическое хирургическое вмешательство может помочь стабилизировать стопу.
Могут помочь физиотерапия (увеличить мышечную силу) и эрготерапия; консультация по выбору профессии может помочь молодым людям подготовиться к профессиональной деятельности, несмотря на прогрессирование заболевания.
Ключевые моменты
Наследственные нейропатии могут поражать двигательные и сенсорные нервы, чувствительные нервы, чувствительные и вегетативные нервы или только двигательные нервы.
Выделяют 3 основных типа моторных и сенсорных нейропатий, которые различают по степени тяжести и скорости прогрессирования; все они начинаются в детстве.
Следует использовать фиксаторы для коррекции отвислой стопы, а также рекомендованы физическая и трудотерапия для того, чтобы помочь пациентам сохранить функцию; иногда требуется проведение ортопедического хирургического вмешательства.
Для наследственной сенсорно вегетативной полиневропатии 3 типа какие существуют критерии диагностики

Поиск
Сенсорные нейропатии: этиология, патогенез, классификация, клинические проявления, диагностика
Поражение периферической нервной системы, приводящее к развитию полинейропатии, обусловливает ограничение трудоспособности, инвалидизацию у этой категории больных. Для диагностики сенсорных полинейропатий необходимы: сбор анамнеза с тщательным выявлением сопутствующих соматических нозологий, особенностей питания, наследственного анамнеза, предшествующих нейропатическим проявлениям инфекционных заболеваний, работы больного с токсическими веществами, факта приёма лекарственных средств, тщательный неврологический и физикальный осмотр, проведение ЭНМГ, биопсия кожных нервов, исследование ликвора, крови, рентгенография органов грудной клетки, УЗИ внутренних органов.
Sensory neuropathy: the etiology, pathogenesis, clinical manifestations, diagnosis
The disturbance of the peripheral nervous system, leading to the development of polyneuropathy, causes disability, disability in these patients. For the diagnosis of sensory polyneuropathy requires: careful history taking to identify concomitant somatic nosology, dietary habits, family history, previous neuronopathic manifestations of infectious diseases of a patient with toxic substances, the fact of taking drugs, a thorough neurological and physical examination, conducting ENMG, a biopsy of cutaneous nerves, the study of the cerebrospinal fluid, blood, chest X-ray, ultrasound of internal organs.
Поражение периферической нервной системы, приводящее к развитию полинейропатии, обусловливает ограничение трудоспособности, инвалидизацию у этой категории больных. При учёте клинической симптоматики у больных с нейропатией оценивается симметричность, распределение нейропатических нарушений, наследственность, повреждение как тонких, так и толстых (А-α и А-β) нервных волокон, и наличие соответствующей клинической симптоматики [1].
Важную роль в развитии целого ряда нейропатий играют ганглиозиды. Ганглиозиды образуют семейство кислых сиалированных гликолипидов, состоящих из углеводных и липидных компонентов. Они в основном находятся во внешнем слое плазматической мембраны. Внешнее расположение углеводных остатков позволяет предположить, что такие углеводы действуют как антигенные мишени при аутоиммунных неврологических расстройствах. Молекулярная мимикрия между ганглиозидами и бактериальными углеводными антигенами (особенно с бактериальным липополисахаридом) может быть ключевым фактором развития целого ряда заболеваний (синдром Миллера-Фишера, энцефалит Биккерстаффа, нейропатия с анти-MAGантителами). Антиганглиозидные антитела могут перекрёстно реагировать с другими гликолипидами и гликопротеинами (HNK1эпитоп), включая гликопротеин миелина – P0, PMP-22, гликолипидами с сульфглюкуронил-параглобазидом и с сульфглюкурониллактозаминил параглобазидом. Недавно была описана ассоциация между цитомегаловирусной инфекцией и анти-GM2 антителами. Антитела, связывающиеся с углеводными антигенами наподобие анти-ганглиозид или анти-MAG (миелин ассоциированный гликопротеин), обнаружены при целом ряде периферических нейропатий. У больных с сенсорными нейропатиями могут наблюдаться признаки поражения вегетативных и моторных волокон [2].
Особенности сенсорных нарушений при нейропатиях.
С позиций патофизиологии в настоящее время выделяют ноцицептивную и нейропатическую боль. Ноцицептивной называют боль, обусловленную действием повреждающего фактора на болевые рецепторы, при интактности других отделов нервной системы. Под нейропатической подразумевается боль, возникающая при органическом поражении или дисфункции различных отделов нервной системы. При оценке и диагностике нейропатической боли у больных с полинейропатией учитывается распределение нейропатической боли (зона иннервации соответствующих нервов, сплетений и корешков), выявляется взаимосвязь между анамнезом заболевания, вызвавшего нейропатическую боль, и локализацией и нейроанатомическим распределением самой боли и сенсорных расстройств, оценка наличия позитивных и негативных сенсорных симптомов [3].
При сенсорных нейропатиях выявляются негативные симптомы нарушения чувствительности: гипестезия/гипалгезия в виде перчаток и носков, нижней части живота. Подобные симптомы чаще всего возникают при хронических воспалительных демиелинизирующих полинейропатиях, при дефиците витаминов В12 и Е, интоксикации витамином В6, при паранеопластических полинейропатиях. Нарушение периферической чувствительности связано с гибелью или прекращением функционирования по меньшей мере половины афферентных волокон. Эти изменения бывают выражены в различной степени в зависимости от того, как быстро наступает поражение чувствительных волокон. Если процесс хронический и происходит медленно, потерю поверхностной чувствительности при осмотре выявить затруднительно при функционировании даже небольшого количества сенсорных нейронов. В случае быстро развивающегося поражения нервных волокон с большей частотой регистрируются положительные симптомы, хорошо распознающиеся пациентами, в сравнении с клиническими нейропатическими проявлениями, которые развиваются в результате медленно прогрессирующей деафферентации. Расстройства чувствительности на доклинической стадии, не выявляемые при осмотре, могут быть обнаружены исследованием проведения по чувствительным нервам или соматосенсорных индуцированных потенциалов.
К позитивным сенсорным симптомам относятся:
а) болевой синдром при диабетической, алкогольной, амилоидной, паранеопластической, токсических полинейропатиях, при васкулитах, нейроборрелиозе, интоксикации метронидазолом;
б) парестезии (чувство онемения или ползания мурашек без нанесения раздражения);
Появление позитивных симптомов связано с регенерацией аксональных отростков. При поражении волокон, проводящих глубокую чувствительность, развивается сенситивная (чувствительная) атаксия, характеризующаяся шаткостью при ходьбе, которая усиливается в темноте и при закрытых глазах. Моторные нарушения характеризуются периферическими парезами, начинающимися с дистальных отделов нижних конечностей. Иногда в процесс вовлекаются мышцы туловища, шеи, краниобульбарная мускулатура (при порфирийной, свинцовой, амилоидной, ХВДП, паранеопластической полинейропатиях, синдроме Гийена-Барре). Максимальное развитие гипотрофии наблюдается к концу 3-4 месяца. При наличии спонтанной эктопической генерацией нервных импульсов вследствие регенерации возникают нейромиотония, миокимии, крампи, синдром беспокойных ног. Вегетативные симптомы, появляющиеся в результате поражения вегетативных волокон, можно разделить на висцеральные, вегетативно-возомоторные и вегетативно-трофические. Висцеральные симптомы появляются вследствие развития автономной полиневропатии (диабетической, порфирийной, амилоидной, алкогольной и других токсической полинейропатиях, а также синдроме Гийена-Барре).
Классификация нейропатий с учётом типов поражённых сенсорных нервных волокон (Левин С., 2005, Mendell J. R., Sahenk Z., 2003).
1. Сенсорные нейропатии с преимущественным поражением толстых нервных волокон:
— острая сенсорная атактическая нейропатия;
— хроническая воспалительная демиелинизирующая полирадикулонейропатия;
— нейропатия при билиарном циррозе печени;
— нейропатия при критических состояниях.
2. Сенсорные нейропатии с преимущественным поражением тонких нервных волокон:
— Идиопатическая нейропатия тонких волокон;
— Диабетическая периферическая нейропатия;
— Нейропатии при заболеваниях соединительной ткани;
— Нейропатии при васкулитах;
— Паранеопластические сенсорные нейропатии;
— Наследственная амилоидная нейропатия;
— Приобретённая амилоидная нейропатия;
— Нейропатия при почечной недостаточности;
— Врождённая сенсорная автономная полинейропатия;
— Полинейропатия при саркоидозе;
— Полинейропатия при отравлении мышьяком;
— Полинейропатия при заболевании Фабри;
— Полинейропатия при целиакии;
— Полинейропатия при ВИЧ-инфекции.
Патофизиология болевых проявлений при полинейропатиях.
Ввиду того, что диабетическая полинейропатия является наиболее частым и труднокурабельным осложнением сахарного диабета, то патогенез нейропатической боли наиболее хорошо изучен при указанной нозологии.
Для исследования патофизиологии нейропатической боли, как правило, используются экспериментальные модели [4]. Повреждение нерва обусловливает запуск патологических изменений поражённых нейронов, однако до сих пор не совсем ясно, какие из выявленных нарушений определяют инициацию и длительное существование нейропатической боли. У больных с полинейропатией в периферическом нерве не все нейроны повреждаются одновременно. Выявлено, что в поддерживании существования нейропатической боли важную роль играют патологические взаимодействия периферических сенсорных волокон: при дегенерации эфферентных волокон нерва в расположенных рядом интактных С-волокнах отмечается спонтанная эктопическая нейрональная активность, сенситизация нейронов на фоне экспрессии цитокинов и нейротрофических факторов. Всё это может указывать на значимость в патогенезе болевых расстройств повреждения толстых нервных волокон. Важную роль в сенситизации нервных волокон, возникновении термической гипералгезии при нейропатической боли играет серотонин, действие которого опосредованно 5-гидрокситриптаминовыми 3 рецепторами. Проведение боли при этом связывают с четырьмя основными разновидностями натриевых каналов: Nav1.3, Nav1.7, Nav1.8 и Nav1.9 [5]. Увеличение численности Na-каналов создаёт условия развития нейрогенного воспаления и вторичной центральной сенситизации. Показано, каналы Nav1.7, Nav1.8, Nav1.9 экспрессированы на тонких ноцицептивных волокнах и участвуют в проведении болевой афферентации. Повышенная экспрессия каналов как Nav1.3, которые в норме у взрослых лишь в небольшой степени представлены в периферической нервной системе, так и Nav 1.6 может играть важную роль в повышении возбудимости нейронов и развитии нейропатической боли при повреждении периферических нервов и спинного мозга. Указанные изменения наблюдаются на 1-8 нед. после начала механической аллодинии. Кроме того, ослабление проницаемости для калия в миелиновых волокнах может способствовать повышению возбудимости нейрона.
При нейропатической боли выявляется более низкий порог активации Аβ и Аδ-волокон на механическую стимуляцию. Увеличение спонтанной активности было найдено в С-волокнах. Гипералгезия при болевых стимулах у больных с полинейропатией может быть связана с повышением уровня циклооксигеназы-2, PG2 как в нейронах дорсального ганглия, так и задних рогах спинного мозга, активацией накопления сорбитола, фруктозы быть связана с стимулах, что указывает на важность в формировании и проведении нейропатической боли проводниковых трактов спинного мозга. В спиноталамическом тракте крыс регистрируется высокая спонтанная активность, увеличение рецепторных полей, также как и более низкий порог ответа нейронов в ответ на механическое раздражение. Нейрогенное воспаление при экспериментальной диабетической полинейропатии в случае болевых проявлений выражено в большей степени в сравнении с недиабетическими нейропатическими болевыми нарушениями. Было выявлено, что аллодиния, возникающая при диабетической полинейропатии, является следствием гибели С-волокон с дальнейшей центральной сенситизацией, повреждение Аδ-волокон, воспринимающих холодовые стимулы, ведёт к холодовой гипералгезии. Вольтажзависимые кальциевые N-каналы, расположенные в заднем роге спинного мозга, участвуют в формировании нейропатической боли.
Имеются данные об увеличении высвобождения нейротрансмиттеров при активации вольтажзависимых кальциевых каналов. Предполагается, что α2Δ-1субъединица, входящая в состав всех вольтажзависимых кальциевых каналов, является мишенью для антиаллодинического действия габапентина. Плотность кальциевых каналов с α2Δ-1субъединицей увеличена в случае индуцированного сахарного диабета, но не при винкристиновой полинейропатии, что указывает на различные механизмы аллодинии при различных типах полинейропатий.
ERK (extracellular signal-regulated protein kinase)-зависимая сигнализация выполняет важную роль в реакциях пролиферации, индуцированных факторами роста, клеточной дифференцировки и цитотрансформационных изменений. При сахарном диабете в экспериментальных моделях выявляется быстрая активация как MARK киназы (the mitogen-activated protein kinase), так и внеклеточной сигнал-зависимой киназы (ERK 1и 2) компонента ERK-каскада, коррелирующая с началом стерптозицин-индуцированной гипералгезии. Было выявлено в экспериментальных моделях, что применение фактора некроза опухоли TNF-α, связанного с активацией MAPK (p38 mitogen-activated protein kinase), при полинейропатии приводит к увеличению гипералгезии не только в пораженных волокнах, но и интактных нейронах, что может определять различные особенности болевых синдромов (табл. 1). При гипералгезии в патогенезе болевого синдрома важную роль играет активация киназы А. Также в патогенезе боли в экспериментальных моделях при диабетической полинейропатии выявлена значимость локальной гипергликемии в индуцировании механической гипералгезии.
Особенности болевого синдрома при различных механизмах поражения нейронов
2. Утрата сегментарного ингибирования толстых миелинизированных и тонких немиелинизированных болевых волокон
3. Эктопическая импульсация из демиелинизированных участков миелинизированных аксонов
4. Вызванное физиологической стимуляцией увеличение активности окончаний ноцицептивных афферентов оболочек нервных стволов
Наиболее часто встречаются следующие клинические варианты сенсорных полинейропатий (табл. 2): дистальная симметричная полинейропатия (ДСП), дистальная сенсорная полинейропатия тонких волокон (ДСПТВ), сенсорная нейронопатия (СН).
Дифференциальный диагноз сенсорных нейропатий
| Дистальная симметричная полинейропатия | Сенсорные нейронопатии | Полинейропатия тонких волокон |
| Клинические признаки полинейропатии | У больного с явными признаками сенсорной нейропатии диагноз сенсорной нейронопатии устанавливается по указанной ниже шкале (6,5 баллов и более) | Поражение периферических тонких нервных волокон при нормальном функционировании толстых сенсорных волокон, мотонейронов |
| Снижение или отсутствие ахилловых рефлексов | Атаксия верхних и нижних конечностей в дебюте заболевания или по мере прогрессирования клинических симптомов (3,1б.) | Снижение порога температурной чувствительности |
| Дистальное распределение сенсорных расстройств | Асимметричные сенсорные нарушения в дебюте заболевания или по мере прогрессирования клинических симптомов (1,7б.) | Снижение плотности эпидермальных нервных волокон |
| Мышечная слабость и/или атрофия мышц дистальных отделов конечностей | Локализация распространения сенсорных нарушений не ограничивается нижними конечностями по мере прогрессирования клинических симптомов (2б.) | |
| ЭМГ с патологическими нарушениями | Отсутствие вызванных потенциалов и/или снижение 3 вызванных потенциалов ниже 30% нормальной амплитуды потенциала в верхних конечностях (при исключении компрессионной нейропатии) – 2,8б. Может определяться снижение нервной проводимости в моторных волокон менее чем в 2 нервах нижних конечностей (3,1б.) Выявление у больного паранеопластических антител и/или наличие установленных злокачественных новообразований в течение последних 5 лет, синдрома Шегрена и/или повышение сигнала по МРТ данным от задних столбов спинного мозга при сумме баллов 6,5 и более свидетельствует о сенсорной нейронопатии | ЭМГ может быть без патологических нарушений |
Существуют различные методы инструментальной диагностики при сенсорных нейропатиях.
Методы клинической диагностики
Необходимо тестировать различные сенсорные волокна, так как возможно селективное вовлечение тонких и/или толстых нервных волокон. Необходимо учитывать, что чувствительность снижается с возрастом и зависит от индивидуальных особенностей пациента (способности к концентрации и понимания задачи). Относительно простым и быстрым способом является использование нейлоновых монофиламентов, обычных игл или булавок.
Исследование болевой чувствительности.
Исследования начинают с определения болевой чувствительности. Порог болевой чувствительности (немиелинизированные С-волокна) определяется прикладыванием предметов с высокой и низкой температурой или использованием обычных игл или взвешенных игл (уколомер). Исследование болевой чувствительности начинают с изучения жалоб. К числу самых частых жалоб относят жалобу на боль, при опросе больного выясняется характер боли (острая, тупая, стреляющая, ноющая, сжимающая, колющая, жгучая и т.д.), ее распространенность, является ли она постоянной или возникает периодически. Исследуются ощущения при нанесении определенных раздражений; выясняется, как больной их воспринимает. Уколы не должны быть слишком сильными и частыми. Сначала выясняют, различает ли больной на исследуемом участке укол или прикосновение. Для этого попеременно, но без правильной последовательности прикасаются к коже тупым или острым предметом, а больному предлагают определить «остро» или «тупо». Уколы должны быть короткими, не вызывающими резкой болезненности. Для уточнения границы зоны измененной чувствительности исследования проводят как от здорового участка, так и в обратном направлении.
Исследование температурной чувствительности.
Нарушение различения теплого и холодного — результат поражения тонких слабо- и немиелинизированных нервов, отвечающих за болевую чувствительность. Для исследования температурной чувствительности в качестве раздражителей используются пробирки с горячей (+40 °С … +50 °С) и холодной (не выше +25 °С) водой. Исследования проводятся раздельно для тепловой (реализуется Аδ-волокнами) и холодовой чувствительности (С-волокна), так как они могут нарушаться в разной степени). Тактильная чувствительность
Этот вид чувствительности обеспечивается большими миелинизи-рованными А-α и А-β волокнами. Может быть использован аппарат Фрея (конский волос разной толщины) и его современные модификации.
Исследование глубокой чувствительности.
Оцениваются функции только толстых миелинизированных волокон.
Вибрационная чувствительность: порог вибрационной чувствительности обычно оценивается на кончике большого пальца ноги и на латеральной лодыжке. Используют калиброванный камертон, ножка которого устанавливается на головку первой тарзальной кости. Больной должен сначала ощутить вибрацию, а затем сказать, когда она прекратится. Исследователь в этот момент считывает по одной из нанесённых на камертон шкал значения 1/8 октавы. Патологическими являются значения менее 1/4 октавы. Тест повторяется не менее трёх раз. Амплитуда вибрации увеличивается постепенно. Обычно используется камертон, рассчитанный на частоту 128 Гц (если камертон некалиброванный, в норме вибрация ощущается в течение 9-11 секунд). Нарушение вибрационной чувствительности свидетельствует о нарушении глубокой чувствительности.
Суставно-мышечное чувство, связанное с активацией в капсуле суставов и сухожильных окончаниях мышечных веретён при локомоции, оценивается при пассивном движении в суставах конечностей.
Инструментальные методы исследования сенсорных нейропатий. Электромиография как метод функциональной диагностики сенсорных нейропатий.
Ключевым в диагностике особенностей повреждения нервного волокна является электромиография (ЭМГ), которая изучает функциональное состояние нервов и мышц. Объектом изучения является двигательная единица (ДЕ) как функциональное ключевое звено нервно-мышечной системы. ДЕ – это комплекс, состоящий из двигательной клетки (мотонейрона переднего рога спинного мозга), её аксона и группы иннервируемых этим аксоном мышечных волокон. ДЕ обладает функциональной целостностью, и поражение одного отдела приводит к компенсаторным или патологическим изменениям в остальных отделах ДЕ. Основные задачи, решаемые при проведении ЭМГ: оценка состояния и фнкционирования мышцы, нервного аппарата, выявление изменений на уровне нервно-мышечной передачи.
Выделяют следующие методики обследования при проведении ЭМГ:
Диагностическая ценность методик различна и часто окончательная диагностика проводится на основе анализа многих показателей.
Игольчатая ЭМГ. Изучается спонтанная активность и при минимальном напряжении мышцы, когда генерируются и анализируются потенциалы отдельных ДЕ. В состоянии покоя выявляется несколько феноменов спонтанной активности при патологических изменениях в мышцах.
Положительные острые волны (ПОВ) наблюдаются при необратимой дегенерации мышечных волокон, являются индикатором необратимых изменений гибели мышечных волокон. Укрупнённые ПОВ, увеличенной амплитуды и длительности, говорят о гибели целых комплексов мышечных волокон.
Потенциалы фибрилляций (ПФ) — это потенциалы отдельного мышечного волокна, возникающие в результате денервации при травматическом или ином поражении любого отдела ДЕ. Возникают чаще на 11-18 день от момента денервации. Раннее возникновение ПФ (на 3-4 день) является неблагоприятным прогностическим признаком, свидетельствующим о значительном поражении нервных волокон.
Потенциалы фасцикуляций (ПФц) спонтанная активность всей двигательной единицы. Возникают при различных вариантах поражения ДЕ, ПФц характерны для нейронального процесса. Некоторые феномены спонтанной активности нозологически специфичны (миотонические разряды при миотониях).
При мышечном напряжении регистрируют потенциалы двигательных единиц (ПДЕ). Основными параметрами ПДЕ являются амплитуда, длительность, степень полифазии, которые изменяются при патологии ДЕ в виде функциональной и гистологической перестройки. Это находит своё отражение в ЭМГ стадиях денервационно-реиннервационного процесса (ДРП). Стадии различаются между собой по характеру распределения гистограмм длительности ПДЕ, изменению средней, минимальной и максимальной длительности ПДЕ относительно норм, указанных в таблицах. Комплексный анализ электрической активности мышцы позволяет выявить характер компенсаторных изменений в мышце в результате патологического процесса.
Перестройка структуры ДЕ точно отражает уровень поражения отделов ДЕ: мышечный, аксональный, нейрональный.
Исследование М-ответа и скорости распространения возбуждения по двигательным нервам.
Позволяет исследовать функционирование двигательных волокон периферического нерва и, косвенно, судить о состоянии мышцы. Метод позволяет определить уровень поражения нервного волокна, характер поражения (аксональный или демиелинизирующий), степень поражения, распространённость процесса. При непрямой стимуляции периферического нерва возникает электрический ответ (М-ответ) с мышцы, иннервируемой данным нервом. Для аксонального процесса характерно значительное уменьшение (ниже нормальных показателей) амплитуды М-ответа, полученного при дистальной стимуляции (дистального М-ответа), а также в других точках стимуляции, скоростные показатели страдают в меньшей степени.
Для демиелинизирующего поражения характерно снижение СРВм в 2-3 раза (иногда на порядок). Величина амплитуды дистального М-ответа при этом страдает в меньшей степени. Важным при исследовании М-ответа является определение отражающей проводимость по самым терминальным ветвлениям нерва резидуальной латентности (РЛ), увеличение которой указывает на патологию терминальных ветвлений аксонов.
Поздние нейрографические феномены F-волна и Н-рефлекс.
F-волна является ответом мышцы на импульс, посланный мотонейроном в результате возбуждения его антидромной волной, возникающей при дистальной непрямой стимуляции нерва током супрамаксимальной (по отношению к М-ответу) величины. По своей природе F-волна рефлексом не является, при этом импульс дважды проходит по самым проксимальным отрезкам нерва двигательным корешкам. Следовательно, анализируя параметры временной задержки (латентности) и скорости распространения F-волны, мы можем судить о проводимости по самым проксимальным отделам. Так как вторичный ответ обусловлен антидромным раздражением мотонейрона, то, анализируя степень вариабельности амплитуды и латентности F-волны, можно судить о возбудимости и функциональном состоянии мотонейронов.
H-рефлекс является моносинаптическим рефлексом. У взрослых в норме вызывается в мышцах голени при стимуляции большеберцового нерва током субмаксимальной (по отношению к М-ответу) величины. Импульс проходит путь по сенсорным волокнам, далее по задним корешкам, переключается на мотонейроны. Возбуждение мотонейронов приводит к сокращению мышцы. Так как импульс проходит вверх по чувствительным, а вниз по двигательным аксонам, можно провести оценку проводимости по проксимальным отделам сенсорных и двигательных путей. При анализе соотношения амплитуды Н-рефлекса и М-ответа при нарастании силы стимула, изучается степень возбудимости рефлекторной дуги, сохранность её элементов. Рассчитывая латентность Н-рефлекса и F-волны, при стимуляции из одной точки можно достаточно точно определить поражение сенсорного или двигательного отдела рефлекторной дуги.
Исследование потенциала действия нерва и сенсорной проводимости.
Метод позволяет выявить поражения сенсорных волокон, что особенно важно при диссоциированной полинейропатии.
Соматосенсорные вызванные потенциалы (ССВП).
Применяемые в диагностике дистальной нейропатии тонких волокон соматосенсорные вызванные потенциалы (ССВП) являются универсальным методом диагностики афферентных сенсорных систем. Однако поскольку регистрация ССВП осуществляется при неизбирательной стимуляции нервов, регистрируемый ответ отражает возбуждение толстых нервных волокон. Для оценки функции тонких А-δ и С-волокон, а также проводящих путей болевой и температурной чувствительности используются методики стимуляции немиелинизированных С-волокон болевым температурным воздействием, слабомиелинизированных А-δ волокон – тепловой стимуляцией. В зависимости от типа стимулятора эти методики подразделяются на лазерные и контактные тепловые вызванные потенциалы (Contact Heat-Evoked Potential- CHEP). У больных с нейропатической болью в начальной стадии полинейропатии, несмотря на нормальную плотность эпидермальных нервов, отмечается снижение амплитуды ответа CHEP, что позволяет использовать этот метод для ранней диагностики дистальной сенсорной полинейропатии тонких волокон.
Ограничивает применение этого метода исследования флюктуация результатов на фоне анальгетической терапии, недифференцированная стимуляция центральной или периферической сенсорных систем.
Биопсия нервов, мышц, кожных покровов.
Биопсия нервов и мышц необходима для дифференциальной диагностики аксональных и демиелинизирующих нейропатий (в первом случае определяются аксональная дегенерация нейронов, группировки мышечных волокон I и II типов, во втором – «луковичные головки» при биопсии нервов, при биопсии мышц – группировки мышечных волокон I и II типов. Биопсия кожи проводится при сенсорной нейропатии с преимущественным поражением тонких волокон (выявляется снижение плотности немиелинизированных и слабомиелинизированных нервных клеток в коже).
Конфокальная микроскопия является современным неинвазивным методом, позволяющим получать информацию о плотности, длине, морфологии немиелинизированных С-волокон в роговице [6]. Её применение целесообразно для мониторинга процесса повреждения тонких волокон при болезни Фабри, диабетической нейропатии, в последнем случае отмечается корреляция тяжести диабетической полинейропатии, снижения плотности эпидермальных волокон с денервационно-регенерационными процессами роговицы.
Для диагностики сенсорных полинейропатий необходимы [7]: сбор анамнеза с тщательным выявлением сопутствующих соматических нозологий, особенностей питания, наследственного анамнеза, предшествующих нейропатическим проявлениям инфекционных заболеваний, работы больного с токсическими веществами, факта приёма лекарственных средств, тщательный неврологический и физикальный осмотр с выявлением утолщений, характерных для амилоидоза, болезни Рефсума, демиелинизирующего варианта Шарко-Мари-Тута, проведение ЭНМГ, биопсия кожных нервов (для исключения амилоидоза, саркоидоза, ХВДП), исследование ликвора, крови (клинический и биохимические анализы крови), рентгенография органов грудной клетки, УЗИ внутренних органов.
Т.Г. Саковец, Э.И. Богданов
Республиканская клиническая больница МЗ РТ, г. Казань
Саковец Татьяна Геннадьевна — ассистент кафедры неврологии и реабилитации
1. Botez S.A., Herrmann D.N. Sensory neuropathies, from symptoms to treatment // Curr. Opin. Neuirol. — 2010. — № 23. — P. 502-508.
2. Overell J.R. Periferal neuropathy: pattern recognition for the pragmatist // Pract. Neurol. — 2011. — № 56. — P. 62-70.
3. Анисимова Е.И., Данилов А.Б. Нейропатический болевой синдром: клинико-нейрофизиологический анализ // Журн. Неврол. и психиат. — 2003. — Т. 103, № 10. — С. 15-20.
4. Zimmermann M. Pathobiology of neuropathic pain // Eur. J. Pharmacol. — 2001. — № 429. – Р. 23–37.
5. Craner M.J., Klein J.P., Renganathan M. et. al. Changes of sodium channel expression in experimental painful diabetic neuropathy // Ann. Neurol. — 2002. — № 52. — Р. 786-792.
6. Mehra S., Tavakoli M., Kallinikos P.A. et. al. Corneal confocal microscopy detects early nerve regeneration after pancreas transplantation in patients with type 1 diabetes // Diabetes Care. — 2007. — № 30. — Р. 2608-2612.
7. Bennett M. The LANSS Pain Scale: The Leeds assessment of neuropathic symptoms and signs // Pain. — 2011. — № 94. — Р. 147-157.



