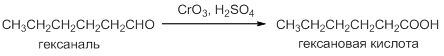до каких продуктов окисляются альдегиды
До каких продуктов окисляются альдегиды
Химия
3.6. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Альдегиды и кетоны. Реакции восстановления и окисления
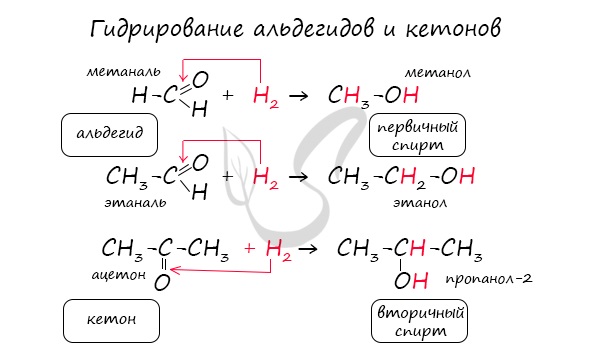
Восстановление
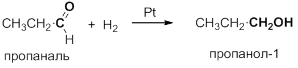
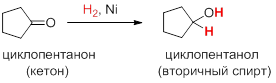
Восстановление (гидрирование) альдегидов и кетонов можно рассматривать как реакцию присоединения водорода по кратной связи C=O. Под действием катализаторов на основе Ni, Pt и Pd, альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных:
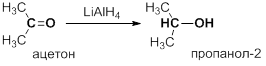
В лабораторных условиях используют в качестве восстановителей используют гидриды некоторых металлов и неметаллов, такие как алюмогидрид лития LiAlH4 или борогидрид натрия NaBH4:
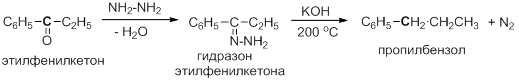
Карбонильные соединения можно восстановить до углеводородов, используя гидразин (NH2-NH2). Эта реакция была открыта русским ученым Николаем Матвеевичем Кижнером в 1911 году во время его работы на кафедре органической химии Томского технологического института (в настоящее время Томский политехнический университет). Из альдегида или кетона сначала получают гидразон, который затем разлагают при нагревании в высококипящем растворителе в присутствии оснований:
Окисление альдегидов и кетонов
Альдегиды окисляются легче, чем другие органические соединения, образуя карбоновые кислоты с тем же строением углеродного скелета. Альдегиды окисляются солями Mn(VII) и Cr(VI). Лучшие результаты получены при использовании реактива Джонса (CrO3 и разбавленная H2SO4). Реакция протекает при комнатной температуре с выходами около 80%:
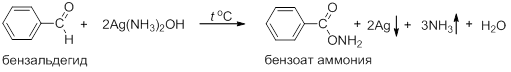
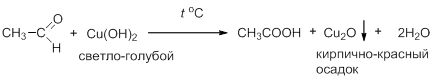
Альдегиды окисляются и более мягкими окислителями, такими как реактив Толленса Ag(NH3)2OH или Фелинга (комплексная соль гидроксида меди и солей винной кислоты):
В первом случае в осадок выпадает металлическое серебро в виде зеркала на стенках пробирки, во втором случае – оксид одновалентной меди. Эти две реакции используют как химические тесты для идентификации альдегидов.
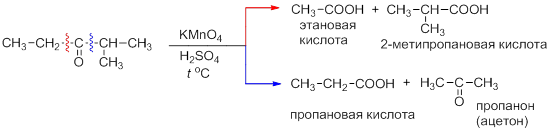
Кетоны окисляются труднее, чем альдегиды и только при действии сильных окислителей – азотной кислоты или солей Mn(VII) и Cr(VI) в кислой среде. При этом молекула кетона разрушается по обе стороны карбоксильной группы с образованием смеси из четырёх кислот или смесей кислот и кетонов:
Поэтому данная реакция не имеет практического значения для алифатических кетонов. Однако она может использоваться для окисления циклических с целью получения двухосновных кислот:
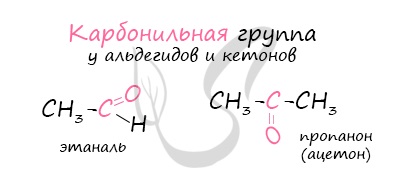
Альдегиды
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
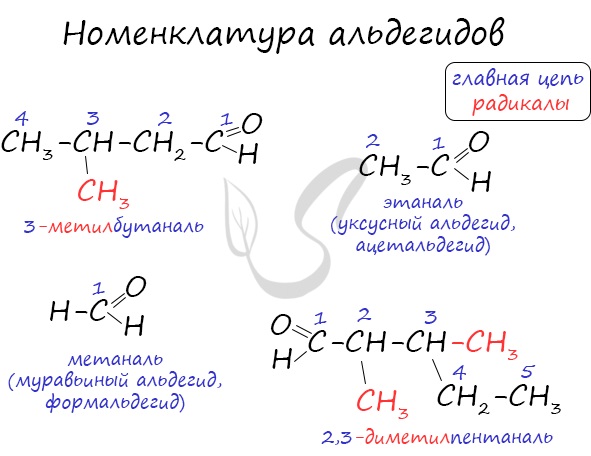
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
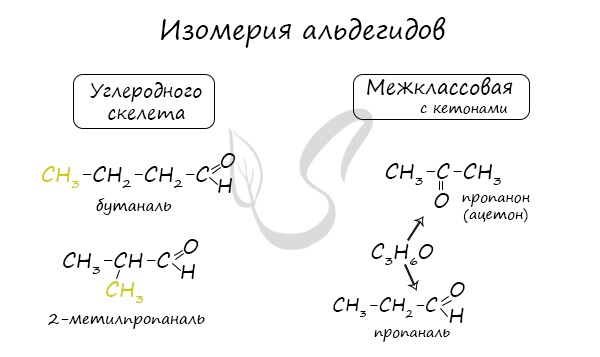
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
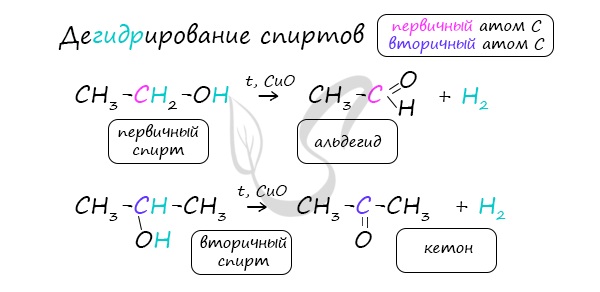
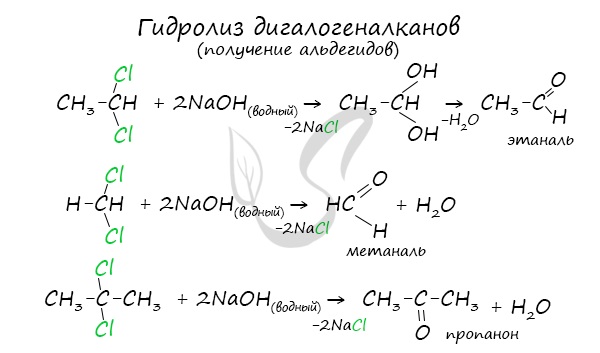
Получение альдегидов и кетонов
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
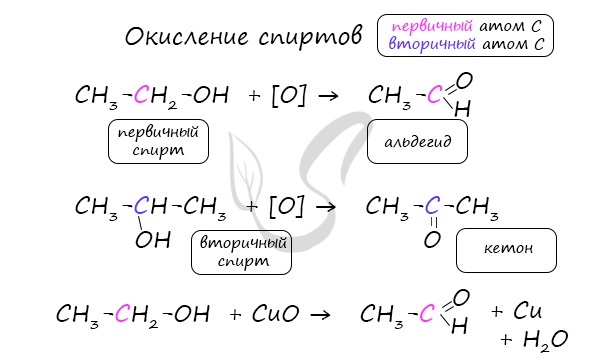
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
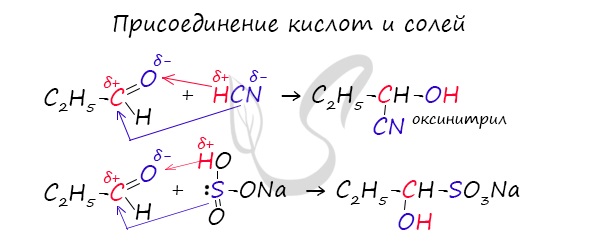
Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.