дюфастон при гиперплазии эндометрия как принимать на какой день цикла
Новая технология противорецидивной гормональной терапии гиперпластических процессов эндометрия у женщин позднего репродуктивного возраста
Проведено исследование специфического связывания рецепторов прогестерона с синтетическими гестагенами у женщин позднего репродуктивного возраста. Разработана новая медицинская технология гесагенотерапии гиперпластических процессов эндометрия, позволяющая
The study on specific binding of progesterone receptors and synthetic gestogens in women of late childbearing age, was done. The new medical technology of gestogen therapy of hyperplastic processes of endometrium, which allows to reduce recurrence frequency, was developed.
.jpg)
Патогенез ГПЭ характеризуется сложным взаимодействием общих системных процессов и локальных изменений в эндометрии. В свете современных концепций в основе развития ГПЭ лежит гормональный дисбаланс, который выражается абсолютной или относительной гиперэстрогенемией [4–6]. Эндометрий является самой чувствительной тканью-мишенью половых гормонов. Исследования последних лет показали, что ведущую роль в развитии ГПЭ играет чувствительность слизистой оболочки матки к стероидным гормонам [2, 7–9]. Для противорецидивной терапии ГПЭ применяют гормональные препараты, состав и дозу которых выбирают в зависимости от результатов гистологического исследования соскоба эндометрия, сочетанных гинекологических и соматических заболеваний, возраста женщины и индивидуальной переносимости препарата. В практическом здравоохранении у пациенток позднего репродуктивного возраста наиболее часто используются синтетические гестагены. Однако, по литературным данным, отсутствие эффекта от гестагенотерапии при ГПЭ варьирует от 25,9% до 78,0% [6, 10].
Резервом повышения эффективности терапии ГПЭ является индивидуальный выбор препаратов. Для осуществления персонализованного подбора гормональной терапии мы предложили использовать силу связывания препарата с рецепторами прогестерона из ткани эндометрия конкретной пациентки. Данное предположение основано на тезисе, что сила связывания лиганда с рецептором определяет эффект от лечения, то есть чем выше связывание гестагенов с прогестерон-связывающими участками, тем лучший эффект ожидается от лечения.
С целью проверки данной гипотезы на кафедре молекулярной фармакологии и радиобиологии им. академика П. В. Сергеева ГБОУ ВПО РНИМУ им. Н. И. Пирогова совместно с МОНИИАГ было проведено исследование специфического связывания рецепторов прогестерона с синтетическими гестагенами у женщин позднего репродуктивного возраста с гиперпластическими процессами эндометрия. Проведенные в отделении гинекологической эндокринологии исследования показали, что выбор гестагена с учетом индивидуальной чувствительности эндометрия к препарату позволил значительно снизить частоту рецидивов железистой гиперплазии эндометрия [4, 5, 7]. По результатам исследования была разработана новая медицинская технология и получен патент на изобретение «Способ гестагенотерапии гиперпластических процессов эндометрия» [11].
Материал и методы исследования
В исследование вошли 164 женщины позднего репродуктивного возраста. Критериями включения в исследование явились: наличие ГПЭ (простой железистой гиперплазии и/или железистых полипов эндометрия), отсутствие тяжелой соматической патологии и выраженных метаболических нарушений, препятствующих проведению противорецидивной гормональной терапии.
Клинические методы исследования включали общее стандартное гинекологическое обследование женщин: осмотр шейки матки в зеркалах, влагалищное бимануальное исследование, трансвагинальное ультразвуковое сканирование органов малого таза (на 5–8 день менструального цикла), мазок на флору и ЗППП. Ультразвуковое сканирование органов малого таза у пациенток позднего репродуктивного возраста проводилось на базе НКО МОНИИАГ, аппаратом Siemens Sequoia 512 с использованием вагинального датчика от 6 до 8 мГц, в режиме двухмерной визуализации.
Ткань эндометрия для определения цитозольных рецепторов половых стероидов получали во время выскабливания стенок полости матки при использовании серийного аппарата Circon Acmi на базе эндоскопического отделения МОНИИАГ или путем эндорам-биопсии.
Уровень рецепторов прогестерона и специфическое связывание стандартных гестагенов с прогестерон-связывающими участками определяли в цитозоле биоптатов эндометрия по методу [12].
Цитозольную фракцию получали стандартным методом с помощью ультрацентрифугирования (105 000 g, ультрацентрифуга UP-65 M, 60’). Уровень рецепторов прогестерона (РП) и специфическое связывание гестагенов с прогестерон-связывающими участками определяли в цитозоле биоптатов эндометрия радиолигандным методом [13].
Белок определяли методом Лоури.
Статистическую обработку материала проводили на персональном компьютере, в работе использовалась программа GraphPad Prism 5.0 и стандартные методы статистического анализа.
Результаты и обсуждение
Из 136 обследованных пациенток с ГПЭ 73 (54%) были с рецидивирующим течением (в анамнезе от 1 до 6 раздельных диагностических выскабливаний (РДВ) слизистой стенок матки и цервикального канала), у остальных 63 женщин (46%) гиперплазия эндометрия была выявлена впервые.
В контрольную группу вошли 28 женщин (без измененного эндометрия), в группу с ГПЭ вошли 73 пациентки, при гистологическом исследовании у 51 (37,5%) пациентки были диагностированы железистые полипы эндометрия, а у 85 — простая железистая гиперплазия эндометрия.
У пациенток с ГПЭ в 112 случаях (82%) были гормонзависимые заболевания гениталий (миома матки и/или эндометриоз различной локализации), 58% обследуемых женщин имели избыточную массу тела (ИМТ ≥ 25).
37 (27,2%) пациенткам с ГЭ проводили гистероскопию с РДВ во II фазу менструального цикла в условиях МОНИИАГ. 99 (73%) женщинам РДВ с или без гистероскопии было проведено по месту жительства.
Уровень РП в эндометрии изменялся в зависимости от нозологической формы гиперплазии. Так, при полипах эндометрия средняя величина этого параметра снизилась в 1,4 раза по сравнению с нормой и составила в среднем 16,9 ± 3,7 фмоль/мг белка, а при железистой гиперплазии эндометрия — в 1,2 раза и равнялась 19,2 ± 5,6 фмоль/мг белка (р ≤ 0,05).
В качестве тестируемых гестагенов использовались: медроксипрогестерона ацетат, норэтистерон, дидрогестерон. Приведенные гестагены выбраны по принципу различий структуры и наличия доступных лекарственных форм. Уровень рецепторов прогестерона в цитозоле эндометрия, как и сила специфического связывания с гестагенами, варьировали в широких пределах. При этом усредненные данные показали, что наибольшую силу связывания продемонстрировал медроксипрогестерона ацетат (64,6 ± 7,2 при полипах эндометрия и 73,8 ± 5,2 при гиперплазии (р ≤ 0,001)), наименьшую — норэтистерон (52,7 ± 4,1 при полипах эндометрия и 60,3 ± 2,6 при гиперплазии (р ≤ 0,001)).
При исследовании были выделены следующие группы: контрольная группа (I группа) — 28 пациенток; женщины с рецидивирующим течением ГПЭ, которым была назначена гормональная противорецидивная терапия по методу слепой выборки (II группа) — 41 пациентка; женщины с рецидивирующим течением ГПЭ, которым назначалась гормональная противорецидивная терапия с учетом результатов связывающей активности гестагенов с прогестерон-связывающими участками (III группа) — 32 пациентки.
II группе была назначена гормональная противорецидивная терапия с использованием препаратов, в состав которых входят тестируемые гестагены. Эффективность терапии пациенток данной группы (отсутствие рецидивов в течение 6 месяцев по окончании лечения) сравнивали с результатами индивидуального тестирования аффинитета рецепторов прогестерона, полученных из эндометрия пациенток до начала лечения.
III группе была назначена гормональная терапия с учетом результатов связывающей активности гестагенов с прогестерон-связывающими участками цитозоля эндометрия конкретной пациентки.
Все пациентки, имеющие рецидивирующее течение заболевания, получали:
Оценка эффективности гормональной терапии проводилась по клиническим симптомам, а также по результатам трансвагинального ультразвукового сканирования органов малого таза на 3-м и 6-м месяцах гормональной терапии. Ультразвуковое исследование проводили на 4–8 день менструального цикла, толщина эндометрия считалась нормальной при значениях 0,3–0,6 см, если же она превышала данные значения, то проводилась гистероскопия для уточнения диагноза.
В результате клинико-лабораторного исследования показано, что во II группе частота рецидивов составила 17,1%, в то время как в III группе частота рецидивов составила 6,3%.
Сравнительный анализ противорецидивной эффективности синтетических гестагенов в проведенном исследовании показал, что количество рецидивов при использовании норэтистерона было максимально и составило 18 через 3 месяца во II группе, тогда как при терапии медроксипрогестерона ацетатом рецидивов обнаружено не было через 3 и 6 месяцев.
Выводы
Таким образом, нами рекомендуется алгоритм проведения персонализированной противорецидивной гормональной терапии по схеме, представленной на рис. 2.
Медико-социальная эффективность
Снижение частоты рецидивов гиперпластических процессов эндометрия у женщин позднего репродуктивного возраста ведет к:
Таким образом, предложенная медицинская технология представляет собой подбор индивидуальной гормональной терапии гиперпластических процессов эндометрия на основании индивидуальной оценки связывающих свойств рецепторов прогестерона эндометрия.
Работа выполнена в рамках программы развития НИУ ГБОУ ВПО РНИМУ им Н. И. Пирогова, 2010–2019, приоритетное направление развития ПНР-2, персонализированная медицина.
Литература
В. И. Краснопольский*, доктор медицинских наук, профессор, член-корреспондент РАМН
Н. Д. Гаспарян*, доктор медицинских наук, профессор
Л. С. Логутова*, доктор медициинских наук, профессор
Е. Н. Карева**, доктор медицинских наук, профессор
О. С. Горенкова*, кандидат медицинских наук
Д. А. Тихонов**
*ГБУЗ Московской области МОНИИАГ,
**ГБОУ ВПО РНИМУ им. Н. И. Пирогова, Москва
Дюфастон и лечение эндометриоза
Эндометриоз – патология, которая характеризуется разрастанием ткани, имеющей сходство с эндометрием и подвергающейся циклическим изменениям. Эндометриоидные очаги могут располагаться на любых органах, чаще всего поражая тело матки, придатки, кишечник, брюшину, мочевой пузырь и почки. С терапевтической целью специалисты назначают различные лекарственные препараты. На раннем этапе очень часто используют для лечения эндометриоза Дюфастон. Ведь он обладает выраженным эффектом, вызывая минимум побочных реакций.
Лечение эндометриоза и дюфастон
Нарушения работы эндокринной системы отражаются на состоянии всего организма, в частности функциональности половой системы. При недостаточном количестве прогестерона и избытке эстрогенов эндометрий (внутренняя оболочка полости матки) начинает активно разрастаться. Так как эндометриоидные очаги также подвержены циклическим изменениям, то на них также отражается гормональный дисбаланс, что приводит к чрезмерному разрастанию патологических очагов и распространению заболевания.
Сегодня наиболее эффективным способом лечения эндометриоза является сочетание хирургических и консервативных методик. Максимальный результат в запущенных случаях дают медикаменты, вводящие женщин в искусственную менопаузу и подавляющие активность яичников. После терапии все функции полностью восстанавливаются, но существуют определенные риски и последствия. На ранних этапах возможно лечение эндометриоза Дюфастоном, этот препарат оказывает мягкое действие и способствует восстановлению баланса гормонов. К тому же он полностью сохраняет репродуктивную функцию у женщин и не препятствует беременности. Стоит отметить, что прием препарата сохраняют даже после успешного зачатия, чтобы снизить риски выкидыша.
Показания и противопоказания Дюфастона
Препарат активно используют в гинекологической практике при недостатке прогестерона, в том числе используют Дюфастон для лечения эндометриоза. Помимо этого, он показан при бесплодии, нарушениях менструальной функции, аменорее, дисфункциональных маточных кровотечениях, заместительной гормонотерапии во время климакса.
Противопоказанием для применения препарата служит непереносимость его компонентов и аллергические реакции. Также Дюфастон следует использовать с осторожностью в лактационный период, так как он проникает в грудное молоко.
В любом случае медикаментозные препараты должны назначаться врачом после тщательного обследования. Самостоятельный прием лекарственных средств может навредить организму и вызвать неблагоприятные реакции. Получить подробную информацию о препарате и пройти полноценное обследование можно в клинике «Центр ЭКО» Курск.
Дюфастон и его эффекты при лечении эндометриоза
Основное действующее вещество препарата – дидрогестерон – аналог природного прогестерона. В 1 таблетке Дюфастона содержится 10 мг активного компонента. Попадая в организм, он быстро всасывается в кровь, его максимальная концентрация наблюдается через 2 часа. Дидрогестерон, избирательно связываясь с прогестероновыми рецепторами в матке, способствует переходу эндометрия из фазы пролиферации в период секреции, предотвращая его избыточное разрастание. К тому же Дюфастон, как и прогестерон, готовит слизистую оболочку к возможной беременности и имплантации зародыша, снижает возбудимость мышечного слоя матки и уменьшает его сократительную деятельность.
Стоит отметить, что дидрогестерон не является производным тестостерона, поэтому при лечении эндометриоза Дюфастоном исключается андрогенная и анаболическая активность, маскулинизирующий эффект, нарушения дифференцировки и развития плода, изменения температуры тела. Препарат не меняет обмен веществ, поэтому пациентки могут не опасаться набора веса.
К тому же Дюфастон снижает воздействие эстрогенов на женский организм, следовательно, может активно применятся при бесплодии и частых выкидышах, маточных кровотечениях и других патологических состояниях, вызванных избытком эстрогенов. В то же время он не подавляет положительных эффектов этих гормонов, которые предотвращают формирование сердечно-сосудистых и нервных заболеваний.
В целом можно выделить следующие положительные эффекты Дюфастона при лечении эндометриоза:
Способы применения препарата Дюфастон
Существуют определенные схемы лечения препаратом в зависимости от диагноза и прогнозируемого эффекта, но в любом случае дозировка и курс терапии подбирается в индивидуальном порядке. При лечении Дюфастоном эндометриоза врач учитывает степень распространения процесса, запущенность патологии, состояние здоровья пациентки.
Как правило, Дюфастон во время лечения эндометриоза принимают по 1 таблетке 2-3 раза в сутки независимо от приема пищи. Начинать терапию рекомендуется на 5 день менструального цикла до 25, но иногда врачи рекомендуют приступить к лечению на следующий день после овуляции, чтобы не препятствовать успешному зачатию. При регулярном 28 дневном цикле овуляция наступает примерно на 12-14 день, овуляторный период можно вычислить по уровню базальной температуры, концентрации гормонов, УЗИ или при помощи специальных тестов. Курс лечения длительный, в большинстве случаев продолжается 9 месяцев и более. После наступления беременности не стоит сразу отменять препарат, срок его применения корректируется врачом.
Побочные реакции при лечении эндометриоза Дюфастоном
Все лекарственные средства могут вызвать побочные проявления, поэтому не исключаются негативные реакции Дюфастона при лечении эндометриоза. Чаще всего пациенты жалуются на головные боли, маточные кровотечения, увеличение чувствительности молочных желез, слабость, общее недомогание, изменение функциональности печени, желтушность кожных покровов, сыпь, периферические отеки, анемию.
При лечении эндометриоза Дюфастоном следует учитывать его взаимодействие с другими лекарственными препаратами. В целом он совместим с медикаментами, но некоторые средства, в частности индукторы ферментов печени, могут усиливать метаболизм Дюфастона и снижать его эффективность.
Менопаузальная гормонотерапия (МГТ)

Почему же процент женщин, принимающих МГТ, остается невысоким?
Крупное американское исследование WHI (Women’s Health Initiative, 2002 г.) вызвало драматический период в судьбе менопаузальной гормонзаместительной терапии, что способствовало резкому сокращению МГТ в большинстве стран мира, появлению страхов и сомнений в отношении пользы и рисков.
Преждевременное завершение части исследования по менопаузальной гормонзаместительной терапии (МГТ) привлекло к себе всеобщее внимание. Как женщины, так и врачи чувствовали себя обманутыми, так как терапия, которая до этого считалась полезной для здоровья в долгосрочной перспективе, теперь оказалась опасной. Отличающийся от фактического изложения пресс-релиз предварительной работы прогремел в СМИ за неделю до того, как сама статья стала доступна для большинства читателей. Сообщалось, что исследование было остановлено в связи с повышенным риском развития рака молочной железы, связанным с заместительной гормональной терапией. На самом деле, в скорректированном анализе связь МГТ и рака молочной железы не была статистически значима!
Последующий углубленный анализ результатов WHI показал, что МГТ характеризуется благоприятным профилем пользы/риска у более молодых женщин, которые начинают терапию в близкие к менопаузе сроки. Эти результаты характеризовались сходным защитным воздействием терапии в отношении ИБС и снижения общей смертности, которые были продемонстрированы ранее в крупномасштабных наблюдательных исследованиях с участием относительно молодых женщин. После WHI широкое распространение получила так называемая временная гипотеза или гипотеза «окна терапевтических возможностей», согласно которой существует различное влияние МГТ на атеросклероз и связанные с ним клинические события в зависимости от возраста женщины и времени начала использования МГТ по отношению к моменту наступления менопаузы.
Основными недостатки данного исследования являлись:
Что же происходит с женским организмом в 45-55 лет?
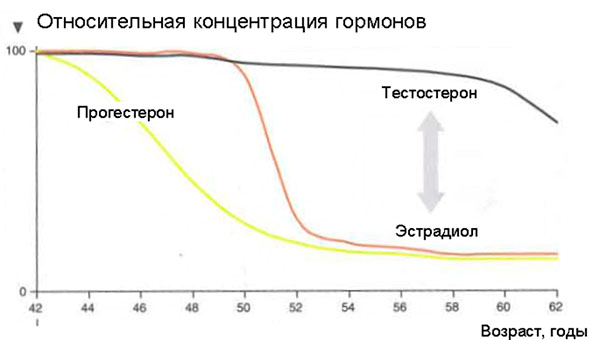
Что будет если МГТ не проводить?
А зачем нужно так «рисковать» и принимать «страшные» гормональные препараты при наступлении менопаузы? Ведь это естественный процесс, может, пусть все идет, как заведено природой? — Но тогда мы неизбежно столкнемся с заболеваниями, которые также предопределены природой.
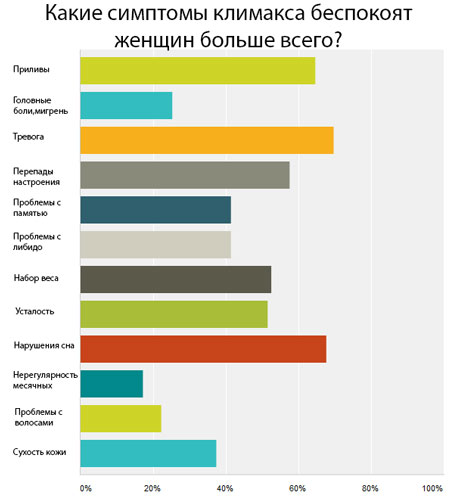
Сначала появляются ранние симптомы:
Через некоторое время появятся и поздние нарушения, связанные с длительным дефицитом половых гормонов:
Какое обследование проводится перед МГТ
Перед назначением менопаузальной гормональной терапии необходимо обследование (впрочем, которое необходимо проводить хотя бы раз в год и без терапии всем сознательным женщинам старше 45 лет).
Дополнительные обследования (при соответствующих данных анамнеза):
Когда пора начинать менопаузальную гормональную терапию?
Но проблема в том, что диапазон нормы ФСГ огромен, и для каждой женщины уровень свой. В идеале нужно сдать анализы крови на гормоны в период максимального расцвета – с 19 до 23 лет. Это и будет вашей индивидуальной идеальной нормой. А начиная с 45 лет ежегодно сверять с ней результаты. Но даже если вы впервые слышите о ФСГ – лучше поздно, чем никогда: в 30, 35, 40 лет имеет смысл выяснить свой гормональный статус, чтобы ближе к критическому возрасту было, на что ориентироваться.
Как самостоятельно понять, что пришло время МГТ?
Уровень эстрогенов снизился, если:
Препаратов огромное количество, какие из них наиболее безопасны?
Действует принцип «минимальности» и «натуральности»!
Для менопаузальной гормональной терапии применяются различные препараты, которые могут быть разделены на несколько групп:
«Натуральные» эстрогены – это препараты эстрогенов, которые по химической структуре идентичны эстрадиолу, синтезируемому в организме женщин. Благодаря современным технологиям создан синтетический эстрадиол, но по своей химической структуре он идентичен натуральному Эстрадиол–17b.
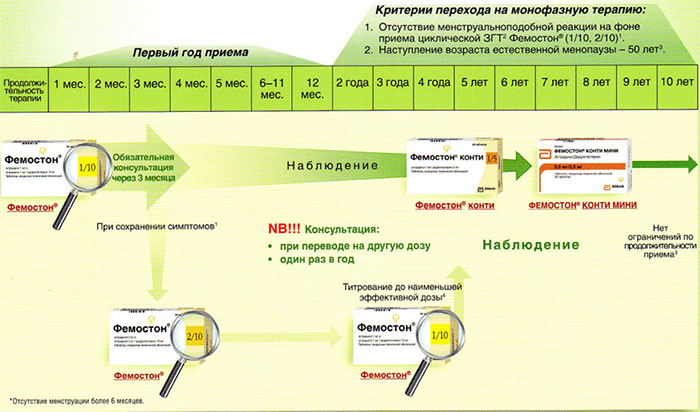
На сегодняшний день таким критериям более всего соответствует препарат Фемостон. Препараты линейки фемостона имеют различные дозировки, что укладывается в один из основных постулатов современной концепции МГТ – использование наименьшей возможной дозировки, которая сохраняет эффективность.
Препараты для двухфазной терапии – когда еще есть месячные
Фемостон 1/10 и Фемостон 2/10
В состав Фемостона 1/10 входят 28 таблеток. 14 белых, содержащих 1 мг Эстрадиола, и 14 серых, содержащих 1 мг Эстрадиола и 10 мг Дидрогестерона.
Состав Фемостона 2/10 отличается только количеством Эстрадиола
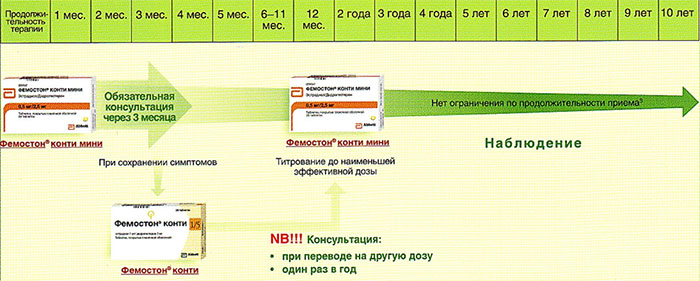
Препараты для монофазной терапии – когда месячные отсутствуют
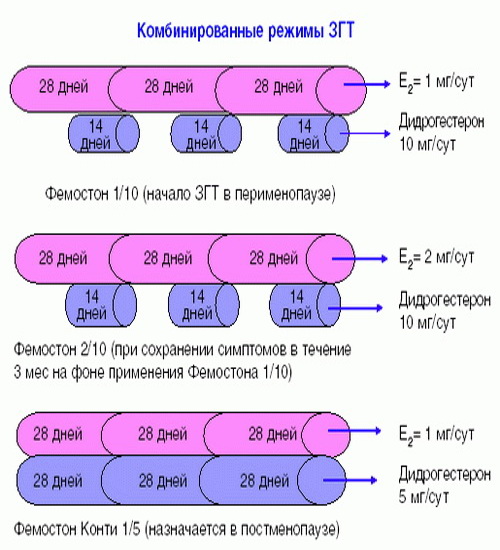
В состав Фемостона конти 1/5 входят 28 таблеток, содержащих 1 мг Эстрадиола и 5 мг Дидрогестерона.
В состав Фемостона мини 0,5/2,5 входят 28 таблеток, содержащих 0,5 мг Эстрадиола и 2,5 мг Дидрогестерона.
Ниже представлена более подробная схема первоначального назначения препаратов фемостон в пременопаузе (то есть до прекращения менструаций, но при наличии характерных климактерических симптомов). Пациенткам, у которых менструации не прекратились, рекомендуют начинать лечение в первый день менструального цикла. Пациенткам с нерегулярным менструальным циклом целесообразно начинать лечение после 10-14 дней монотерапии прогестагеном («химический кюретаж»).
Далее Вашему вниманию представлен алгоритм первоначального назначения препарата фемостон в постменопаузе (то есть когда уже прошел год и более после последней менструации).
Какой способ применения препаратов лучше?
Трансдермальное (накожное) нанесение позволяет избежать первой стадии печеночного метаболизма, благодаря чему колебания концентрации эстрадиола в плазме крови при применении накожных препаратов незначительны. Метаболизм и выведение эстрадиола при трансдермальном введении подобен метаболизму натуральных эстрогенов.
Большинству пациентов желательно использовать оптимальную и наиболее безопасную на сегодняшний день схему: Дивигель накожно + Утрожестан интравагинально.

Схема приема для женщин, у которых сохранена менструальная функция, назначается врачом. Обычно средство прописывают циклом с первого дня после окончания менструации (5 день цикла) в течение 25 дней, после овуляции (c 16 по 25 день цикла) нужно добавлять препараты гестагенов.
Утрожестан – содержит прогестерон микронизированный, существует в двух формах — 100 и 200 мг.
При МГТ в постменопаузе в непрерывном режиме препарат Утрожестан применяется в дозе 100 мг с первого дня приема эстрогенов.
При болях в молочной железе можно добавить прожестожель ежедневно по 1 дозе на каждую молочную железу 2-4 недели.
Противопоказаниями для заместительной гормонотерапии являются:
Нужен ли женщинам тестостерон?
Согласно рекомендациям Международного общества по менопаузе (International Menopause Society (IMS)) основное показание для применения тестостерона – лечение уменьшенного сексуального влечения, которое заставляет данную женщину испытывать значительные страдания. До рассмотрения вопроса о проведении терапии тестостероном необходимо решить вопросы, связанные с другими причинами нарушенного сексуального желания и/или возбуждения. К ним относятся диспареуния, депрессия, побочные эффекты лекарственных препаратов, проблемы взаимоотношений и другие проблемы со здоровьем, влияющие на женщину или ее партнера.
В настоящее время возможно применение трансдермальных препартов. На отечественном фармацевтическом рынке существует только один вариант – Андрогель, но его применение у женщин является «off-label», то есть не разрешено инструкцией. Обычно назначается 1/5 пакета в день (то есть 1 г геля/10 мг тестостерона).
Еще более перспективным может стать интравагинальная форма тестостерона, которая также может оказывать благоприятное действие при лечении вульвовагинальной атрофии.
Ключевые положения по применению препаратов тестостерона
Самые частые заблуждения:
А как же рак молочной железы, ведь это самая главная причина смерти у женщин?
В этом утверждении много заблуждений. На самом деле рак молочной железы – причина смертности в 4% случаев. Ведущая причина преждевременной смерти – сердечно-сосудистые заболевания (50%), которые запускает инсулинорезистентность. А она возникает на фоне гормональных нарушений.
Гормоны вызывают побочные эффекты и от них толстеют?
Новые низкодозированные и высокоселективные препараты направлены четко на мишень. Врачи на протяжении многих лет наблюдали за тысячами женщин, которые получали МГТ? Сегодня уже есть уникальные гестагены, метаболически нейтральные, они не приводят к ожирению и вместе с тем не понижают тестостерон, если у женщины нет его избытка. Выработаны и новые схемы лечения. Иногда при применении таблеток с эстрогенами, где-то в 10% случаев, бывают головные боли и боль в венах. В этом случае они заменяются на трансдермальные формы в виде геля.
Зачем мне принимать гормоны, если у меня нет приливов и отличное самочувствие?
Вместе с падением уровня гормонов возникает риск развития возрастных болезней: повышается артериальное давление, возникает ожирение, увеличивается риск развития сахарного диабета второго типа, подагры, остеопороза и онкологических заболеваний.
Вместо таблеток лучше принимать травы и различные фитоэстрогены?
Эффективность данных препаратов по устранению вазомоторных симптомов составляет 30%, что равно эффективности плацебо. При этом данная группа препаратов никаким образом не оказывает профилактического действия на возрастные заболевания (сердечно-сосудистые, онкологические заболевания, остеопороз, ожирение и сахарный диабет).
_575.gif)
.gif)