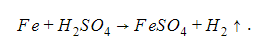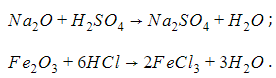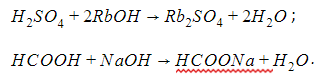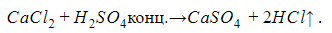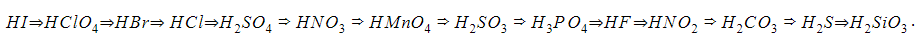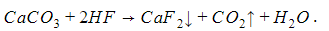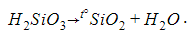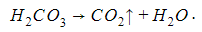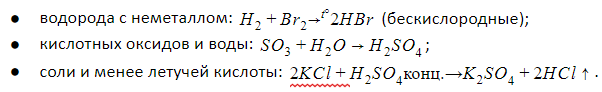На что делятся кислоты в химии
Урок №47. Кислоты. Состав. Классификация. Номенклатура. Получение кислот
Классификация кислот
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
2. По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
Кислотный остаток (А)
Соответствующий кислотный оксид
SO 3 оксид серы ( VI )
HMnO 4 марганцевая
MnO 4 (I) перманганат
Mn 2 O 7 оксид марганца ( VII )
SO 2 оксид серы ( IV )
PO 4 (III) ортофосфат
P 2 O 5 оксид фосфора ( V )
N 2 O 3 оксид азота ( III )
CO 2 оксид углерода ( IV )
SiO 2 оксид кремния (IV)
С l 2 O оксид хлора ( I)
С l 2 O 3 оксид хлора ( III)
НСlO 3 хлорноватая
С l 2 O 5 оксид хлора ( V)
С l 2 O 7 оксид хлора ( VII)
б) Таблица бескислородных кислот
Кислотный остаток (А)
HCl соляная, хлороводородная
H 2 S сероводородная
Физические свойства кислот
Способы получения кислот
HCl, HBr, HI, HF, H 2 S
1. Прямое взаимодействие неметаллов
1. Кислотный оксид + вода = кислота
2. Реакция обмена между солью и менее летучей кислотой
Кислоты в химии
Кислоты в химии – это группа соединений, обладающих общими чертами в строении молекул, в состав которых всегда входит водород и кислотный остаток. В химических процессах кислоты проявляют специфические свойства, главное из которых – способность образовывать соли.
Определение и формулы
Кислота – соединение, молекулы которого способны к обмену или замещению водородного катиона 

Химические формулы
В неорганической химии общая формула кислот имеет вид 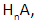
Значение n соответствует валентности кислотного остатка. Формула кислоты позволяет установить состав соединений, образуемых с ее участием, и составить уравнение реакции.
Органические карбоновые кислоты имеют общую формулу RCOOH, где R – углеводородный радикал, COOH – карбоксильная группа, атом водорода в составе которой может замещаться.
Ионные формулы
При растворении в воде происходит диссоциация – разложение – молекул кислоты на катионы H+ и анионы кислотных остатков. Поэтому кислоту можно представить в ионной записи 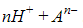
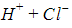
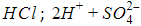
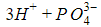
Диссоциация молекул карбоновых кислот происходит по схеме 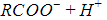
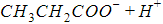
Структурные формулы
Взаимное расположение атомов и кратность связей в молекуле отражают графические, или структурные, формулы:
| Кислота | Структурная формула | Трехмерная модель молекулы |
| плавиковая HF | 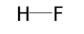 | 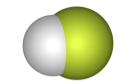 |
| угольная H2CO3 | 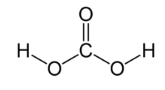 | 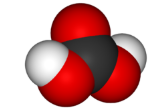 |
| уксусная CH3COOH |  |  |
Классификация кислот в химии
Кислоты подразделяются на группы по ряду признаков:
Силу кислородсодержащих кислот с формулой 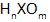
| m – n | Сила | Примеры |
| 0 | очень слабая | HClO, H3AsO3 |
| 1 | слабая | H2CO3, H2SiO3, H3PO4 |
| 2 | сильная | HNO3, HClO3, H2SO4 |
| 3 | очень сильная | HClO4, HMnO4 |
Кислоты классифицируют также по растворимости, летучести и устойчивости.
Номенклатура
Систематические наименования бескислородных кислот строятся по следующему правилу: название элемента + суффикс «-о-» + «-водородная» (бромоводородная HBr ).
Наименование кислородсодержащей кислоты определяют особенности состава:
Кислоты, их соли и ангидриды
Названия и состав некоторых кислот, их солей (наименования кислотных остатков) и ангидридов (кислотных оксидов) представлены в таблице:
Свойства кислот
В стандартных условиях кислоты представляют собой жидкости или твердые вещества. Водные растворы кислот изменяют цвет индикаторов:
Фенолфталеин на кислую среду не реагирует.
Химические свойства
Водород не выделяется в реакциях с концентрированной серной и азотной кислотами, так как металлы в этом случае окисляются серой S6+ и азотом N5+:
Продукты реакции – соль и вода.
Сильная кислота вытесняет из соли более слабую. Сила кислот убывает слева направо в ряду:
Так, в карбонате кальция CaCO3 плавиковой кислотой HF вытесняется угольная H2CO3:
При нагревании молекулы нерастворимых кислот разлагаются на кислотный оксид и воду:
Неустойчивые молекулы угольной и сернистой кислот разлагаются в момент образования на газ и воду:
Получение
Кислоты образуются при взаимодействиях:
Применение
Кислоты применяются во множестве отраслей: в пищевой, легкой, химической промышленности, в производстве медицинских препаратов, в горном деле.
Из минеральных кислот наиболее широко используются серная, азотная, ортофосфорная, соляная. Карбоновые кислоты – щавелевая, уксусная, масляная, муравьиная и другие – также находят применение в различных областях: от производства продуктов питания до металлургии.
Задания
1. Назовите валентность кислотного остатка:
2. Установите степени окисления элементов в кислотах и наименования кислот в соответствии с номенклатурой:
3. Какое соединение в ряду CO2, BaSO4, HCl, HCOOH, Na2CO3, H2SiO3, MgO, H3AsO4 является:
4. Определите тип реакции Mg+HCl=? Каковы ее продукты? Составьте ее молекулярное и ионное уравнения.
5. H2WO4 – малорастворимая вольфрамовая кислота. На какие вещества она разлагается при нагревании? Составьте уравнение реакции разложения.
Ответы
Химические свойства кислот, их классификация и реакции
Общие свойства кислот. Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Многоосновные кислоты диссоциируют ступенчато.
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Виды кислот и способы их получения
В химии неорганические соединения делятся на простые и сложные вещества. Простые состоят из атомов одного химического элемента, сложные — из нескольких. Сложные неорганические вещества делятся на пять основных классов: кислоты, основания, амфотерные гидроксиды, оксиды, соли.
Разберёмся с первым классом из списка — кислотами.
Что такое кислота — определение в химии
Кислоты — это сложные вещества, которые состоят из атомов водорода и кислотных остатков.
A c — кислотный остаток;
x — число атомов водорода;
n — степень окисления кислотного остатка.
В химических реакциях активный атом водорода может замещаться на атом металла, в результате чего получается соль. Кислотный остаток — это часть молекулы кислоты без атомов водорода. Валентность кислотного остатка равна числу связанных с ним атомов водорода.
Виды кислот и их классификация, какие бывают (примеры)
Существуют несколько классификаций кислот. Разберёмся с основной классификацией, созданной по формальным признакам: содержанию кислорода, растворимости и так далее.
По содержанию кислорода
Кислоты могут делиться на кислородосодержащие и бескислородные.
Кислородсодержащие получаются при воздействии воды на кислотные оксиды — ангидриды.
Их название в корне содержит название элемента, входящего в состав ангидрида. Примеры:
Номенклатура выглядит следующим образом. В случае, если элементу соответствуют несколько кислот, для названия кислоты с большей валентностью такого элемента употребляют суффикс «Н» или «В». Для кислот с меньшей валентностью элемента в названиях добавляют еще один суффикс «ИСТ». Например, серная ( H 2 S O 4 ) и сернистая кислота ( H 2 S O 3 ).
Бескислородные представляют собой растворы некоторых газов в воде. Названия бескислородных кислот составляют по принципу: элемент + водородная кислота.
Важно, что газ и раствор газа имеют различные свойства. Например, хлороводород и соляная кислота.
Газ хлороводород можно получить из водорода и хлора. Уравнение:
H 2 + C l 2 → 2 H C l
В сухом состоянии такой газ не проявляет кислотных свойств. При перевозке в тех же металлических ёмкостях не происходит никаких реакций. Но, если хлороводород растворить в воде, получается раствор, который называют соляной кислотой. Она обладает сильными кислотными свойствами и опасна при реагировании с металлом.
По растворимости в воде
Кислоты делят на растворимые и нерастворимые. Большинство кислот растворимы. Нерастворимые — кремниевая H 2 S i O 3 и все органические карбоновые кислоты, содержащие десять атомов углерода и больше.
По летучести
Летучие кислоты — это химические соединения, которые быстро испаряются при нормальных условиях, то есть молекулы легко переходят в газовую фазу. В их список входят, к примеру, органические соединения, которые образуются в человеческом организме в результате процесса пищеварения, болезней или метаболизма.
Список летучих кислот:
Нелетучими являются все остальные. Они стабильны в водных растворах.
По силе (степени диссоциации)
Кислоты также можно разделить на сильные и слабые. Если в водном растворе кислота полностью распадается на ионы (диссоциирует), то она является сильной. Слабые кислоты не распадаются на ионы полностью, обычно их диссоциация протекает в незначительной степени.
Как определить силу кислоты, то есть степень диссоциации? Можно использовать лёгкий приём: вычесть из числа атомов O число атомов H. Если в ответе получается число меньше 2 — слабая. Больше или равно — сильная.
Степень диссициации можно также установить экспериментальным путем посредством измерения проводимости растворов. Разбавленные растворы сильных кислот хорошо проводят электрический ток, растворы слабых кислот — плохо.
Характерные химические и физические свойства
Химические свойства
Взаимодействие с основными оксидами. Образуются соль и вода:
C a O + 2 H C l → C a C l 2 + H 2 O
Взаимодействие с амфотерными оксидами. Образуются соль и вода:
Z n O + 2 H N O 3 → Z n ( N O 3 ) 2 + H 2 O
Взаимодействие со щелочами. Образуются соль и вода (реакция нейтрализации):
N a O H + H C l → N a C l + H 2 O
Взаимодействие с солями. Реакция протекает, если выпадает осадок или выделяется газ:
B a C l 2 + H 2 S O 4 → B a S O 4 ↓ + H C l ↑
Сильные кислоты вытесняют более слабые из их солей:
K 3 P O 4 + 3 H C l → 3 K C l + H 3 P O 4
Также металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (если соль, которая образуется в итоге, растворима):
M g + 2 H C l → M g C l 2 + H 2 ↑
Однако! С азотной и концентрированной серной кислотами реакция идёт иначе:
M g + 2 H 2 S O 4 → M g S O 4 + S O 2 ↑ + 2 H 2
Физические свойства
Получение и применение кислот
Кислоты можно получить несколькими методами.
Взаимодействие кислотного оксида с водой:
H 2 O + S O 3 → H 2 S O 4
Взаимодействие водорода и неметалла:
H 2 + C l 2 → 2 H C l
Вытеснение слабой кислоты из солей более сильной кислотой:
3 H 2 S O 4 + 2 K 3 P O 4 → 3 K 2 S O 4 + H 3 P O 4
Кислоты находят широкое применение в различных сферах. К примеру, серная используется для производства лакокрасочных материалов и минеральных удобрений. Борная является медицинским антисептиком. Уксусную и лимонную добавляют при приготовлении выпечки, а аскорбиновую применяют при лечении простудных заболеваний.
Кислоты — классификация, свойства, получение и применение.
Кислотам дали такое название не просто так. Большинство из них имеют кислый вкус. С некоторыми из них знаком каждый из вас. Это, например, уксусная кислота, которая есть в каждом доме, аскорбиновая кислота (она же витамин C), лимонная кислота и т.д. Но не стоит все кислоты пробовать на вкус. Кислоты являются очень едкими веществами. Даже всем нам привычная и известная аскорбиновая кислота в большой концентрации будет вредна нашему организму. А от более сильных кислот — серной, соляной и даже уксусной — можно получить очень сильные ожоги, вплоть до летального исхода. Поэтому при работе с кислотами нужно быть осторожными, а также соблюдать технику безопасности.
Таблица названий некоторых кислот и их солей
| Название кислоты | Формула | Название соли |
|---|---|---|
| Серная | H2SO4 | Сульфат |
| Сернистая | H2SO3 | Сульфит |
| Сероводородная | H2S | Сульфид |
| Соляная (хлористоводородная) | HCl | Хлорид |
| Фтороводородная (плавиковая) | HF | Фторид |
| Бромоводородная | HBr | Бромид |
| Йодоводородная | HI | Йодид |
| Азотная | HNO3 | Нитрат |
| Азотистая | HNO2 | Нитрит |
| Ортофософорная | H3PO4 | Фосфат |
| Угольная | H2CO3 | Карбонат |
| Кремниевая | H2SiO3 | Силикат |
| Уксусная | CH3COOH | Ацетат |
Классификация кислот
| По содержанию кислорода | |
|---|---|
| Кислородсодержащие (H2SO4) | Бескислородные (HCl) |
| По количеству содержащихся катионов водорода (H+) | ||
|---|---|---|
| Одноосновные (HCl) | Двухосновные (H2SO4) | Трёхосновные (H3PO4) |
Понятие «одноосновная кислота» произошло по причине того, что для нейтрализации одной молекулы одноосновной кислоты нам понадобится одна молекула основания. для двухосновной — соответственно две молекулы и т. д.
| По растворимости (в воде) | |
|---|---|
| Растворимые (HCl) | Нерастворимые (H2SiO3) |
| По силе (степени диссоциации) | |
|---|---|
| Сильные (H2SO4) | Слабые (CH3COOH) |
| По летучести | |
|---|---|
| Летучие (H2S) | Нелетучие (H2SO4) |
| По устойчивости | |
|---|---|
| Устойчивые (H2SO4) | Неустойчивые (H2CO3) |
Свойства кислот
Изменение цвета индикаторов в кислой среде
| Индикатор | Нейтральная среда | Кислая среда |
|---|---|---|
| Метилоранж | оранжевый | красный |
| Лакмус | фиолетовый | красный |
| Фенолфталеин | бесцветный | бесцветный |
| Бромтимоловый синий | зеленый | желтый |
| бромкрезоловый зеленый | синий | желтый |
Химические свойства кислот
H2SO4 + 2Na → Na2SO4 + H2↑
Металлы, находящиеся в ряду активности после водорода, не вступают в реакцию с кислотой (кроме концентрированной серной кислоты).
Азотная и концентрированная серная кислоты проявляют свойства окислителей, и продукты реакций будут зависеть от концентрации, температуры и природы восстановителя.
H2SO4 + MgO → MgSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + H2O
H2SO4 + K2CO3 → K2SO4 + H2O + CO2↑
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Получение кислот
H2O + SO3 →H2SO4
H2 + Cl2 → 2HCl
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Применение кислот
В настоящее время, минеральные и органические кислоты находят множество сфер применения.
Серная кислота (H2SO4), находит широкое применение в химической технологии, для производства лакокрасочных материалов, производстве минеральных удобрений, в пищевой промышленности (пищевая добавка Е513), в качестве электролита в производстве аккумуляторных батарей.
Раствор двухромовокислого калия в серной кислоте (хромовая смесь) используются в лабораториях для мытья химической посуды. Являясь сильным окислителем, хромка позволяет отмывать посуду от следов загрязнений органическими веществами. Так же, хромовая смесь используется в органическом синтезе.
Борная кислота (H3BO3) используется в медицине как антисептик, в качестве флюса при пайке металлов, как борсодержащее удобрение, в домашнем хозяйстве используется как средство от тараканов.
Широко известны в домашнем использовании при выпечке уксусная и лимонная кислоты. Также в быту их используют для удаления накипи.
Знакомая всем с детства аскорбиновая кислота, более известная в народе как витамин С, применяется при лечении простудных заболеваний.
Азотная кислота (HNO3) находит применение при производстве взрывчатых веществ, при производстве минеральных азотсодержащих удобрений (аммиачная, калиевая селитра), в производстве лекарственных средств (нитроглицерин).