На что распадается сернистая кислота
Сернистая кислота: строение и химические свойства
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.
Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
HSO3 – ↔ SO3 2– + H +
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
3. Сернистая кислота взаимодействует с сильными основаниями и их оксидами.
4. Наиболее ярко выражены восстановительные свойства сернистой кислоты. При взаимодействии с окислителями степень окисления серы повышается.
Азотная кислота очень легко окисляет сернистую:
Озон также окисляет сернистую кислоту:
Качественная реакция на сернистую кислоту – обесцвечивание раствора перманганата калия:
5. В присутствии сильных восстановителей сернистая кислота может проявлять окислительные свойства.
Свойства сернистой кислоты и её взаимодействие с другими веществами
Сернистая кислота — что она собой представляет
Сернистая кислота — это двухосновная кислородсодержащая кислота.
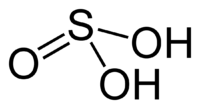
Сернистая кислота является неустойчивым веществом, распадающимся на диоксид серы S O 2 и воду. Валентность серы в сернистой кислоте равна IV, а степень окисления: +4. Структурная формула выглядит так:
Химические и физические свойства
Сернистый ангидрид S O 2 представляет собой бесцветный газ и обладает резким запахом.
Физические свойства сернистой кислоты:
Сернистая кислота в водном растворе является слабым электролитом. Диссоциация протекает обратимо по двум ступеням.
H 2 S O 3 ↔ H S O 3 – + H +
H S O 3 – ↔ S O 3 2 – + H +
В процессе самопроизвольного распада сернистой кислоты образуются диоксид серы и вода.
H 2 S O 3 ↔ S O 2 + H 2 O
Сернистая кислота вступает в химическую реакцию с сильными основаниями и их оксидами.
Взаимодействие сернистой кислоты с гидроксидами таких щелочных металлов, как натрий и калий, описывается уравнениями:
H 2 S O 3 + К О Н → K H S О 3 + H 2 O
H 2 S O 3 + 2 К О Н → К 2 S О 3 + 2 H 2 O
Среди всех химических свойств сернистой кислоты наиболее ярко выражены ее восстановительные свойства. Взаимодействуя с окислителями, сера повышают собственную степень окисления.
Обесцвечивание бромной воды с помощью сернистой кислоты:
H 2 S O 3 + B r 2 + H 2 O → H 2 S O 4 + 2 H B r
Процесс окисления сернистой кислоты азотной протекает достаточно легко по уравнению:
H 2 S O 3 + 2 H N O 3 → H 2 S O 4 + 2 N O 2 + H 2 O
Окисление сернистой кислоты с помощью озона:
H 2 S O 3 + O 3 → H 2 S O 4 + O 2
При контакте с сильными восстановителями могут проявляться окислительные свойства сернистой кислоты.
Взаимодействие сернистой кислоты и сероводорода сопровождается ее восстановлением до элементарной серы:
H 2 S O 3 + 2 Н 2 S → 3 S + 3 H 2 O
Качественная реакция на сернистую кислоту
Качественная реакция на сернистую кислоту представляет собой обесцвечивание раствора перманганата калия:
5 H 2 S O 3 + 2 K M n O 4 → 2 H 2 S O 4 + 2 M n S O 4 + K 2 S O 4 + 3 H 2 O
N a 2 S O 3 + 2 H C l → 2 N a C l + S O 2 ↑ + H 2 O
2 H + + S O 3 2 – → S O 2 ↑ + H 2 O
Способы получения и как применяется
Далее можно наблюдать реакцию, протекающую по уравнению:
C u ( м е д ь ) + 2 H 2 S O 4 ( с е р н а я к и с л о т а ) = C u S O 4 ( с у л ь ф а т с е р ы ) + S O 2 ( с е р н и с т ы й г а з ) + H 2 O ( в о д а )
Затем поток сернистого газа следует направить в пробирку с водой. При нахождении в ней газообразное вещество растворяется, частично протекает химическая реакция с водой. В итоге синтезируется сернистая кислота:
S O 2 ( с е р н и с т ы й г а з ) + H 2 O ( в о д а ) = H 2 S O 3
Таким образом с помощью пропускания сернистого газа через воду получают сернистую кислоту.
В процессе экспериментов с сернистым газом необходимо использовать индивидуальные средства защиты, так как вещество раздражает слизистую оболочку дыхательных путей. Подобное воздействие сопровождается воспалительным процессом и потерей аппетита. Длительное вдыхание сернистого газа приводит к потере сознания.
Сернистая кислота нашла применение в качестве восстановителя. Вещество используют для беления шерсти, шелка и других материалов, которые не способны выдержать отбеливание сильными окислителями в виде хлора. Сернистую кислоту используют в процессе консервирования плодов и овощей, а также для:
Сернистая кислота
| Сернистая кислота | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | сернистая кислота |
| Химическая формула | H2SO3 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 82.07 а. е. м. |
| Молярная масса | 82.07 г/моль |
| Плотность | 1,03 г/см³ |
| Термические свойства | |
| Химические свойства | |
| pKa | 1,81 |
| Растворимость в воде | 14.73 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7782-99-2 |
| Регистрационный номер EC | 231-973-1 |
| Безопасность | |
| Токсичность |  |
Серни́стая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Химическая формула 
Химические свойства
Кислота средней силы:

Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
и средние — сульфиты (в избытке щёлочи):
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:
При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
слабая двухосновная кислота, отвечающая степени окисления серы +4
Применение
Сернистая кислота и её соли применяют как восстановители, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей (хлора). Сернистую кислоту применяют при консервировании плодов и овощей. Гидросульфит кальция (сульфитный щелок, Са(HSO3)2) используют для переработки древесины в так называемую сульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнин — вещество, связывающее волокна целлюлозы, в результате чего волокна отделяются друг от друга; обработанную таким образом древесину используют для получения бумаги).
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Сернистая кислота» в других словарях:
СЕРНИСТАЯ КИСЛОТА — H2SO3, слабая двухосновная кислота. В свободном виде не выделена, существует в водных растворах. Соли сернистой кислоты сульфиты … Большой Энциклопедический словарь
СЕРНИСТАЯ КИСЛОТА — (H2SO3) слабая двухосновная кислота. Существует лишь в водных растворах. Соли С. к. сульфиты. Применяют в целлюлозно бумажной и пищевой промышленности. См. также Кислоты и ангидриды … Российская энциклопедия по охране труда
сернистая кислота — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN sulfurous acid … Справочник технического переводчика
сернистая кислота — Н2SO3, слабая двухосновная кислота. В свободном виде не выделена, существует в водных растворах. Соли серной кислоты сульфиты. * * * СЕРНИСТАЯ КИСЛОТА СЕРНИСТАЯ КИСЛОТА, H2SO3, слабая двухосновная кислота. В свободном виде не выделена,… … Энциклопедический словарь
сернистая кислота — sulfito rūgštis statusas T sritis chemija formulė H₂SO₃ atitikmenys: angl. sulfurous acid rus. сернистая кислота ryšiai: sinonimas – vandenilio trioksosulfatas (2–) … Chemijos terminų aiškinamasis žodynas
Сернистая кислота — H2SO3, слабая двухосновная кислота, отвечающая степени окисления серы +4. Известна только в разбавленных водных растворах. Константы диссоциации: K1 = 1,6 · 10 2, K2 = 1,0 · 10 7 (18°C). Даёт два ряда солей: нормальные Сульфиты и кислые… … Большая советская энциклопедия
СЕРНИСТАЯ КИСЛОТА — H2SO3, слабая двухосновная кислота. В свободном виде не выделена, существует в вод. р рах. Соли С. к. сульфиты … Естествознание. Энциклопедический словарь
Сернистая кислота — см. Сера … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
СЕРНИСТАЯ КИСЛОТА — см. Серы диоксид … Химическая энциклопедия
Урок №24. Оксид серы (IV). Сернистая кислота и её соли
Сернистый ангидрид; сернистый газ – SO 2
Физические свойства
Обесцвечивает многие красители, убивает микроорганизмы.
Получение
1) При сжигании серы в кислороде:
2) Окислением сероводорода и сульфидов:
2H 2 S + 3O 2 = t = 2SO 2 + 2H 2 O
2CuS + 3O 2 = t = 2SO 2 + 2CuO
4FeS 2 + 11O 2 = t = 2Fe 2 O 3 + 8SO 2
3) Обработкой солей сернистой кислоты – сульфитов минеральными кислотами:
Na 2 SO 3 + 2HCl = 2NaCl + SO 2 ↑ + H 2 O
4) При окислении неактивных металлов концентрированной серной кислотой:
Cu + 2H 2 SO 4 (конц) → CuSO 4 + SO 2 ↑ + 2H 2 O
Химические свойства
1. SO 2 – проявляет окислительно-восстановительные свойства
SO 2 — восстановитель (S +4 – 2ē → S +6 )
2SO 2 + O 2 ← кат-V2O5 → 2SO 3
Обесцвечивает бромную воду:
SO 2 + Br 2 + 2H 2 O = H 2 SO 4 + 2HBr
Окисляется азотной кислотой, озоном и оксидом свинца (IV):
SO 2 + 2HNO 3 = H 2 SO 4 + 2NO 2
Обесцвечивает раствор перманганата калия – качественная реакция на сернистый га з:
5SO 2 + 2KMnO 4 + 2H 2 O = K 2 SO 4 + 2MnSO 4 + 2H 2 SO 4
SO 2 — окислитель (S +4 + 4ē → S 0 )
SO 2 + С = t = S + СO 2
SO 2 + 2CO = t = 2СО 2 + S
SO 2 + 2H 2 S = t = 3S + 2H 2 O
При растворении SO 2 в воде образуется слабая и неустойчивая сернистая кислота H 2 SO 3 (существует только в водном растворе)
Свойства сернистой кислоты
Сернистая кислота диссоциирует ступенчато:
(первая ступень, образуется гидросульфит – анион)
(вторая ступень, образуется анион сульфит)
Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка.
Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO 2 с резким запахом:
Na 2 SO 3 + 2HCl = 2NaCl + SO 2 ↑+ H 2 O
2H + + SO 3 2- = SO 2 ↑+ H 2 O
Сернистая кислота H 2 SO 3. проявляет восстановительные свойства:
Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
H 2 SO 3 + I 2 + H 2 O = H 2 SO 4 + 2НI
Водные растворы сульфитов щелочных металлов окисляются на воздухе:
2SO 3 2- + O 2 = 2SO 4 2-
3. Взаимодействие со щелочами
Ba(OH) 2 + SO 2 → BaSO 3 ↓ (сульфит бария) + H 2 O
Ba(OH) 2 + 2SO 2 (избыток) = Ba(HSO 3 ) 2 (гидросульфит бария)
4. Взаимодействие с основными оксидами
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Задание №1. Закончите уравнения химических реакций, составьте электронный баланс, укажите процессы окисления и восстановления, окислитель и восстановитель:
Задание №2. Осуществите превращения по схемам:
1) S → H 2 S → SO 2 → Na 2 SO 3 → BaSO 3 → SO 2
3) FeS 2 → SO 2 →Na 2 SO 3 +HCl → A + O 2 → B → H 2 SO 4
5) SO 2 → S → K 2 S → H 2 S → PbS → SO 2
6) H 2 SO 3 +I 2 → A +Cu → B +NaOH → C
7) K 2 SO 3 → SO 2 → MgSO 3 → SO 2 → KHSO 3 → SO 2
Уравнения реакций ионного обмена напишите в полном и кратком ионном виде.
Оксид серы (IV) и сернистая кислота
SO 2 (сернистый ангидрид; сернистый газ)
Обесцвечивает многие красители, убивает микроорганизмы.
1) При сжигании серы в кислороде:
2) Окислением сульфидов:
3) Обработкой солей сернистой кислоты минеральными кислотами:
4) При окислении металлов концентрированной серной кислотой:
1) Сернистый ангидрид — кислотный оксид.
· взаимодействие с водой
При растворении в воде образуется слабая и неустойчивая сернистая кислота H 2 SO 3 (существует только в водном растворе)
Сернистая кислота диссоциирует ступенчато:
H 2 SO 3 ↔ H + + HSO 3 — (первая ступень, образуется гидросульфит – анион)
HSO 3 — ↔ H + + SO 3 2- (вторая ступень, образуется анион сульфит)
H 2 SO 3 образует два ряда солей — средние (сульфиты) и кислые (гидросульфиты).
Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO 2 с резким запахом:
Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
· взаимодействие со щелочами
Ba ( OH )2 + 2 SO 2 (избыток)→ Ba ( HSO 3)2(гидросульфит бария)
· взаимодействие с основными оксидами
2) Реакции окисления, SO 2 — восстановитель ( S +4 – 2ē → S +6 )
Водные растворы сульфитов щелочных металлов окисляются на воздухе:
3) Реакции восстановления, SO 2 — окислитель ( S +4 + 4ē → S 0 )
SO 2 + С → S + С O 2 (при нагревании)








