Нао болезнь что такое
Дифференциальная диагностика и принципы терапии наследственного ангионевротического отека (анализ клинического наблюдения)
Наследственный ангионевротический отек (НАО) — хроническое заболевание, относящееся к группе первичных иммунодефицитов с аутосомно-доминантным наследованием и неполной пенетрантностью, связанное с качественным или количественным генетически детерминирова
Наследственный ангионевротический отек (НАО) — хроническое заболевание, относящееся к группе первичных иммунодефицитов с аутосомно-доминантным наследованием и неполной пенетрантностью, связанное с качественным или количественным генетически детерминированным дефектом генов, кодирующих синтез ингибитора эстеразы компонента комплемента C1 (С1inh), которое проявляется в виде рецидивирующих отеков (О.) кожи и слизистых оболочек дыхательных путей, желудочно-кишечного (ЖКТ) и урогенитального трактов [2, 3, 5, 10–14]. Первые упоминания о подобных О. были сделаны Гиппократом в IV в. до н. э.
Первичный дефицит компонентов комплемента встречается редко, так как для манифестации необходимо гомозиготное состояние по аутосомным аллелям. Исключение — делеция гена С1inh при типе 1, точечная мутация при типе 2 (11р11.2-q13). Больные НАО являются гетерозиготами, т. е. имеют один нормальный и один измененный ген, отвечающий за синтез и функционирование С1inh. Частота мутации гена составляет в среднем 1/100 000 [2, 3, 10, 13]. Несмотря на редкое распространение НАО, в некоторых странах созданы национальные общества и регистры, например, во Франции описано 300 случаев [11].
В настоящее время известны 3 различных дефекта [2, 3, 5, 10–12], которые клинически неразличимы:
Критерии диагноза НАО [2, 3, 5, 1-–14, 16, 17] (табл. 1)
Особенности клинической картины
Первые признаки НАО могут возникнуть уже в возрасте нескольких месяцев, но чаще после 1-2 лет жизни. У большинства больных НАО дебют заболевания возникает до 20 лет (60%), гораздо реже — в среднем и даже пожилом возрасте [2, 3, 10, 13]. В пубертатном периоде течение заболевания может утяжелиться в связи с гормональной перестройкой. Больные неоднократно наблюдаются у различных специалистов и не сразу обращаются к аллергологу-иммунологу.
Отсутствие в семейном анамнезе сведений о НАО не исключает возможности постановки подобного диагноза [3, 10, 11, 16]. Клинические проявления у пациентов характеризуются рецидивирующими О. различной локализации: кожи лица (губы, периорбитальная область), шеи, туловища, конечностей, слизистых оболочек верхних отделов дыхательных путей, в том числе гортани, желудочно-кишечного (приступообразные боли в животе) и урогенитального трактов. О. может распространяться на верхние дыхательные пути с вовлечением пищевода, гортани и проявляется дисфагией, дисфонией, симптоматикой обструкции дыхательных путей, напоминающей в ряде случаев бронхиальную астму, и прогрессировать вплоть до асфиксии. Смертность при НАО составляет 20–30% [12]. Больным с О. без симптомов крапивницы и кожного зуда следует уделять особое внимание, так как у них может быть АНО с синдромом недостаточности С1inh, носящий наследственный характер.
Интервалы между обострениями у каждого больного индивидуальны: у некоторых больных О. возникают только после значительной травмы, у других обострения проявляются через каждые 9– 14 дней, вне зависимости от внешних воздействий, на протяжении многих лет [2, 3]. Нередко у больных наблюдается аура в виде слабости, разбитости, мраморность кожи, обильных бледных высыпаний типа кольцевидной эритемы, сохраняющейся во время О., не сопровождающиеся зудом, жжением и ↑ t°. О. может возникать на любом участке кожи или слизистых оболочек.
У более половины больных наблюдаются выраженные А. (вызваны О. различных участков слизистой оболочки ЖКТ). Кожные симптомы, как правило, остаются или усиливаются во время О. или А. Развитию приступов A. при НАО часто предшествуют ощущения спазмов в околопупочной области, слабость, тошнота, спастические боли в эпигастрии. Абдоминалгия нередко сопровождается рвотой и жидким стулом, характерна болезненность живота при пальпации. Клинически болевой синдром проявляется в виде разлитой боли в брюшной полости, кишечных колик, возможна тонкокишечная непроходимость. У ряда пациентов наблюдается первичный генез рецидивирующей тонкокишечной непроходимости как forme fruste (приостановление в развитии или скрытое течение заболевания), и только исследование концентрации С4-фракции комплемента позволяет правильно поставить диагноз [7]. Некоторые пациенты предъявляют жалобы на ощущения «отеков внутренних органов».
Боли в животе бывают настолько интенсивными, что их иногда называют «брюшная мигрень», а сопровождающие болевой симптом общие явления (тахикардия, колебания АД, головокружение, головная боль и др.) — «вегетативная буря». Из-за А. больные часто подвергаются лапаротомии; при операции выявляют ограниченный О. кишечника, признаки асептического воспаления.
В более редких случаях при локализации О. на лице могут вовлекаться менингеальные оболочки с проявлением менингеальных симптомов (ригидность затылочных мышц, резкая цефалгия, рвота, иногда судороги), при поражении лабиринтных систем развивается синдром Меньера, что выражается головокружением, тошнотой, рвотой. Все эти симптомы могут встречаться как одновременно, так и по отдельности. При атипичном течении О. могут отсутствовать, также возможны изолированные А., характерны полиартралгии, снижение С4-фракции комплемента. В очень редких случаях описаны: эпилептический приступ, уртикарии, кожная пурпура, феномен Рейно [11]. При лабораторном обследовании больных НАО обнаруживается: С1inh обычно не более 20–30% от нормального (или отсутствие даже в период полной ремиссии), концентрации С2- и С4-компонентов — не более 30–40% от нормальных, уровни С1 и С3 в плазме чаще нормальные. В результате нарушения ингибирования активности С1 постоянно происходит активация комплемента.
Дифференциальная диагностика
Для того чтобы идентифицировать НАО, необходимо провести дифференциальную диагностику генетического, отечного и абдоминального синдромов.
В 80-х гг. J. T. Chiu и соавт. описали редкие случаи приобретенной гипокомплементемии и приступов АНО со снижением содержания С1inh в плазме, что наблюдается при активации и потреблении комплемента при инфекционных заболеваниях и обострении болезней, обусловленных циркуляцией «иммунных комплексов» (ЦИК). Известно редкое явление — персистирующий приобретенный дефицит С1inh в сочетании с ↓ содержания С1, С4 и С2 у больных В-клеточными лимфомами [2, 3, 5, 13, 14; табл. 1, 3].
По сравнению с врожденной формой, приобретенный АНО (ПАНО) с дефицитом С1inh, встречается реже, при этом у других членов семьи больного не обнаруживаются аномалии уровня С1inh. Это комплемент-зависимый ПАНО связан с ускорением метаболизма С1inh в 2-3 раза.
Кроме ↓ уровня С4 и С1inh для больных с приобретенной формой заболевания характерно ↓ С1 и С1q, что помогает проводить дифференциальную диагностику. ПАНО можно отличить от НАО по отсутствию дефектности системы комплемента у здоровых родственников и ↓ содержания С1-компонента, при наследственной форме обычно содержащегося в нормальном количестве (табл. 1).
Этиопатогенетическая структура отечного синдрома чрезвычайно вариабельна и имеет полиморфный генез: гипоонкотический, мембраногенный, эндокринный, венозный, лимфогенный О., также отмечены медикаментозные и идиопатические О. [7, 10, с дополнениями].
Распространенные и редкие причины А. могут быть связаны с патологией ЖКТ, гепатобиллиарной системы и поджелудочной железы, системы органов дыхания, сердечно-сосудистой системы, нервной системы, опорно-двигательного аппарата, мочевыделительной системы, половых органов, эндокринного и метаболического генеза, при гематологических заболеваниях и иммунодефицитных состояниях, а также при распространенных инфекционных и паразитарных заболеваниях [12, 14, 16, 18, с дополнениями].
Описанный ниже клинический случай пациентки с направительным диагнозом периодической болезни (ПБ) заставил нас вспомнить об этом заболевании.
ПБ, или семейная средиземноморская лихорадка (доброкачественный (семейный) пароксизмальный перитонит, возвратный полисерозит; перемежающаяся шестидневная лихорадка, ложный «острый живот», синдром Джэйнуэя-Мозенталя, болезнь Реймана, синдром Сигала-Коттена-Маму). До недавнего времени ПБ считалась редкой генетически обусловленной патологией с аутосомно-рецессивным (не исключается аутосомно-доминантный) типом наследования и полной пенетрантностью гена [1, 4, 6, 8, 9, 15, 18, с дополнениями].
Болезнь начинается чаще в детстве и встречается у людей из этнических групп Восточного Средиземноморья (дебют первого приступа ПБ, как правило, наблюдают до 30 лет и в 1,5-2 раза чаще у мужчин с астенической конституцией) — армян, евреев (чаще сефардов), арабов, турков, реже у лиц других национальностей. Средний возраст, в котором дебютируют первые признаки болезни, — 9 лет с колебаниями от 2 мес до 60 лет. Средняя продолжительность болезни — 16,8 лет. Ежегодно отмечается тенденция роста заболеваемости и расширение географии распространения ПБ, причем не только у представителей народов средиземноморского бассейна, но и среди коренного населения: у японцев, русских, болгар, итальянцев. Эндемическим районом считается Армения [4, 5, с дополнениями]. Частота семейных случаев ПБ резко варьирует от 6,8 до 60%. По данным А. А. Айвазяна (n=1036) [1], частота семейных форм составляет 27,5%. Вероятность передачи заболевания от матери к дочери — 2,2%, а от отца к сыну — 28%.
Провоцирующими пароксизмы факторами обычно являются: эмоциональная перегрузка, переутомление, охлаждение, интеркуррентные заболевания, различные пищевые продукты, оперативные вмешательства, перемена климата, обострение язвенной болезни и т. д. Для ПБ характерно обострение с началом менструации, ремиссия болезни во время беременности и после назначения больным прогестерона (табл. 4). Продромальными симптомами (81%) при ПБ являются: слабость, недомогание, зевота, чувство внутренней тревоги, снижение аппетита, раздражительность, ломота в теле, бледность кожных покровов или крапивница, акроцианоз, парестезии, ощущение жжения в животе, полидипсия, похолодание конечностей, озноб и повышение температуры тела, которые обычно наблюдаются за 1-2 ч до развития основного синдрома [4]. По основным клиническим проявлениям выделяют: 1) абдоминальную, 2) торакальную, 3) суставную, 4) лихорадочную и 5) смешанную формы ПБ. Характерны стереотипные периодические пароксизмы высокой t до 38–40°С в 100%, А. в 81,7–98% и/или торакалгий (плевриты и перикардиты) в 33–66%, артралгий и/или артритов в 50–77%, рожеподобной сыпи (эритема) в 46%, лимфаденопатии в 1–6% случаев. Патогномоничные симптомы ПБ (табл. 4) длятся, как правило, от нескольких часов до 3 сут, проходят самостоятельно. Основу клинической картины асептических перитонитов составляет парез ЖКТ. На высоте приступа интенсивные А. сопровождаются тошнотой, рвотой, вздутием живота, задержкой отхождения газов. При объективном исследовании отмечаются: гиперемия лица, тахикардия, вздутие, напряжение, усиление кишечных шумов и болезненность живота, симптомы раздражения брюшины, при этом живот не участвует в акте дыхания. Часто определяется гепатомегалия, реже — спленомегалия.
При лабораторном исследовании в этот период определяются острофазные воспалительные изменения периферической крови. Лапароскопия считается основным диагностическим тестом, особенно для диагностики первого приступа А. при ПБ [1, 4]. Желчный пузырь, как правило, несколько увеличен, застойный и находится в нежных спайках с окружающими тканями или органами, в основном с сальником. В серозной жидкости, взятой из брюшной полости, у всех больных обнаруживаются в различных количествах лейкоциты и лимфоциты. Окончание приступа сопровождается обильным потоотделением на фоне снижения t° тела, началом отхождения газов, уменьшением А. У некоторых больных A. сочетаются с торакалгиями колющего или давящего характера, затрудняющими дыхание, и суставными явлениями. При выраженных А. нередко производятся неоднократные лапоротомии, «ненужные операции» — аппендэктомии, холецистэктомии, спленэктомии, грыжесечение, нефрэктомии, гистеровариэктомии. У таких пациентов описан феномен «географического живота», характеризующегося наличием многочисленных послеоперационных рубцов [1, 4, 6, 8, 9].
Указанные симптомы возникают с интервалом несколько недель или месяцев и обычно проявляются в течение 1–3 дней. Пароксизмы рецидивируют с частотой от 1-2 нед до 1 года; могут быть спонтанные ремиссии. Редко наблюдается status periodicus, когда приступы повторяются практически без светлых промежутков; очень редко возможны и абортивные приступы. Имеются наблюдения развития периодической пурпуры, язвенного поражения кожи лица, нейтропении, менингита, психоза, эпилептиформных судорог [4, 6, 9]. Ассоциированный с ПБ; вторичный АА-амилоидоз развивается, по одним данным, в 25%, по другим — в 41,3% случаев, особенно у носителей HLA A28, B5. Поражение почек часто определяет прогноз (причина смерти больных от уремии до 40-летнего возраста) и считается наиболее постоянным и выраженным признаком при ПБ с лихорадкой, абдоминальными и плевральными синдромами. Известны 2 фенотипа ПБ: при первом (чаще) — присоединение амилоидоза происходит при уже имеющейся картине ПБ; при втором (реже) — амилоидоз является первым признаком заболевания. Наряду с этим встречаются случаи ПБ без амилоидоза и случаи, когда амилоидоз служит единственным проявлением заболевания [8].
Описанный клинический случай представляет интерес для врачей различных специальностей с целью проведения дифференциального диагноза НАО и ПБ (табл. 4).
Впервые приступообразные боли в животе (абдоминалгии) появились в возрасте 7 лет. А. продолжительностью более 12 ч повторялись каждые 7–12 дней, сопровождались рвотой, жидким стулом, при этом не отмечалось связи с конкретными причинными факторами, провоцирующими приступы. Неоднократное обследование у различных специалистов, патологии не было выявлено, еженедельные приступы сохранялись. В 13 лет на фоне очередного приступа абдоминалгии госпитализирована в хирургическое отделение с подозрением на холецистит, при лапаротомии изменений желчного пузыря не выявлено, произведена аппендэктомия. Посев на флору серозной жидкости подтвердил асептическое воспаление. С 15 лет на фоне месячных отмечается появление рецидивирующих спонтанных О. различной локализации кожи и слизистых оболочек, исчезающие самостоятельно через 12–16 ч, возникающие еженедельно. О. на коже и слизистых возникали с той же периодичностью, как и приступы А., иногда провоцировались травмой, психоэмоциональной нагрузкой, стоматологическими манипуляциями (экстракция зуба). В 1974 г. впервые О. гортани с удушьем. Применение антигистаминных препаратов и глюкокортикостероидов без положительного эффекта. Со слов пациентки и по данным медицинской документации, лихорадочных реакций, кратковременного повышения температуры тела до, во время и после приступов А. никогда не отмечалось (кроме редких случаев ОРВИ с t до 37,5°С). Больная неоднократно обследовалась у аллерголога, данных, свидетельствующих о наличии аллергопатологии, получено не было, протеинурии не отмечалось. Во время беременности прослеживалась транзиторная протеинурия до 0,03 г/л/сут, умеренное повышение АД до 150 и 90 мм рт. ст., приступы А. продолжались. Роды протекали без развития О. Но после родов О. продолжали возникать через 10–14 дней с той же периодичностью. После родов протеинурия не обнаружена при многократных повторных анализах мочи. После наступления менопаузы абдоминальные боли стали беспокоить реже (1-2 раза в месяц), О. гортани 1-2 раза в год, последний раз в феврале 2001 г.
С марта 2001 г. наблюдалась в Клинике терапии, нефрологии и профессиональных болезней им. Е. М. Тареева ММА им. И. М. Сеченова. Проводились общеклиническое обследование, биопсия десны и прямой кишки. Амилоидоз не верифицирован. Методом исключения, учитывая анамнез, национальность, характерные клинические проявления, невыявленную острую хирургическую патологию при повторяющихся пароксизмах А., установлен диагноз: «периодическая болезнь с абдоминалгиями, ангионевротическими отеками». Назначена терапия колхицином по 1,0 мг/сут в течение года, затем в связи с недостаточным эффектом терапии колхицин назначен по 1,5 мг/сут в течение 6 мес, положительного эффекта от терапии не отмечалось, приступы А. и О. продолжались с той же частотой. В октябре 2002 г. пациентка обратилась в Центр медицинской генетики НАН (г. Ереван). Обнаружена мутация М694V в гетерозиготном состоянии (ген MEFV). Диагноз ПБ не подтвержден. Система комплемента специально не исследовалась. По данным медицинской документации Клиники им. Е. М. Тареева, в связи с № АД в 2001 г. рекомендован прием энапа, но, со слов пациентки, препарат она не принимала.
При поступлении состояние относительно удовлетворительное, t — 36,8°C Конституция гиперстеническая (масса тела — 84 кг, рост — 164 см, ИМТ — 31,23). Кожные покровы бледно-розовые, с несколько повышенной сухостью и нормальной эластичностью, зуда и О. нет. Периферические лимфатические узлы не увеличены. Движения в суставах сохранены в полном объеме, крепитации, болезненности не отмечается, мышцы и скелет без особенностей. ЧДД 18/мин, дыхание везикулярное, хрипов нет. Тоны сердца ясные с ЧСС = 84/мин, ритм правильный; дующий систолический шум на верхушке. АД 145 и 90 мм рт. ст. При осмотре О. слизистой оболочки полости рта нет. Живот увеличен в размерах, симметричный, мягкий, б/б при поверхностной пальпации. При глубокой ориентировочной методической скользящей пальпации по Образцову-Стражеско-Василенко симптомов раздражения брюшины не выявлено. Слабоположительные симптомы: Ортнера и Георгиевского-Мюсси справа. Печень и селезенка не увеличены. Стул и мочеиспускание регулярные, свободные, безболезненные, симптом «поколачивания» отрицательный с обеих сторон. При исследовании поджелудочной железы: дискомфорт при пальпации зоны Шоффара и панкреатической точки Дежардена. Щитовидная железа мягко-эластической консистенции, не увеличена.
При копрологическом обследовании выявлены признаки ферментативной недостаточности поджелудочной железы. При биохимическом анализе крови: снижение уровня сывороточного железа до нижней границы нормы при ОЖСС — 46,2, остальные основные показатели в пределах нормы. Во время умеренного приступа абдоминальных болей: АЛТ 18,2 ед/л, АСТ 21,0 ед/л, ЩФ 65 ед/л, a-амилаза 39 ед/л, диастаза мочи 110 ед/л. Выявлено снижение g-глобулинов до 7,0 г/л (в норме 8,3–16,8 г/л). Коагулограмма (вне приступа): признаки гиперкоагуляции. При УЗИ: диффузные изменения печени и поджелудочной железы по типу липоматоза; в остальном без патологии. ЭКГ: ритм синусовый, правильный с ЧСС 68/мин. Полугоризонтальное положение ЭОС. Замедление АВ-проводимости I степени. Изменения миокарда диффузного характера. В иммунограмме: CD 8+абс. — 386 (нижняя граница нормы), CD4+/CD8+ — 2,52 (N 1,0–2,5), CD 19+ — 3% (N 5-19), CD 19+абс. — 61 (N 100-500), ЦИК (у. е.): ПЭГ 3% — 32 (N 14-35), ПЭГ 4% — 96 (N 50-90), соотношение 3% к 4% — 3,0 (N 2,5-3,5), показатели Ig A, M, G, общего E в норме. Скарификационные кожные аллергопробы: тест-контроль — «-», гистамин — «++». Сенсибилизации к бытовым, эпидермальным и пыльцевым аллергенам не выявлено. При исследовании системы комплемента в Институте иммунологии МЗ РФ: С2 — 2 (4-6), С4 — 2 (5-7), СН50 — 3 (4-6), С1inh — 30 ед (в 5 раз ниже минимально нормального значения). Показатели снижены. С2 — 2 (4-7), С4 — 6 (7-10), С5- 5 (5-8), СН50- 5 (4-7). Заключение: С2, С4 — ниже нормы, С5 — нижний предел нормы. Очень низкая активность комплемента. Острофазное состояние. При обследовании также получено сомнительное количество антител к антигенам лямблий. При копроовоцистоскопии (ФЦ Госсанэпиднадзора) — цисты Lamblia intestinalis. В зеве: Str. salivarius — умеренный рост, Candida albicans — обильный рост.
Рекомендации по лечению и ведению пациентов при НАО [2–3, 10–12, 14]
Пациенты с НАО требуют не только дифференцированного индивидуального подхода, но и назначения препаратов, учитывая возможный риск, изменение качества жизни. Такие предпосылки обусловлены тем, что дебют заболевания чаще происходит в пубертатный период, когда имеются не только эндокринные, но и психологические проблемы у пациентов с НАО.
В случае дебюта НАО у девочек в пубертатном периоде или женщин во время беременности и лактации рекомендуется начинать лечение с введения нативной плазмы.
Для многих пациентов зрелого возраста характерно многолетнее и безуспешное лечение у врачей различных специальностей — терапевтов, гастроэнтерологов, гинекологов, хирургов, врачей приемных комиссий военкоматов и др. В связи с этим больным НАО часто ставят неправильный диагноз (О. Квинке, крапивница, аллергия, острый живот, острый аппендицит, острый холецистит, стеноз чревного ствола, ангина, ревматологическое заболевание, кровоизлияние в мозг, мигрень, эпилепсия и др.) и назначают неадекватную для данного заболевания терапию, что становится причиной высокой смертности таких пациентов. Около 25% больных умирают от О. гортани в возрасте до 30 лет. Многим больным неоднократно проводят лапаротомии и трахеотомии из-за некупирующихся О. [2, 3, 10, 13].
Данный клинический случай ярко демонстрирует сложности дифференциальной диагностики абдоминального синдрома при НАО и ПБ, что отражено в таблице 4. Это особенно важно для практикующих врачей-хирургов, терапевтов, врачей скорой помощи, оториноларингологов, аллергологов. От клиницистов требуется не только сбор анамнеза заболевания и владение методами объективного исследования, но и знание клинической картины кожно-висцерального синдрома — ПБ и атипичных проявлений НАО, ставших актуальной проблемой современной клинической аллергологии и иммунологии.
По вопросам литературы обращайтесь в редакцию.
Г. Х. Викулов
Е. С. Феденко, доктор медицинских наук
Т. В. Латышева, доктор медицинских наук, профессор ГНЦ Институт иммунологии МЗ РФ, г. Москва
Нао болезнь что такое
Кафедра клинической аллергологии ГБОУ ДПО РМАПО Минздрава России, Москва
Редкие (орфанные) заболевания (англ. rare disease, orphan disease) – заболевания, затрагивающие небольшую часть популяции. Единого международного определения орфанных болезней нет. Нет и общего для всех стран критерия «редкости» заболевания. В США редкими считают болезни с распространенностью 1 случай на 1500 человек, в Европе – 1 на 2000, в Японии — 1 на 50 тыс., в Австралии — 1 человек менее чем на 2000 жителей страны, в России – 1 на 10 тыс. человек. Однако эти цифры можно считать условными, т.к. для разных заболеваний они могут меняться в связи с появлением новых данных или в зависимости от географического положения и состава популяции. Орфанными называют не просто малораспространенные заболевания – это хронические тяжелые или угрожающие жизни болезни, которые могут приводить к инвалидности, сокращению продолжительности жизни. Классифицировать их непросто: некоторые редкие недуги не имеют даже кода в международном классификаторе болезней. К орфанным относят почти все генетические заболевания – они передаются по наследству и сопровождают человека всю жизнь.
Для большинства редких заболеваний не существует эффективного лечения, однако при сегодняшнем уровне фармакологической индустрии производится множество лекарственных препаратов, позволяющих улучшить качество и продолжительность жизни пациентов. Как правило, пациенты с разными редкими заболеваниями сталкиваются с одними и теми же вопросами. В первую очередь это проблемы, связанные с диагностикой конкретного заболевания, поиском квалифицированного специалиста и достоверной информации о заболевании. Отсутствие определенного диагноза существенно затрудняет тактику лечения и прогноз заболевания. В случае наследственного заболевания диагноз необходим для прогноза в отношении вероятности рождения других больных в данной семье. В связи с вышеизложенным во всем мире признается необходимость принятия соответствующих мер на государственном уровне, т.к. решение вопросов, связанных с диагностикой, лечением и социальным обеспечением пациентов с редкими заболеваниями, а также проведение специализированных научно-исследовательских программ невозможны без поддержки и финансирования со стороны государства. Уровень такой поддержки в разных странах варьируется, при этом в некоторых государствах существуют специальные государственные программы, направленные на поддержку данной категории больных. Сотни редких заболеваний уже можно диагностировать различными методами анализа биологических образцов (биохимическими, иммунологическими, цитогенетическими, молекулярно-генетическими и др.). Создание специализированных регистров по отдельным заболеваниям позволяет проводить поиск причин и изучать их клинические особенности. Единая информационная база, которой могут пользоваться как исследователи, так и врачи, позволяет обмениваться информацией и повышает эффективность усилий в решении задач диагностики и лечения пациентов.
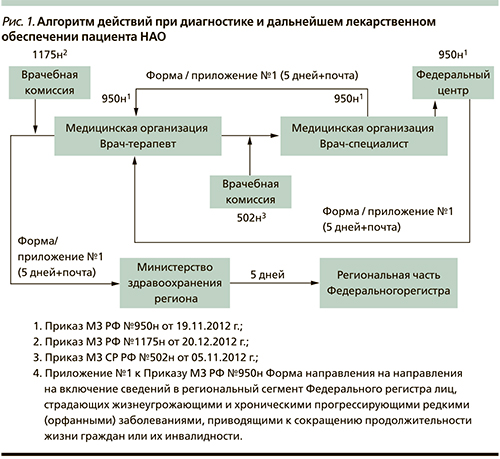
Впервые в российском законодательстве определение понятия «орфанные болезни» было дано в 2011 г. в Федеральном законе «Об основах охраны здоровья граждан в Российской Федерации». В этом документе редкие (орфанные) они определяются как заболевания, имеющие распространенность не более 10 случаев на 100 тыс. населения (или 1 случай на 10 тыс.). По разным оценкам, в России насчитывается от 300 тыс. до 5 млн человек, страдающих редкими болезнями. Отсутствие более точной статистики связано с тем, что само понятие орфанного заболевания введено совсем недавно. Кроме того, в 2012 г. Правительством РФ был утвержден перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни граждан или их инвалидности, представленный 24 нозологиями и размещенный в открытом доступе на официальном интернет-портале правовой информации (pravo.gov.ru) [1]. Также были утверждены правила ведения Федерального регистра лиц, страдающих редкими (орфанными) заболеваниями, обозначенными в перечне. По данным Минздрава, в настоящее время разработаны 24 стандарта оказания помощи пациентам с редкими заболеваниями, угрожающими жизни и приводящими к инвалидности. Основная часть финансовой нагрузки по лечению орфанных больных из списка ложиться на региональные бюджеты.
Одним из орфанных заболеваний, представленных в регистре, является наследственный ангиоотек (НАО) – заболевание указано как дефект системы комплемента (D 84.1). На сегодняшний день проблемы гиподиагностики данного заболевания, относящегося к первичным иммунодефитам, стоят очень остро. С клиническими проявлениями данной патологии на первичном этапе сталкиваются педиатры, врачи общей практики, хирурги, отоларингологи. В связи со скудной информацией о НАО постановка диагноза, к сожалению, может занять многие годы. В данной статье мы бы хотели осветить общие сведения о данном заболевании и затронуть вопросы лекарственного обеспечения этой категории больных.
Определение, патогенез и клиническая картина
НАО – редкое, потенциально жизнеугрожающее, генетически детерминированное заболевание, связанное с дефицитом или снижением функции С1-ингибитора (C1INH), характеризующееся рецидивирующими отеками глубоких слоев дермы различной локализации, которые сохраняются от нескольких часов до нескольких дней и в большинстве случаев проходят бесследно без дополнительной терапии [2]. К характерным особенностям отеков при НАО относится отсутствие зуда, гиперемии кожи, сопутствующей крапивницы, а также эффекта от лечения глюкокортикостероидами (ГКС) и антигистаминными средствами. НАО относится к первичным иммунодефицитам без инфекционного синдрома; в патогенезе данного заболевания основную роль играют нарушения в системе комплемента. Распространенность 1:50 тыс. Для данного заболевания в большинстве случаев характерен аутосомно-доминантный тип наследования. Около 25% больных не имеют семейной истории ангиоотеков (мутации de novo) [2]. Достоверных данных о распространенности НАО среди населения России нет, что обусловлено низкой выявляемостью данного заболевания и отсутствием достаточной информированности врачей об этом заболевании.
На сегодняшний день выделяют 2 формы НАО [3–6]: 1) НАО вследствие недостаточности C1INH и 2) НАО с нормальными или почти нормальными антигенными и функциональными уровнями C1INH.
НАО вследствие недостаточности C1INH представлен двумя типами ангиоотеков и подразделяется на основании антигенного уровня C1INH: НАО типа 1 (НАО-1) характеризуется низкими антигенными и функциональными уровнями C1INH, в то время как НАО типа 2 (НАО-2) возникает вследствие дисфункции C1INH и характеризуется нормальным (или) повышенным антигенным, но пониженным функциональным уровнем C1INH.
В свою очередь существует два подтипа НАО с нормальным уровнем C1INH: НАО, возникающий по причине мутации фактора XII свертываемости крови, и НАО, возникающий по неизвестной причине. Первый подтип ранее называли эстрогензависимым вариантом ангиоотека, на сегодняшний день выделяют группу пациентов с рецидивирующим ангиоотеком и семейным анамнезом заболевания, у которых была выявлена мутация в гене, кодирующем XII фактор свертываемости крови, локализованная в V хромосоме [3–4]. Наличие указанного генетического дефекта влечет за собой нарушение кининового профиля, что приводит к повышению продукции брадикинина. На сегодняшний день имеются скудные данные о подтипе НАО, возникающего по неизвестной причине, по той же причине он не внесен в официальную классификацию [2, 4].
Брадикинин является медиатором, ответственным за возникновение ангиоотека у пациентов с НАО [7]. Далее, говоря о НАО, мы будем учитывать, что на сегодняшний день эта группа изолированных ангиоотеков классифицируется как брадикининовые ангиоотеки. Брадикинин – это олигопептид, вырабатываемый при активации контактной системы, который может потенциально повышать сосудистую проницаемость путем связывания со своим рецептором (BKR2) на эндотелиальных клетках сосудов. В зависимости от фармакологических свойств выделяют 2 подтипа рецепторов к брадикинину: BKR1 и BKR2. Брадикинин расщепляется из высокомолекулярного кининогена калликреином плазмы, который физиологически продуцируется из зимогена посредством активации фактора XII свертываемости крови при активации контактной системы. Механизм, который приводит к активации контактной системы in vivo, на сегодняшний день не изучен. В свою очередь С1INH на нескольких этапах участвует в контроле активации контактной системы, являясь важным ингибитором фактора XII и калликреина плазмы. При пониженном уровне или нарушении функции C1INH может возникнуть выброс брадикинина с образованием ангиоотека [7, 8].
После воздействия инициирующего фактора недостаточность C1INH ведет к неадекватной выработке брадикинина – повышается сосудистая проницаемость, вызывая расширение сосудов, сокращение висцеральной гладкой мускулатуры и последующий выход жидкости в ткани, вызывающий незудящий отек. Таким образом, в плазме пациентов с брадикининовыми ангиоотеками наблюдается высокий уровень брадикинина ввиду недостаточности C1INH.
Обычно НАО дебютирует в первые 2 десятилетия жизни – чаще в пубертатном периоде. Частота приступов – в значительной степени варьирующийся показатель. Чаще всего симптомы заболевания начинают беспокоить пациента в детстве [5], но более активно заболевание обычно проявляется в период полового созревания [9].
К потенциальным триггерам обострения относятся механическая травма, интенсивность которой может быть разной – от легкого сдавления одеждой или легкого ушиба до перелома кости; хирургическое вмешательство; малоинвазивные диагностические процедуры; экстракция зуба; лекарственные препараты (ингибиторы АПФ; оральные контрацептивы, содержащие эстроген; препараты гормональной заместительной терапии), инфекции, стресс, алкоголь. Для изолированных брадикининовых ангиоотеков характерна определенная динамика симптомов: отеки достаточно медленно нарастают в течение 12–36 часов и разрешаются в течение 2–5 дней, а абдоминальные симптомы исчезают в течение 12–24 часов.
Клинические проявления НАО характеризуются рецидивирующими отеками различной локализации: кожи лица (губы, периорбитальная область), шеи, туловища, конечностей, слизистых оболочек верхних отделов дыхательных путей, желудочно-кишечного (приступообразная боль в животе) и урогенитального трактов. Приступы могут длиться от 72 до 96 часов и часто протекают в тяжелой форме, тем самым снижая дееспособность, качество жизни пациентов, и могут быть сопряжены со значительными осложнениями и риском смерти [5, 9].
Рецидивирующие периферические и абдоминальные отеки характеризуют около половины всех приступов, но у более чем 50% пациентов в течение жизни происходит хотя бы один приступ со стороны верхних дыхательных путей с риском асфиксии. Многие атаки начинаются с продрома или ауры – обычно это дрожь, покалывание, слабость, разбитость, мраморность кожи. Зуд и крапивница для НАО не характерны, однако примерно треть всех случаев ангиоотека сопровождается гигантской кольцевидной эритемой (erithemaannulare), обильными бледными высыпаниями мультиформного характера без зуда, жжения и местной гиперемии. Продромальный период предшествует приступу за несколько часов или за день (продолжительность предшествующих симптомов – до 1 дня) у 50% пациентов с НАО [5].
Диагностика
Лабораторными критериями диагноза НАО являются: