если алт повышен к какому врачу
Печень под угрозой
Считается, что есть безопасные дозы алкоголя и в интернете можно найти нормы, как будто рекомендуемые всемирной организацией здравоохранения. На самом деле ВОЗ предупреждает, что безопасной дозы алкоголя не существует.
Нередко человек просто не догадывается о проблемах с печенью, поскольку этот орган весьма терпелив – и пока основательно не пострадает, старается ничем не выдать имеющихся проблем. Поэтому лучше периодически проверять состояние печени.
Будет ли печень болеть, если превышать безопасную норму употребления алкоголя?
Поскольку в печени нет нервных окончаний, она долгое время «помалкивает». Неприятные ощущения тяжести в правом подреберье, боли и дискомфорт могут появиться из-за растяжения капсулы печени, когда ее размеры увеличиваются. Что касается желтухи, кожного зуда, темной мочи и светлого кала, то эти симптомы могут быть признаками гепатита – повреждения и воспаления клеток печени инфекционного или токсического происхождения. Более частый симптом заболеваний печени – это упадок сил и повышенная усталость, но поскольку такой признак может быть при многих других заболеваниях. Если тягостные симптомы беспокоят, то нужно обследоваться. Особенно важно это делать тем, кто не придерживается принципов здорового образа жизни или вынужден длительно принимать лекарства.
Как не упустить болезнь печени? Какие анализы надо сдавать регулярно?
Различных тестов на болезни печени много. Какой анализ самый точный?
Анализы крови на общий, прямой и непрямой билирубин служат важным маркером оценки функции печени. Их обычно назначают при появлении желтухи, а также при подозрении на заболевания печени (например, гепатит).
Аланинаминотрансфераза (АЛТ) – это фермент печеночных клеток. При повреждении клеток печени, уровень АЛТ в крови поднимается. Причем, это происходит задолго до появления желтухи. Существенное (более, чем в 10 раз) повышение уровня АЛТ обычно связано либо с острым вирусным гепатитом, либо с острым токсическим поражением печени. Умеренный рост АЛТ (в несколько раз) характерен для хронических вирусных гепатитов, нарушения оттока желчи и хронических заболеваний гепато-билиарной зоны, а также злоупотребления алкоголем и поражений печени при инфекционных заболеваниях.
Второй фермент–аспартатаминотрансфераза (АСТ) – менее показателен, но важен в комплексной диагностике функции печени. Его обычно назначают вместе с анализом на АЛТ.
Повышение щелочной фосфатазы (ЩФ) может наблюдаться при нарушении оттока желчи и других заболеваниях печени, а также при любых формах холестаза (затруднения желчеотделения).
ГГТ (гамма-глутамилтрансфераза) — фермент, участвующий в метаболизме аминокислот. Его повышенная концентрация в сыворотке крови чаще всего является маркером затруднения оттока желчи, а также интоксикации, вызванной алкоголем или лекарственными препаратами. Анализ крови на ГГТ важен для диагностики многих заболеваний печени.
Почему нет одного теста, для оценки функции печени всегда предлагают сдать комплекс анализов?
Если алт повышен к какому врачу
Аланинаминотрансфераза (АЛТ) – фермент, который находится во всех клетках организма, главным образом в печени и почках, меньше его в сердце и мышцах. В норме активность АЛТ в крови очень низкая. При проблемах с печенью фермент высвобождается в кровоток обычно еще до появления таких характерных симптомов, как желтуха. В связи с этим АЛТ часто используется как показатель повреждения печени.
Глутамат-пируват-трансаминаза, глутамат-пируват-трансаминаза в сыворотке, СГПТ.
Синонимы английские
Alanine aminotransferase, Serum glutamic-pyruvic transaminase, SGPT, Alanine transaminase, AST/ALT ratio.
УФ кинетический тест.
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Венозую, капиллярную кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Аланинаминотрансфераза (АЛТ) – это фермент, который присутствует главным образом в клетках печени и почек и в заметно меньших количествах в клетках сердца и мышц. У здоровых людей активность в крови невелика, норма АЛТ имеет низкие значения. При поражении клеток ткани печени АЛТ высвобождается в кровоток обычно еще до появления таких характерных симптомов, как желтуха. В связи с этим активность данного фермента используется в качестве показателя повреждений печени. Вместе с другими исследованиями, выполняющими те же задачи, анализ на АЛТ входит в состав так называемых печеночных проб.
Печень является жизненно важным органом, который расположен в верхней правой части брюшной полости. Она участвует в осуществлении многих важных функций организма – в переработке питательных веществ, производстве желчи, синтезе белков, таких как факторы свертывающей системы крови, а также расщепляет потенциально токсичные соединения до безопасных веществ.
Ряд заболеваний приводит к повреждению клеток печени, что способствует повышению активности АЛТ.
Наиболее часто анализ на АЛТ назначают, чтобы проверить, не повреждена ли печень при гепатите и приеме лекарственных препаратов либо иных веществ, которые являются токсичными для данного органа. Однако АЛТ не всегда отражает только повреждения печени, активность этого фермента может повышаться и при заболеваниях других органов.
АСТ и АЛТ считаются двумя наиболее важными показателями повреждений печени, хотя АЛТ более специфичен, чем АСТ. В некоторых случаях АСТ напрямую сопоставляется с АЛТ и вычисляется их соотношение (АСТ/АЛТ). Оно может использоваться для выявления причин повреждения печени.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Референсные значения (норма АЛТ для мужчин, женщин и детей):
Возраст, пол
Референсные значения
Причины повышенной активности АЛТ:
При большинстве заболеваний печени активность АЛТ выше активности АСТ, так что соотношение АСТ/АЛТ будет низким. Однако существует несколько исключений: алкогольный гепатит, цирроз и повреждение мышц.
Кто назначает исследование?
Врач общей практики, терапевт, гастроэнтеролог, инфекционист, гематолог, эндокринолог, хирург.
АЛТ и АСТ повышены в крови: причины у женщин и мужчин, что значит и о чем говорит
Анализ на определение уровня АЛТ и АСТ назначают для диагностики различных заболеваний. Повышение значений наблюдается при нарушении функций печени, миокарда, некрозе, травматическом шоке.
АЛТ и АСТ — что это?
АЛТ (АлАТ) — аланинаминотрансфераза, фермент, который участвует в транспортировке аминокислоты алатин. Содержится во всех клетках, в больших количествах — в сердечной и других мышцах, в печени, почках и поджелудочной железе.
АСТ — фермент, необходимый для транспортировки аминокислоты аспартат. Содержится в клетках печени, почек, миокарде и скелетных мускулах.
Оба вида белка проникают в кровь только при некрозе и разрушении клеток. Поэтому эти ферменты часто называют маркерами повреждений.
Нормальные показатели ферментов (в Ед/л):
У взрослых людей допускается отклонение показателей в течении суток на 10-30%. Для мониторинга анализ проводят с минимальны интервалом 48 часов. У детей показатели приближаются к взрослым значениям после 12 лет.
Причины увеличения уровня АЛТ и АСТ
Увеличение уровня АЛТ свидетельствует о наличии воспалительных процессов, очагов некроза в организме.
Повышение показателей ферментов происходит при:
Показатели могут измениться при приеме нестероидных противовоспалительных средств, оральных контрацептивов, медикаментов на основе никотиновой кислоты, после сильных нервных потрясений. Изменения наблюдаются при длительном стрессе, злоупотреблении жирной и жареной пищей, алкогольными напитками.
На раннем сроке беременности уровень ферментов часто снижается. Преимущественно это связано с дефицитом витамина B6. Обычно показатели нормализуются во II, III триместре. Но если значения на поздних сроках значительно выше нормы, это может свидетельствовать о гестозе. Резкое снижение ферментов происходит при термальной стадии цирроза, острых поражениях печени, общем истощении.
АЛТ, АСТ после коронавирусной инфекции
Коронавирус, попадая в кровь, негативно влияет на работу всего организма, разрушает ткани и клетки различных органов. Печени приходится работать в усиленном режиме, чтобы нейтрализовать токсины. Это приводит к увеличению АЛТ, АСТ.
При коронавирусе показатели ферментов более 40 Ед/л. Это связано с тем, что вирус активно разрушает клетки печени, почек, миокарда, мышц. Другая причина — длительный или бесконтрольный прием антибиотиков.
Для выявления показателей ферментов назначают биохимический анализ крови. Направление может выписать кардиолог, гастроэнтеролог, эндокринолог, нефролог, гинеколог или ортопед. Этот анализ относится к методам первичной диагностики, на основании результатов точный диагноз не ставят. Дополнительно назначают тесты на вирусные гепатиты и гормоны щитовидной железы, УЗИ органов брюшной полости, ЭКГ и другие исследования сердца, биопсию печени.
Чтобы избежать погрешностей, необходимо правильно подготовиться к сдаче биоматериала:
Для выявления патологий значение имеет соотношение ферментов. Этот показатель называют коэффициентом доктора де Ритиса (DRr). Для подсчета количество АСТ делят на АЛТ. Для мужчин и женщин этот коэффициент одинаков. В норме составляет 1, 3, допустимые отклонения, если другие показатели в норме, 0,9-1,7.
При вирусном гепатите DRr меньше 1, при дистрофических процессах в печени — больше или равен 1. Если соотношение ферментов больше 2, уровень альбумина ниже 35 г/мл — это признак некроза печени. Показатели более 2 — признак инфаркта миокарда, алкогольного цирроза. Коэффициент де Ритса высчитывают только если уровень содержания ферментов в крови в несколько раз выше нормы.
Анализ крови на АЛТ, АСТ позволяет выявить вирусные гепатиты минимум за 2 недели до появления характерных симптомов болезни.
Клинические проявления при высоких показателях АЛТ, АСТ
Признаки высокого содержания ферментов в крови зависят от заболевания, которое стало причиной повышения показателей.
Но можно выявить несколько общих симптомов:
Как снизить показатели?
Чтобы снизить уровень АЛТ, АСТ, требуется комплексный подход, который включает медикаментозную терапию и диету.
Правильное питание — один из основных этапов успешного выздоровления. Основа рациона — нежирные сорта мяса и рыбы, крупы, овощи и фрукты. Нужно полностью отказаться от курения и алкоголя, вредной и тяжелой пищи. Питание дробное — принимать пищу 5-6 раз в день небольшими порциями, ужинать не позднее двух часов до сна. Показаны умеренные физически нагрузки, соблюдение питьевого режима.
Отклонение показателей АЛТ и АСТ от нормы не является заболеванием, но свидетельствует о наличии серьезных проблем со здоровьем. Чаще всего значения возрастают при болезнях печени, сердца, травмах, дистрофических и воспалительных процессах в организме.
Неалкогольная жировая болезнь печени: клиника, диагностика и лечение
В настоящее время неалкогольная жировая болезнь печени (НЖБП) является одним из самых распространенных заболеваний в гепатологии, приводящим к ухудшению качества жизни, инвалидизации и смерти. В первую очередь, это обусловлено высоким риском прогрессирова
В настоящее время неалкогольная жировая болезнь печени (НЖБП) является одним из самых распространенных заболеваний в гепатологии, приводящим к ухудшению качества жизни, инвалидизации и смерти. В первую очередь, это обусловлено высоким риском прогрессирования НЖБП с развитием неалкогольного стеатогепатита (НАСГ), печеночной недостаточности и гепатоцеллюлярной карциномы. Общая распространенность НЖБП в популяции колеблется от 10 до 40%, тогда как частота НАСГ составляет 2–4% [1, 2, 3].
Эпидемиология и патогенез НЖБП
Понятие НЖБП объединяет спектр клинико-морфологических изменений печени, представленных стеатозом, НАСГ, фиброзом и циррозом, развивающихся у пациентов, не употребляющих алкоголь в гепатотоксичных дозах (не более 40 г этанола в сутки для мужчин и не более 20 г — для женщин). НЖБП встречается во всех возрастных группах, но наибольшему риску ее развития подвержены женщины в возрасте 40–60 лет с признаками метаболического синдрома (МС) [4, 5].
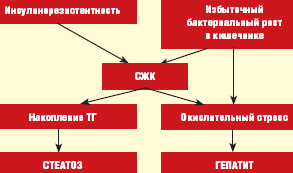
Патогенез НЖБП тесно связан с синдромом инсулинорезистентности (ИР), вследствие которого в печени накапливаются триглицериды (ТГ) и формируется жировой гепатоз (ЖГ) — первый этап или «толчок» заболевания. В последующем происходит высвобождение из жировой ткани и синтез de novo в гепатоцитах свободных жирных кислот (СЖК), способствующих возникновению окислительного стресса, являющегося вторым «толчком» заболевания и приводящего к развитию воспалительно-деструктивных изменений в печени в виде стеатогепатита [6].
Максимальный риск развития НЖБП отмечен в группе лиц с МС — это пациенты с сахарным диабетом (СД) 2 типа, ожирением, гипертриглицеридемией. Частота НЖБП у больных СД 2 типа и ожирением по данным различных исследований варьирует от 70 до 100%. При этом СД 2 типа или нарушение толерантности к глюкозе (НТГ) отмечаются у 10–75%, ожирение — у 30–100%, гипертриглицеридемия — у 20–92% пациентов с НЖБП [1, 4, 7, 8]. В то же время признаки НЖБП обнаруживаются у 10–15% людей без клинических проявлений МС, что может быть обусловлено другими патогенетическими механизмами формирования НЖБП, например, синдромом избыточной пролиферации бактерий в кишечнике или дисбиозом, как это принято формулировать в отечественной литературе [5, 10].
Основные механизмы развития НЖБП при кишечном дисбиозе связаны с нарушением синтеза апо-липопротеидов классов А и С, являющихся транспортной формой для ТГ в процессе образования липопротеидов очень низкой плотности (ЛПОНП), а также кишечным эндотоксикозом, что позволяет рассматривать это состояние в качестве дополнительного источника окислительного стресса (рис.) [11, 12].
Взаимосвязь патогенеза НЖБП с ИР позволяет считать это заболевание одним из независимых компонентов МС, клиническая значимость которого заключается в значительном прогрессировании атеросклеротического поражения сосудов.
В ряде работ показано, что НЖБП повышает риск возникновения сердечно-сосудистых заболеваний (ССЗ) независимо от других предикторов и проявлений МС [13]. Это подтверждается несколькими фактами, к которым относится связь НЖБП с концентрацией адипонектина в плазме. Известно, что адипонектин обладает антиатерогенным действием и по данным многих проспективных исследований снижение его уровня является ранним предиктором ССЗ и МС. У пациентов с НЖБП была отмечена более низкая концентрация адипонектина в плазме, чем у здоровых лиц [13].
Кроме этого, у указанной категории больных по сравнению с контрольной группой отмечается значительное увеличение толщины интимы (ТИ) сонной артерии, которое также признано достоверным субклиническим признаком атеросклероза. Доказано, что величина ТИ менее 0,86 мм связана с низким риском ССЗ, а более 1,1 — с высоким. У пациентов с НЖБП ее значение составляет в среднем 1,14 мм [14–18].
Другим субклиническим признаком атеросклероза, обнаруженным у больных НЖБП, служит выявление эндотелиальной дисфункции, что подтверждается снижением эндотелийзависимой вазодилатации плечевой артерии у пациентов с НЖБП. При этом уменьшение этого показателя коррелирует со степенью морфологических изменений в печени независимо от пола, возраста, ИР и других компонентов МС [19, 20].
Таким образом, патогенез НЖБП неразрывно связан с МС, а сам факт развития указанной патологии изменяет прогноз для этих пациентов, как в виде прогрессирования печеночной недостаточности, так и в виде значительного увеличения частоты осложнений ССЗ.
Клиника и диагностика
В целом для НЖБП характерно бессимптомное течение, поэтому наиболее часто в практике врач сталкивается со случайно обнаруженным при биохимическом исследовании синдромом цитолиза. При этом пациент с НЖБП, как правило, либо не предъявляет жалоб, либо они являются неспецифичными в виде астеновегетативного синдрома (слабость, утомляемость) и дискомфорта в правом подреберье. Наличие кожного зуда, диспепсического синдрома, наряду с развитием желтухи и портальной гипертензии, свидетельствует о далеко зашедшей стадии НЖБП [2, 3].
При объективном осмотре больных НЖБП обращают на себя внимание гепатомегалия, которая встречается у 50–75%, и спленомегалия, выявляемая у 25% пациентов [4].
При лабораторном исследовании для НЖБП характерны следующие изменения:
Основным дифференциальным отличием ЖГ от НАСГ, доступным в клинической практике, может быть выраженность биохимического синдрома цитолиза.
Следует отметить, однако, что отсутствие изменений лабораторных показателей, характеризующих функциональное состояние печени (АЛТ, АСТ, ЩФ, ГГТП), не исключает наличия воспалительно-деструктивного процесса и фиброза [10].
Как указывалось выше, диагностический поиск проводится в связи с выявлением у больного синдрома цитолиза, при этом наличие у него СД 2 типа, абдоминального ожирения, артериальной гипертензии и нарушения липидного обмена свидетельствует о высокой вероятности НЖБП. Постановка этого диагноза достаточно сложна ввиду необходимости исключения всех других причин, вызывающих цитолиз, макровезикулярный стеатоз и воспалительно-деструктивные изменения в печени. Следует исключить вторичный характер поражения печени (табл. 1) [2].
Для уточнения диагноза могут использоваться инструментальные методы (ультразвуковое исследование (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ)), которые позволяют верифицировать гепатомегалию, косвенно оценить степень стеатоза печени и зарегистрировать формирование портальной гипертензии.
УЗИ является недорогим и, по мнению некоторых авторов, достаточно информативным инструментальным методом диагностики стеатоза печени. Выделяют 4 основных ультразвуковых признака стеатоза печени:
К преимуществам УЗИ относится также возможность регистрировать динамику признаков стеатоза, в том числе на фоне лечения [20].
При проведении КТ печени основными признаками, свидетельствующими о наличии стеатоза, являются:
В целом КТ менее информативна, чем УЗИ при диффузных поражениях печени, однако она является методом выбора при очаговых заболеваниях [23].
Преимуществами современной высокопольной МРТ по сравнению с другими методами визуализации являются: высокая тканевая контрастность изображения за счет выгодного соотношения сигнал–шум, возможность получения целостного изображения органа в любой проекции, а также большие ресурсы программного обеспечения, используемые для дифференциальной диагностики.
Однако все визуализационные методы диагностики, несмотря на достаточно высокую информативность, не позволяют оценить наличие признаков стеатогепатита, степень его активности и стадию фиброзных изменений в печени [24, 25]. Поэтому с целью верификации диагноза необходимо проведение пункционной биопсии.
Значение пункционной биопсии печени в клинической практике неоднозначно. С одной стороны, только биопсия печени позволяет провести дифференциальный диагноз между стеатозом и стеатогепатитом, оценить стадию фиброза и на основании гистологических данных прогнозировать дальнейшее течение заболевания, а также исключить другие причины поражения печени. Однако отсутствие информированности врачей о целесообразности, а пациентов о безопасности метода сдерживают активное внедрение пункционной биопсии в практику.
Помимо этого, до сих пор активно обсуждаются морфологические критерии НЖБП. До настоящего времени в практике широко использовалась классификация, предложенная Brunt Е. (1999, 2001), которая подразделяет НЖБП в зависимости от степеней стеатоза, активности воспаления и стадии фиброза печени:
I. Степени крупнокапельного стеатоза:
0 степень: нет стеатоза;
1 степень: стеатоз до 33% гепатоцитов;
2 степень: стеатоз 33–66% гепатоцитов;
3 степень: стеатоз более 66%.
II. Степени НАСГ:
1 степень (мягкий НАСГ) — стеатоз 1–2 степени, минимальная баллонная дистрофия в 3 зоне ацинуса, лобулярное воспаление — рассеянная или минимальная лимфоплазмоцитарная инфильтрация, портальное воспаление отсутствует или минимальное;
2 степень (умеренный НАСГ) — стеатоз любой степени (крупно- и мелкокапельный), умеренная баллонная дистрофия в 3 зоне ацинуса, мягкое или умеренное портальное и лобулярное воспаление в 3 зоне ацинуса, может быть перисинусоидальный фиброз;
3 степень НАСГ (тяжелый НАСГ) — панацинарный стеатоз (смешанный), выраженная баллонная дистрофия, выраженное лобулярное воспаление, мягкое или умеренное портальное воспаление.
III. Стадии фиброза:
1 стадия — перисинусоидальный/перицеллюлярный фиброз в 3 зоне ацинуса, очаговый или распространенный;
2 стадия — перисинусоидальный/перицеллюлярный фиброз в 3 зоне ацинуса, очаговый или распространенный перипортальный фиброз;
3 стадия — очаговый или распространенный мостовидный фиброз;
4 стадия — цирроз печени [26].
Однако, по мнению ряда авторов, эта классификация не отражает целый спектр морфологических признаков, выявляемых у больных НЖБП при гистологическом исследовании. Недавно на основе существующей классификации была разработана и предложена Шкала активности НЖБП (NAFLD activity score — NAS), представляющая комплексную оценку морфологических изменений в баллах и объединяющая такие критерии, как стеатоз (0–3), лобулярное воспаление (0–2) и баллонную дистрофию гепатоцитов (0–2). Сумма баллов менее 3 позволяет исключить НАСГ, а более 5 свидетельствует о наличии у пациента гепатита. Данная шкала используется преимущественно для оценки эффективности лечения НЖБП, поскольку позволяет определить достоверность динамики морфологических изменений на фоне терапии за относительно короткий период времени [27].
В тех случаях, когда выполнение пункционной биопсии невозможно, диагноз НЖБП устанавливается в соответствии с алгоритмом, позволяющим пошагово исключить другие заболевания печени (табл. 2).
В связи с тем, что все пациенты с МС относятся к группе риска развития НЖБП, то больные с ожирением, СД 2 типа или НТГ, нарушением липидного обмена нуждаются в дополнительном обследовании, включающем клинические, лабораторные и инструментальные методы диагностики НЖБП и, в особенности, НАСГ. Однако до настоящего времени НЖБП и ее проявления не входят ни в критерии постановки диагноза МС, ни в алгоритм обследования больных с подозрением на его наличие (табл. 3).
Скрининг больных на стадии доклинических проявлений МС включает:
С учетом частоты, роли и значения НЖБП, в алгоритм обследования больных с МС должны входить клинико-лабораторные и инструментальные методы, позволяющие оценить морфофункциональное состояние печени:
Обязательными показаниями для биопсии являются:
Оценивать течение НЖБП возможно на основании данных гистологического исследования печени. Однако когда выполнение биопсии недоступно, существуют предикторы, позволяющие предположить высокий риск прогрессирования НЖБП с развитием гепатита и фиброза, которые были установлены при проведении статистической обработки результатов большого количества наблюдений [28–30].
Выявление более 2 критериев свидетельствует о высоком риске фиброза печени.
Для формулировки полноценного клинического диагноза необходимо учитывать данные клинико-лабораторного и инструментального обследования, выявление факторов неблагоприятного течения заболевания и других компонентов МС. Поскольку диагноз «неалкогольная жировая болезнь печени» в МКБ-10 (ВОЗ, 1998) пока отсутствует, его формулировка практическими врачами может производиться с учетом правил диагностики алкогольной болезни печени и вирусных гепатитов. В диагнозе на первом месте лучше указывать ту нозологическую единицу, на фоне которой развилась НЖБП, далее идет форма заболевания (гепатоз или НАСГ), степень стеатоза (по данным УЗИ), активность гепатита и стадия фиброзных изменений в печени в случае проведения гепатобиопсии. Если морфологическое исследование не выполнялось, допустимым, как и при других заболеваниях печени, является заключение: неустановленный фиброз. Примеры диагностических заключений:
Лечение НЖБП
В связи с высокой вероятностью неблагоприятного течения НЖБП, особенно в сочетании с другими проявлениями МС, все больные независимо от тяжести заболевания нуждаются в динамическом наблюдении и лечении. Однако до сих пор не разработаны стандартизированные терапевтические подходы к ведению пациентов с НЖБП.
Используемые направления терапии больных НЖБП основываются на механизмах развития заболевания, к которым в первую очередь относятся синдром ИР и окислительный стресс, поэтому наиболее важными задачами у данной категории пациентов являются:
Диета. С учетом современных представлений об этиологии, патогенезе и факторах прогрессирования НЖБП больным рекомендуются следующие диетические принципы:
Для пациентов с избыточной массой тела и ожирением — снижение общей энергетической ценности пищевого рациона. Суточная калорийность подбирается индивидуально в зависимости от массы тела, возраста, пола, уровня физической активности с использованием специальных формул. Сначала рассчитывают количество калорий, необходимых для основного обмена:
18–30 лет: (0,06 × вес в кг + 2,037) × 240
31–60 лет: (0,034 × вес в кг + 3,54) × 240
старше 60 лет: (0,04 × вес в кг + 2,76) × 240
18–30 лет: (0,06 × вес в кг + 2,9) × 240
31–60 лет: (0,05 × вес в кг + 3,65) × 240
старше 60 лет: (0,05 × вес в кг + 2,46) × 240.
Полученное значение умножают на коэффициент физической активности (1,1 — низкая активность, 1,3 — умеренная, 1,5 — тяжелая физическая работа или активное занятие спортом) и получают калорийность суточного рациона. Для снижения массы тела из рассчитанной величины суточных энергозатрат вычитают 500–700 ккал. Однако минимальное потребление калорий в сутки должно быть не менее 1200 ккал для женщин и не менее 1500 для мужчин. Доказано, что снижение массы тела на 5–10% сопровождается уменьшением гепатоспленомегалии, активности АЛТ, АСТ и коррелирует с регрессированием стеатоза печени [4]. Следует учесть, что быстрая потеря веса может привести к развитию «острого» НАСГ с формированием портального фиброза, центральных некрозов на фоне значительного повышения воспалительной активности вследствие увеличения поступления СЖК в печень на фоне периферического липолиза [5, 31]. Для больных ожирением и НЖБП безопасным и эффективным является снижение массы тела на 500 г в неделю для детей и на 1600 г в неделю для взрослых [31].
Кроме этого, всем пациентам с НЖБП рекомендуется:
Физическая нагрузка. Обязательным условием лечения больных НЖБП является физическая нагрузка. Она оказывает положительный эффект на снижение массы тела и чувствительность к инсулину, при этом увеличивается поступление СЖК в мышечную ткань, где происходит их окисление, тем самым уменьшается ИР [4]. Степень снижения ИР, как правило, коррелирует с интенсивностью физических упражнений, которые рекомендуется проводить не менее 3–4 раз в неделю, продолжительностью 30–40 минут.
Повышение чувствительности клеточных рецепторов к инсулину. К базисным медикаментозным средствам лечения синдрома ИР у больных НЖБП могут быть отнесены инсулиновые сенситайзеры — бигуаниды (метформин) и тиазолидиндионы (пиоглитазон, росиглитазон) — препараты, повышающие чувствительность клеточных рецепторов к инсулину. Опыт применения данных лекарственных средств свидетельствует о положительном влиянии на клинико-морфологические проявления НЖБП в виде уменьшения активности показателей цитолитического синдрома, степени стеатоза и воспаления. Но в целом вопрос применения этих препаратов у больных НЖБП требует проведения дальнейших исследований, что обусловлено отсутствием адекватных методов контроля эффективности лечения (гепатобиопсия) в выполненных работах [32].
Гиполипидемические средства. Учитывая патогенез заболевания, у пациентов с НЖБП эффективным может оказаться применение гиполипидемических средств из группы фибратов. Однако результаты исследования с назначением клофибрата больным НЖБП показали его неэффективность [33]. Не следует забывать и о возможности развития фибрат-индуцированных гепатитов. В отношении статинов также существует ряд противопоказаний, связанных с их гепатотоксическим действием. В целом данные выполненных работ противоречивы и указывают на необходимость дальнейшего изучения возможности использования этих препаратов у пациентов с НЖБП.
Пентоксифиллин. Снижение концентрации тумор-некротизирующего фактора-a (TNFa) имеет значение для прогрессирования НЖБП. Обладая высокой биологической активностью, TNFa усиливает ИР и приводит к развитию окислительного стресса. Уменьшение его уровня в крови связано с регрессом клинических и морфологических проявлений НЖБП. Подобный эффект был обнаружен у пентоксифиллина. Назначение этого препарата у пациентов с НАСГ в суточной дозе 1200 мг на протяжении 12 месяцев было связано со снижением показателей цитолитического синдрома и достоверным улучшением гистологических показателей у 67% больных [34].
Антагонисты рецепторов ангиотензина II. Формирование данного подхода обусловлено ролью ангиотензина в прогрессировании НАСГ. Установлено, что он, способствуя пролиферации миофибробластов, клеточной миграции, синтезу коллагена и провоспалительных цитокинов, активирует процессы фиброгенеза в печени. Поэтому в настоящее время исследуется возможность применения блокаторов ангиотензиновых рецепторов у пациентов с НЖБП. Так, прием лозартана у пациентов с НАСГ и артериальной гипертензией в суточной дозе 50 мг в течение 38 недель приводил к достоверному снижению АЛТ и ГГТП, что сочеталось с уменьшением степени стеатоза и воспалительной активности [35].
Антиоксиданты. Применение антиоксидантов у больных НЖБП оправдано наличием окислительного стресса, что подтверждается повышением в плазме у больных НАСГ маркера окислительного стресса — тиоредоксина и снижением концентрации антиоксидантных факторов. В настоящее время активно изучается возможность использования витамина Е, эффективность которого была продемонстрирована в ряде исследований [36]. Также имеется ряд зарубежных и отечественных работ, посвященных оценке влияния УДК на морфофункциональное состояние печени. Механизмы действия этой гидрофильной кислоты связаны с тем, что, нормализуя гепатоэнтеральную циркуляцию желчных кислот и целого ряда биологически активных веществ, вытесняя токсичные желчные кислоты, она способствует ликвидации избытка холестерина в гепатоцитах, путем уменьшения его синтеза и всасывания из кишечника. УДК также обладает цитопротективным и антиапоптотическим действием, препятствуя развитию окислительного стресса, что позволяет применять ее на обоих этапах НЖБП [33].
В отношении АЛК установлено, что она обладает плейотропным действием на весь организм, оказывая положительное влияние на энергетический, липидный (тормозит синтез холестерина, подавляя высвобождение СЖК из жировой ткани, что предупреждает развитие стеатоза гепатоцитов) и углеводный (снижает ИР, усиливает захват и утилизацию глюкозы клеткой, повышает чувствительность клеточных рецепторов к инсулину) виды обменов.
Кроме этого, АЛК, имея низкий оксислительно-восстановительный потенциал, обладает мощным антиоксидантным эффектом, действуя непосредственно на печень, способствует повышению детоксицирующих субстанций в гепатоцитах (восстанавливает глутатион) и улучшению морфологических изменений [36].
Восстановление микробиоценоза кишечника. К сожалению, большинство работ, подтверждающих патогенетическую роль дисбиоза кишечника в формировании НЖБП и эффективность антибактериальных препаратов в лечении указанной нозологии, относится к 80–90-м годам прошлого столетия.
Поэтому вопрос проведения санации кишечника антибактериальными препаратами остается открытым. Антибиотики рекомендуются только при наличии верифицированной чувствительной условно-патогенной флоры в кишечнике или формировании заболевания после оперативного лечения на брюшной полости, например «синдрома приводящей петли». Преимуществом выбора при этом принадлежит препаратам, обладающим способностью хорошо накапливаться в желчи с эффектом вторичного прохождения через желудочно-кишечный тракт, к которым относятся фторхинолоны первого поколения (ципрофлоксацин). Также могут использоваться кишечные антисептики, типа метронидазола или нифуроксазид, и невсасывающиеся в кишечнике препараты, например рифаксимин.
Во всех остальных случаях, когда нет показаний для применения антибиотиков, кишечную санацию у больных НЖБП следует проводить пребиотиками, а препаратом выбора в данном случае является Эубикор. Его преимуществом является сбалансированный состав, куда входят пищевые волокна и винные дрожжи (S. vini). Кроме мощного пребиотического эффекта, Эубикор обладает хорошими сорбционными свойствами, что позволяет не только восстанавливать нормальную микрофлору, но и проводить дезинтоксикацию. По результатам исследований, прием Эубикора у данной категории пациентов способствовал дополнительному уменьшению дислипопротеидемии и повышению чувствительности к инсулину [37, 38].
Лечение неалкогольного ЖГ
В целом требования, предъявляемые к лекарственным средствам, используемым в лечении НЖБП, достаточно высоки. В первую очередь, они должны быть максимально безопасны с точки зрения гепатотоксичности, также желательно их позитивное действие на улучшение клинико-лабораторных и морфологических изменений в печени.
Собственный опыт лечения больных НЖБП на стадии гепатоза состоит в использовании комбинации АЛК с Эубикором. АЛК (препарат «Берлитион», производитель — Берлин-Хеми, Германия) назначалась по 600 ЕД внутривенно в течение 14 дней, с переходом на пероральный прием в той же суточной дозе, однократно в течение 6 месяцев. Эубикор назначался по 2 пакетика 3 раза в день во время еды. Результаты работы показали положительное влияние Берлитион и Эубикора не только на показатели липидного и углеводного обменов, но и на степень жировой дистрофии в печени по результатам ультразвукового и морфологического исследований. Положительная динамика указанных изменений имеет значение как для формирования системной ИР, являющейся основной причиной развития МС, так и для течения собственно НЖБП и развития НАСГ. Поэтому данные препараты, наряду с немедикаментозной терапией, могут рассматриваться как средства базисной терапии первой стадии НЖБП — ЖГ.
Лечение НАСГ
При развитии у пациентов НАСГ терапия заболевания усиливалась дополнительной комбинацией метформина (препарат «Сиофор», производитель — Берлин-Хеми, Германия) в дозе 1500 мг в сутки с УДК (препарат «Урсосан» фирмы PRO.MED.CS Praha a.s.) в дозе 15 мг на 1 кг массы тела, с однократным приемом через час после ужина. Длительность лечения подбиралась индивидуально, как правило, она составляла не менее 6 месяцев, иногда достигая 12 и более месяцев. Продолжительность курса зависела от выраженности клинических проявлений, комплайнса и динамики лабораторно-инструментальных показателей на фоне лечения. Назначение этих препаратов сопровождалось уменьшением не только клинико-лабораторных проявлений заболевания, но и достоверно способствовало улучшению гистологической картины печени. При этом комбинированная терапия у данной категории пациентов являлась методом выбора, поскольку именно в группе, получавшей одновременно Сиофор, Берлитион и Урсосан, динамика показателей синдромов цитолиза, холестаза, а также жирового и углеводного обменов была более значимой. На фоне лечения у больных НАСГ также отмечалось обратное развитие жировой дистрофии, достоверно уменьшилась выраженность воспалительных изменений и отсутствовало прогрессирование стадии фиброза в печени. Таким образом, комбинированная терапия воздействует на основные этиопатогенетические механизмы формирования метаболических нарушений, приводит к улучшению показателей липидного и углеводного обменов в виде нормализации уровней ЛПВП, ТГ и индекса ИР у пациентов с НАСГ.
Предложенная схема лечения НЖБП не является стандартизированной, но она патогенетически обоснована, а ее рабочий вариант может рассматриваться как применение:
На практике рациональный выбор того или иного препарата может определяться сочетанием НЖБП с другими компонентами МС.
Рекомендуемые алгоритмы выбора терапии пациентов с НЖБП и ожирением:
ИМТ менее 40 кг/м 2 :